Proyecto Terminal
Maestría en Nutrición Clínica
Valoración y Abordaje Nutricional
en Pacientes con Obesidad en
Protocolo de Trasplante Renal
L.N. Iván Armando Osuna Padilla
AGRADECIMIENTOS
En primer lugar agradezco a dios por darme la oportunidad de vivir ésta experiencia, por permitirme conocer a personas tan preparadas y por permitirme cumplir mis metas y objetivos personales y profesionales.
Agradezco infinitamente el apoyo de mi madre, quién me motivo y brindo apoyo incondicional en todo momento. Agradezco a mis hermanos por hacerme sentir cerca de casa, y por sus palabras de aliento en los momentos precisos.
Agradezco a mis amistades, a Patty, Claudia y Mónica de manera especial, por formar parte de mi familia y de mi vida, y compartir esta experiencia a mi lado.
Agradecer a mis maestros, por sembrarme la semilla del conocimiento e impulsar en mí la necesidad de seguirme preparando, así como aportar mi granito de arena desempeñándome como docente para continuar transmitiendo este mundo de conocimientos.
Tabla de Contenidos
Epidemiología de la Enfermedad Renal Crónica ... 1
Factores de Riesgo de Enfermedad Renal Crónica ... 3
Fisiopatología de la Enfermedad Renal Crónica ... 7
Diagnostico de la Enfermedad Renal Crónica ... 15
Clasificación de la Enfermedad Renal Crónica ... 16
Tratamiento de la ERCT ... 18
Hemodiálisis ... 18
Diálisis Peritoneal ... 20
Trasplante ... 21
Relación de la enfermedad con la Nutrición ... 24
ERCT e Inflamación ... 24
ERCT y Desnutrición ... 27
ERCT y Riesgo Cardiovascular ... 30
ERCT y Obesidad ... 32
Obesidad y Trasplante Renal ... 33
Proceso de Cuidado Nutricio ... 33
Evaluación del Estado Nutricional ... 34
Diagnóstico Nutricio ... 48
Terapia Medico Nutricia ... 49
Nuevas Evidencias ... 58
Descripción del Caso ... 61
Bibliografía ... 67
Anexo 1. Valores de Laboratorio en la ERC ... 75
Anexo 2. Principales signos de Desnutrición ... 80
Anexo 3. Signos y Síntomas de las anormalidades del Potasio ... 81
Anexo 4. Clasificación del Edema ... 82
Anexo 5. Interacciones Medicamento-Nutrimento ... 83
Anexo 6. Interpretación del Porcentaje de Adecuación Energética y de Nutrimentos ... 84
Anexo 7. Interacciones Alimento-Medicamento ... 85
ÍNDICE DE TABLAS Y FIGURAS
Figura 1. Representación esquemática de los factores que intervienen en la patogénesis del
hiperparatiroidismo secundario a la ERC. 10
1
Epidemiología de la Enfermedad Renal Crónica
La enfermedad renal crónica (ERC) es resultante de diversas enfermedades crónico-degenerativas, entre las que destacan la diabetes mellitus y la hipertensión arterial, fenómeno que ocurre de manera similar en todo el mundo y que, lamentablemente, conduce hacia un desenlace fatal si no es tratada. Las cifras de morbilidad y mortalidad son alarmantes; en México, esta es una de las principales causas de atención en hospitalización y en los servicios de urgencias. La ERC se encuentra entre las primeras 10 causas de mortalidad general en el Instituto Mexicano del Seguro social (IMSS), ocupa la octava causa de defunción del varón de edad productiva y la sexta en la mujer de 20 a 59 años, mientras que por demanda de atención en los servicios de urgencias del segundo nivel de atención ocupa el décimo tercer lugar, el noveno en las unidades de tercer nivel y el octavo como causa de egreso hospitalario por defunción1.
A nivel mundial, el número de pacientes con ERC se está incrementando marcadamente, especialmente en adultos, por lo que la ERC se ha reconocido actualmente como uno de los principales problemas de salud pública que amenaza con llegar a ser una epidemia de gran magnitud en la próxima década2. El costo de cualquiera de las modalidades de terapia de
remplazo para la ERCT es en general elevado y representa un reto económico para las instituciones de salud publicas en muchos países 3.
Actualmente, México no cuenta con un registro nacional de enfermos renales crónicos, pero si aplicamos el porcentaje promedio de habitantes enfermos en otros países (que equivale al 0.1 % de la población), podemos estimar que hay más de 102 000 enfermos renales crónicos en el país, de los cuales solo 37 000 cuentan con algún tratamiento sustitutivo de manera continua4. Otros autores estiman una incidencia de pacientes con ERC de 377 casos
por millón de habitantes y la prevalencia de 1 142; con aproximadamente 52 000 pacientes en terapias sustitutivas, de los cuales el 80% de los pacientes son atendidos en el IMSS1.
2 A principios del 2008, se implementó en la Ciudad de México y en Jalisco una fase piloto del Programa de Evaluación Temprana del Riñón, KEEP (Kidney Early Evaluation Program), por sus siglas en ingles, el cual es un programa de detección oportuna de la enfermedad renal, ofrecido por las Fundación Nacional del Riñón (National Kidney Foundation) para personas que tienen riesgo de desarrollar insuficiencia renal. Se evaluaron a 1519 pacientes en la Ciudad de México, y 2020 en Jalisco, encontrando una prevalencia de ERC en el 22 % de la población participante para la Ciudad de México, y 33 % en Jalisco. Al analizar los factores de riesgo de los participantes, encontraron diversos grados de ERC en el 38% de los participantes con diagnostico de diabetes y en 42 % de los participantes con diabetes e hipertensión6.
Los estudios epidemiológicos, que se han realizado han puesto en evidencia que la enfermedad renal terminal (ERCT) representa la punta del iceberg de la ERC y sugieren que aquellos pacientes en estadios tempranos exceden al menos 50 veces a aquellos con ERCT2.
Las estadísticas de mortalidad en el año 2005, en México, mostraron que la ERCT fue, por si misma, la decima causa de muerte a nivel nacional. De acuerdo con datos disponibles en el país, se han realizado estimaciones de aproximadamente 129 mil pacientes con ERCT, por lo que se esperaría alrededor de 6.45 millones de personas con ERC en etapas tempranas3.
3
Factores de Riesgo de Enfermedad Renal Crónica
La ERC se debe a una pérdida progresiva e irreversible de un gran número de nefronas funcionales. En general, la ERC puede aparecer por un trastorno de los vasos sanguíneos, los glomérulos, los túbulos, el intersticio renal y la vía urinaria inferior. A pesar de esta amplia variedad de enfermedades que pueden provocar una ERC, el resultado final es prácticamente el mismo: una reducción del número de nefronas funcionales. A principios de la década de los ochenta se creía que la glomerulonefritis en todas sus formas era la causa inicial más común de la nefropatía terminal. En los últimos años, la diabetes mellitus y la hipertensión han pasado a reconocerse como las principales causas de nefropatía terminal, responsables en conjunto de alrededor del 70% de todas las enfermedades renales crónicas. Se ha encontrado que el aumento de peso excesivo es el factor de riesgo más importante de estas dos principales causas de nefropatía terminal8.
Muchos tipos de lesiones vasculares dan lugar a una isquemia renal y a la muerte del tejido renal. Las más comunes son: 1) la aterosclerosis de las arterias renales grandes con una constricción esclerótica progresiva de los vasos; 2) la hiperplasia fibromuscular de una o más de las arterias grandes, que también obstruye los vasos, y 3) la nefroesclerosis, causada por lesiones escleróticas de las arterias pequeñas, las arteriolas y los glomérulos8.
4 frecuencia y gravedad de la nefroesclerosis y de la glomeruloesclerosis aumentan mucho con una HTA y DM concurrentes 8.
La glomerulonefritis crónica puede deberse a varias enfermedades que producen inflamación y lesión en las asas capilares de los glomérulos renales. Al contrario que la forma aguda de esta enfermedad, la glomerulonefritis crónica es una enfermedad lentamente progresiva que lleva a menudo a una enfermedad renal irreversible. Puede ser una nefropatía primaria, tras una glomerulonefritis aguda, o secundaria a una enfermedad sistémica, como el lupus eritematoso. En la mayoría de los casos, la glomerulonefritis crónica comienza con la acumulación de complejos antígeno-anticuerpo precipitados en la membrana glomerular. Los resultados de la acumulación de complejos antígeno anticuerpo en las membranas glomerulares son la inflamación, el engrosamiento progresivo de las membranas y la invasión final de los glomérulos por tejido fibroso. En los últimos estadios de la enfermedad, el coeficiente de filtración capilar glomerular se reduce mucho por un número de capilares filtradores en los penachos glomerulares y por un engrosamiento de las membranas glomerulares. En los estadios finales de la enfermedad, muchos glomérulos son sustituidos por tejido fibroso y, por tanto, son incapaces de filtrar líquido 8.
Las enfermedades primarias o secundarias del intersticio renal se denominan nefritis intersticial. Pueden deberse, en general, a lesiones vasculares, glomerulares o tubulares que destruyen nefronas individuales, o pueden consistir en una lesión primaria del intersticio renal por tóxicos, fármacos e infecciones bacterianas8.
Las causas más importantes de ERC son: diabetes mellitus 44.9 % (DM tipo 1 en un 3.9%, DM tipo 2 en un 41 %), HTA 27.2 %, glomerulonefritis 8.2 %, nefritis crónica intersticial 3.6 %, trastornos hereditarios 3.1 %, vasculitis o glomerulonefritis secundaria 2.1 %, y otras causas un 11.2 % 9.
5 vascular hipertensiva y las nefropatías tubulointersticiales lo hacen más lentamente. En general las nefropatías con más proteinuria progresan con mayor rapidez a la insuficiencia renal terminal que las nefropatías no proteinúricas 10.
Pero además de estos factores de progresión dependientes de la etiología, se han identificado varios factores comunes a todas ellas y que pueden acelerar la evolución de la enfermedad renal. La mayor parte de los factores de progresión de la enfermedad renal son también factores clásicos de riesgo cardiovascular global, como también lo es la propia ERC. Por este motivo, la corrección de estos factores tendrían un doble efecto positivo sobre los pacientes: no solo frenaría el deterioro de la enfermedad renal, sino que además contribuiría a mejorar el elevado riesgo cardiovascular asociado a la ERC10.
En comparación con la población general, los pacientes con ERC tienen mayor riesgo de morir, y de padecer enfermedades cardiovasculares. Datos recientes indican que los pacientes con ERC tienen de 5 a 10 veces más probabilidad de morir que de progresar a la ERCT. Es especialmente evidente que uno de los grandes saltos en la mortalidad ocurre entre el estadio 3 y el 4. Esta gran variabilidad en la mortalidad se debe a que el desarrollo del estado urémico inicia una vez que la TFG es menor de 60 ml/min/1.73 m2 e incrementa conforme la función renal disminuye. Por lo tanto, los pacientes con TFG cercana a 30 ml/min/1.73 m2 tienen un grado distinto de cambios patológicos asociados a la uremia en comparación a los pacientes con TFG cercana a 59 min/1.73 m2. Cabe señalar que el riesgo de padecer eventos cardiovasculares también aumenta conforme disminuye la TFG estimada7.
6 El mecanismo específico por el cual la ERC puede aumentar el riesgo de muerte en general no se conoce; sin embargo, pueden hacerse varias consideraciones. La ERC con frecuencia coexiste con otros factores de riesgo cardiovascular, como dislipidemia, hipertensión, tabaquismo y diabetes, que se sabe, aumentan el riesgo de mortalidad en la población general7.
7
Fisiopatología de la Enfermedad Renal Crónica
Los riñones son un par de órganos encapsulados localizados en el espacio retroperitoneal. En el hilio de cada riñón ingresa una arteria renal y sale una vena renal. Aproximadamente 25% del gasto cardiaco va a los riñones. La sangre se filtra en los riñones para retirar los desperdicios, en particular la urea y los compuestos nitrogenados, y para regular los electrolitos extracelulares y el volumen intravascular. Debido a que el flujo renal se realiza desde la corteza hacia la médula, y debido a que ésta tiene un flujo sanguíneo relativamente escaso respecto a una tasa de actividad metabólica grande, la tensión normal de oxigeno en la medula es menor que en otras partes del riñón. Esto hace a la médula particularmente susceptible a la lesión isquémica11.
La enfermedad renal crónica (ERC) se define como una disminución de la función renal, expresada por un filtrado glomerular (FG) o por un aclaramiento de creatinina estimados <60 ml/min/1.73 m2, o como la presencia de daño renal de forma persistente durante al menos 3 meses. El daño renal se diagnostica habitualmente mediante marcadores en vez de por una biopsia renal, por lo que el diagnostico de ERC, ya se establezca por un FG disminuido o por marcadores de daño renal, puede realizarse sin conocimiento de la causa. El principal marcador de daño renal es una excreción urinaria de albúmina o proteínas elevada12.
La patogénesis de la enfermedad renal crónica ocasiona la perdida irreversible de las nefronas. Como resultados, menos nefronas cumplen una mayor carga funcional, y esto se manifiesta como un incremento en la presión de filtración glomerular e hiperfiltración. Por razones no bien comprendidas, esta hiperfiltración compensadora, la cual se puede considerar como una variante de “hipertensión” en el ámbito de la nefrona individual, predispone a la fibrosis y a la cicatrización. Como resultado se incrementan las velocidades de la pérdida y la destrucción de la nefrona, y esto acelera la progresión a la uremia, el complejo de síntomas y signos que tiene lugar cuando la función renal residual es inadecuada con una función renal residual inadecuada11.
8 grado de azoemia (aumento de las concentraciones sanguíneas de los productos normalmente excretados por los riñones). A pesar de esto, los pacientes pueden permanecer largamente asintomáticos debido a que logran un nuevo estado basal en el cual las concentraciones sanguíneas de estos productos no son lo bastante grandes como para producir intoxicación abierta. Sin embargo, incluso en este nivel aparentemente estable de función renal, se está en evolución hacia la enfermedad renal crónica en etapa terminal (ERCT) acelerada por la hiperfiltración11.
La patogénesis de la ERC deriva en parte de la combinación de los efectos tóxicos de:
- La retención de los productos normalmente excretados por los riñones (por ejemplo, productos nitrogenados provenientes del metabolismo proteínico)
- Productos normales como las hormonas presentes en mayores cantidades.
- La pérdida de los productos normales del riñón (por ejemplo, pérdida de la eritropoyetina).
La insuficiencia excretora también causa alteraciones de los líquidos, con incrementos en el sodio y el agua intracelulares, y disminución en el potasio intracelular. Estas modificaciones pueden contribuir a las transformaciones sutiles en la función de una gran cantidad de enzimas, sistemas de transporte, etc11.
Las manifestaciones clínicas de la ERC son varias, entre las más importantes destacan alteraciones del equilibrio y del volumen del Na+, alteraciones del equilibrio del K+, acidosis metabólica, alteraciones minerales y óseas, anormalidades cardiovasculares, pulmonares, neuromusculares, gastrointestinales, endócrinas, metabólicas y dermatológicas11.
9 La hiperpotasemia constituye un problema grave en los pacientes con ERC, especialmente en aquellos cuya TFG ha disminuido por debajo de 5 ml/min/1.732. Por arriba de este nivel, conforme disminuye la TFG, se incrementa, el transporte del K+ mediado por la aldosterona en el túbulo distal, en una modalidad compensadora. Sin embargo, esto significa que un paciente cuya TFG esta entre 50 y 5 ml/min/1.732 depende del transporte tubular para conservar el equilibrio del K+. Por tanto, el tratamiento con diuréticos ahorradores de K+ (inhibidores de la enzima convertidora de angiotensina) o β bloqueadores (fármacos capaces de deteriorar el transporte del K+ mediado por la aldosterona) puede precipitar una hiperpotasemia peligrosa en un paciente con ERC11.
Así como los pacientes con ERC son más susceptibles a los efectos de las sobrecargas de Na+ o del volumen, también están en mayor riesgo de una hiperpotasemia con las cargas súbitas de K+ de fuentes endógenas (hemólisis, infección, trauma) o de fuentes exógenas (sangre almacenada, alimentos abundantes en K+ o medicamentos con K+)11.
La disminución en la capacidad para excretar ácido y generar amortiguadores que tienen lugar en la ERC provoca acidosis metabólica. En la mayor parte de los casos, sí la TFG es mayor a 20 ml/min/1.732 solo se desarrolla una acidosis moderada antes del restablecimiento de un nuevo estado basal de producción y consumo de amortiguador. En estas personas la disminución en el pH sanguíneo por lo general se puede corregir con 2 a 3 g de bicarbonato de sodio por vía oral al día. Sin embargo, estos pacientes son muy susceptibles a la acidosis en el caso de una carga ácida súbita o del inicio de trastornos capaces de aumentar la carga de ácido generada11.
Como resultado de una compleja serie de eventos, se han observado varios trastornos del fosfato del Ca2+ y del metabolismo óseo en la ERC. Los factores cruciales en la patogénesis de estos trastornos incluyen:
La disminución en la absorción del Ca2+ a partir del intestino, la sobreproducción de hormona paratiroidea, trastornos en el metabolismo de la vitamina D, y la acidosis metabólica crónica11.
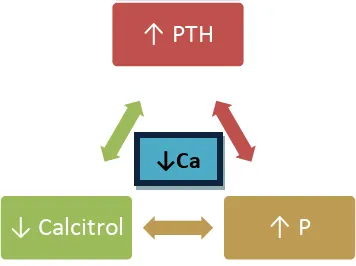
10 hiperfosfatemia contribuye al desarrollo de la hipocalcemia y, de esta manera, sirve como desencadenante adicional del hiperparatiroidismo secundario, con lo cual incrementa las concentraciones sanguíneas de la PTH. El aumento de la PTH sanguínea depleta adicionalmente el Ca2+ óseo y contribuye a la osteomalacia y a la osteoporosis de la ERC11.
[image:15.612.217.395.184.317.2](Ver Figura 1)
Figura 1. Representación esquemática de los factores que intervienen en la patogénesis del hiperparatiroidismo secundario a la ERC. Fuente: Rodriguez M, 1995
Se entiende por calcificación vascular la deposición de fosfato cálcico, en forma de cristales de bioapatita (similar al hueso), que puede ocurrir en los vasos sanguíneos y en las válvulas cardíacas. Clásicamente se consideraba que la calcificación vascular era un proceso pasivo y degenerativo que frecuentemente ocurría con la edad avanzada, aterosclerosis, varias alteraciones metabólicas (como DM y ERCT) y en raras enfermedades genéticas. Sin embargo, desde hace algunos años, la calcificación vascular es considerada como un proceso activo y regulado de manera semejante a la mineralización y metabolismo del hueso, en el que se encuentran implicadas diversas proteínas óseas13.
Existen estudios clínicos, epidemiológicos y experimentales que sugieren una relación entre las alteraciones del recambio óseo y la progresión de la calcificación vascular. La mayoría de ellos indican que un recambio óseo bajo se asocia con una mayor prevalencia y progresión de las calcificaciones vasculares. Se han identificado diversos factores que podrían ser mediadores y responsables de esta asociación. La mayoría de factores implicados en estos procesos son comunes y han sido implicados tanto en la formación y recambio óseo como en la génesis de las calcificaciones vasculares. Alguno de ellos podría ser el nexo entre ambas alteraciones. De ellos, la hiperfosfatemia es uno de los factores más estudiado y la mayoría de los resultados indican que, probablemente, desempeñe un
↑ PTH
↑ P ↓ Cal itrol
11 importante papel en el mantenimiento de una buena salud ósea y vascular, especialmente en pacientes con ERC14.
La insuficiencia cardiaca congestiva y el edema pulmonar se deben, con mayor frecuencia, a las sobrecargas del volumen y de sal. Sin embargo, también se presenta un síndrome, mal comprendido, que involucra el aumento en la permeabilidad de la membrana alvéolo-capilar, y el cual puede ocasionar edema pulmonar incluso con presiones en cuña normales o ligeramente aumentadas de los capilares pulmonares14.
La hipertensión constituye un hallazgo frecuente en la ERC, por lo general sobre la base de sobrecargas en el líquido y de Na+. Sin embargo, la hiperreninemia también constituye un síndrome reconocido en el cual la disminución en la perfusión renal desencadena la sobreproducción de renina a cargo del riñón insuficiente, y de esta manera incrementa la presión arterial sistémica11.
La pericarditis resultante de la irritación y de la inflamación del pericardio por las toxinas urémicas, constituye una complicación cuya incidencia en la ERC va en disminución debido a la institución agresiva y temprana de la diálisis renal13.
El aumento de riesgo cardiovascular es una complicación observada en pacientes con ERC y permanece como la causa principal de mortalidad en esta población. Esto favorece el infarto del miocardio, evento vascular cerebral y periférico. En estos pacientes los factores de riesgo cardiovascular incluyen la hipertensión, la hiperlipidemia, la intolerancia a la glucosa, el incremento crónico en el gasto cardiaco, y las calcificaciones valvular y miocárdica como consecuencias del incremento en el producto Ca2 x PO43-, así como otros
factores14.
12 trata con eritropoyetina. Entre las causas adicionales de anemia se pueden incluir los efectos supresores de la médula ósea a cargo de las toxinas urémicas, la fibrosis de la médula ósea debida al incremento en las PTH sanguínea, los efectos tóxicos del aluminio (por los antiácidos fijadores de fosfato y las soluciones de la diálisis), y a la hemólisis y la pérdida sanguínea gastrointestinal relacionada con la diálisis11.
La uremia se acompaña de un aumento en la susceptibilidad a las infecciones, la cual se estima se debe a la supresión del leucocito a cargo de las toxinas urémicas. Al parecer la supresión es mayor en las células linfoides que en los neutrófilos y también puede afectar la quimiotaxia, la respuesta inflamatoria aguda y la hipersensibilidad retardada, más que otras funciones del leucocito. También se estima que la acidosis, la hiperglucemia, la desnutrición y la hiperosmolaridad contribuyen a la inmunosupresión en la ERC. La invasividad de la diálisis y la utilización de inmunosupresores en los pacientes con trasplante renal, también contribuyen a la mayor incidencia de infecciones11.
Los síntomas y los signos del SNC pueden variar desde trastornos leves del sueño y deterioro de la concentración mental, perdida de la memoria, errores en el juicio e irritabilidad neuromuscular (manifestada por hipo, calambres, fasciculaciones y contracturas), todos leves, hasta asterixis, mioclono, estupor, convulsiones, y coma en la uremia en etapa terminal. La asterixis se manifiesta como movimientos ondulantes involuntarios que se presentan al extender los brazos y doblar las muñecas hacia atrás. Esto es resultado de la modificación en la conducción nerviosa de la encefalopatía metabólica debida a diversas causas entre las cuales se incluye la ERC11.
La neuropatía periférica (de predominio sensitiva; más intensa en las extremidades inferiores que en las superiores), caracterizada por el síndrome de “piernas inquietas” (sensación de molestia mal localizada y movimientos involuntarios en las extremidades inferiores) constituye un hallazgo frecuente en la ERC, y una indicación importante para iniciar la diálisis11.
13 gastroenteritis urémica, caracterizada por ulceraciones de la mucosa con perdida hemática, así como una variante distintiva de halitosis debido a la degradación de la urea en amoniaco a cargo de las enzimas salivales11.
En los pacientes urémicos los síntomas gastrointestinales inespecíficos incluyen anorexia, hipo, nauseas, vómitos y divertículos. Si bien no está clara la patogénesis precisa de estos síntomas, muchos de ellos mejoran con la diálisis11.
Las mujeres con uremia presentan concentraciones menores de estrógeno, lo cual quizá explica la gran incidencia de amenorrea y la observación de que rara vez pueden lograr un embarazo a término. De igual manera, en los varones con ERC las concentraciones bajas de testosterona, la disfunción eréctil, la oligospermia y la displasia de células germinales constituyen datos frecuentes11.
La resistencia a la insulina (RI) es una alteración de la respuesta biológica a la insulina, que se traduce en una disminución de la capacidad para ejercer sus acciones biológicas en los tejidos, especialmente en músculo, hígado y tejido adiposo. La RI conduce a una serie de alteraciones en la composición de los lípidos plasmáticos, coagulación, función endotelial, resistencias vasculares, cambios endocrinos y obesidad, que en conjunto incrementan el riesgo de desarrollo de hipertensión arterial y aterosclerosis acelerada. Este aumento de riesgo cardiovascular asociado a RI ha sido demostrado en la población general15.
Una alta proporción de pacientes con ERC muestran datos bioquímicos compatibles con RI, incluso en los estadios más tempranos de la enfermedad. Los mecanismos fisiopatológicos no son todavía bien conocidos. Las hipótesis se basan en que es una consecuencia de la uremia característica de la ERC, así como del incremento de las citocinas y mediadores inflamatorios. Se ha encontrado que el grado de severidad de la RI en la ERC se asocia con la obesidad, niveles de triglicéridos, albúmina y fósforo plasmáticos, sin embargo no se han encontrado resultados contundentes de dicha condición con los niveles de proteína C reactiva o la magnitud de la proteinuria, ni las cifras de presión arterial15-16.
15
Diagnostico de la Enfermedad Renal Crónica
La composición de la orina y de la sangre suministra información valiosa sobre la función renal. Los exámenes radiológicos, la endoscopia y la biopsia renal proveen medios para apreciar las estructuras macroscópicas y microscópicas de los riñones y del sistema urinario17.
La ERC implica una pérdida gradual de la función renal, de modo que en las etapas tempranas de la enfermedad es frecuente que los pacientes estén asintomáticos y que el diagnostico se retrase hasta que el daño renal sea muy severo. Este puede diagnosticarse de manera directa al observar alteraciones histológicas en la biopsia renal, o bien, indirectamente por alguno de los siguientes marcadores de daño renal: albuminuria o proteinuria, alteraciones del sedimento urinario, o alteraciones en las pruebas de imagen como ultrasonido, radiografías, tomografía computarizada e imagen por resonancia magnética. Los pacientes que cuentan con una función renal normal pero presentan marcadores de daño renal tienen mayor riesgo de presentar las complicaciones de la ERC. Se estima que aproximadamente el 17% de las personas mayores de 60 años tienen una TFG menor a 60 ml/min/1.73 m2 debido a que disminuye con la edad y, por lo mismo, la prevalencia de la enfermedad renal crónica aumenta con los años7.
16 concentración urinaria resultante, así como por otros factores (hematuria e infección urinaria) que hay que considerar a la hora de evaluar la microalbuminuria. En un intento de reducir la variabilidad de estos parámetros, se ha desarrollado otro método de cuantificación que consiste en hallar el cociente entre la cantidad de albúmina y creatinina excretadas en una muestra de orina aleatoria; es el método recomendado en la actualidad. Dado que la concentración de creatinina en orina depende, entre otros factores, de la masa muscular, y esta varía en varones y mujeres, se han definido diferentes umbrales de normalidad del cociente microalbumina/creatinina en función del sexo: 22 mg/g para varones y 31 mg/g para mujeres18.
Clasificación de la Enfermedad Renal Crónica
En Febrero del 2002, la Fundación Nacional del Riñón de Estados Unidos (NKF por sus siglas en inglés) publicó quince guías sobre la enfermedad renal crónica. En ellas, estatificaron cinco etapas en la evolución de la enfermedad crónica renal, las cuales se basan en la presencia de daño estructural y/o la disminución de la tasa de filtración glomerular 19.
La etapa 1 se caracteriza por la presencia de daño renal con TFG normal o aumentada (mayor a 90 ml/min/1.73m2). Debido a que los pacientes generalmente están asintomáticos, la enfermedad pasa desapercibida. El diagnostico en estadio 1 normalmente constituye un hallazgo al estudiar otras condiciones relacionadas como diabetes e hipertensión; puede detectarse como microalbuminuria o proteinuria persistente, o como un hallazgo ecográfico de enfermedad poliquística con TFG normal o aumentada19.
El estadio 2 se establece por la presencia de daño renal asociada con una ligera disminución de la TFG entre 89 y 60 ml/min/1.73m2. Usualmente el paciente no presenta síntomas y no se percata de la enfermedad. El diagnostico se realiza de manera incidental al estudiar otras condiciones19.
17 metabolismo óseo. Algunos de los síntomas acompañantes incluyen fatiga relacionada con la anemia, edema por retención de agua corporal, dificultad para conciliar el sueño debido a prurito y calambres musculares, cambios en la frecuencia urinaria, espuma cuando hay proteinuria y coloración oscura en la orina que refleja hematuria. En este estadio se observa un riesgo aumentado de progresión de la ERC y de complicaciones cardiovasculares. Debido a que el rango de TFG del estadio 3 es muy amplio, los pacientes forman un grupo heterogéneo que por sus diferencias en la mortalidad se ha dividido en dos etapas: la etapa temprana 3a, conformada por pacientes con TFG entre 59 y 45 ml/min/1.73m2, y la etapa tardía 3b, con TFG entre 44 y 30 ml/min/1.73m2 19.
El estadio 4 se refiere a daño renal avanzado con una disminución grave de la TFG entre 15 y 30 ml/min/1.73m2. Estos pacientes presentan un alto riesgo de progresión al estadio 5 y de complicaciones cardiovasculares, y clínicamente se manifiestan con un síndrome urémico. A los síntomas iniciales del estadio anterior se agregan náusea, sabor metálico, aliento urémico, anorexia, dificultad para concentrarse y alteraciones nerviosas como entumecimiento u hormigueo de las extremidades19.
El estadio 5 equivale a la ERCT, donde la TFG cae por debajo de 15 ml/min/1.73m2.
18
Tratamiento de la ERCT
La diálisis o terapia de remplazo renal se indica cuando el paciente presenta uremia avanzada o desequilibrios electrolíticos graves. La opción entre la diálisis y el trasplante depende de la edad, los problemas de salud relacionados, la disponibilidad de donantes y las preferencias personales. Aunque el trasplante suele ser el tratamiento de elección, la diálisis cumple un papel crucial como tratamiento de la ERCT. Este método mantiene la vida de los pacientes que no pueden ser sometidos a trasplante o que esperan uno. Hay dos categorías amplias de diálisis: HD y DP.
Hemodiálisis
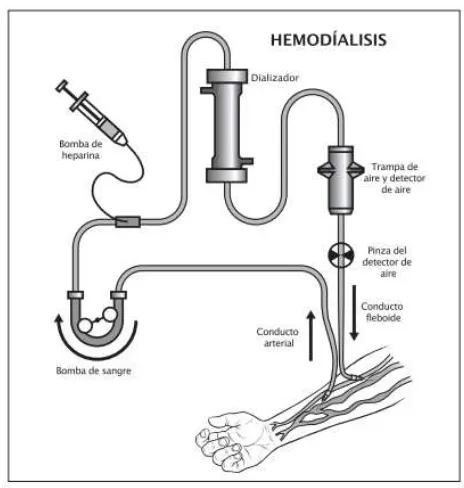
La HD surgió a partir de que, en 1854, Thomas Graham experimentó colocando una membrana de tejido vesical entre un objeto con forma de campana que contenía orina que flotaba libremente y un recipiente con agua destilada que se encontraba debajo del primero. Después de dejarlo en reposo durante varias horas, calentó lo que solía ser agua destilada hasta su tota evaporación, notando un residuo en el contenedor que consistía principalmente de cloruro de sodio y urea. Graham acuño el término diálisis al proceso de separar sustancias con una membrana semipermeable. En 1912, en el hospital John Hopkins, Abel, Turner y Rowntree crearon la primera maquina hemodializadora. El reto más grande al que se enfrentaron fue que la sangre tendía a coagularse en los tubos del aparato, así que emplearon la hirudina, un anticoagulante obtenido de sanguijuelas. En 1943 el Dr. Willem Kolff utilizó el procedimiento de diálisis para el tratamiento de la enfermedad renal aguda con una maquina dializadora que él había inventado. A pesar que solamente uno de sus pacientes sobrevivió, Kolff refinó su máquina dializadora y viajó a los Estados Unidos donde promovió el uso terapéutico de la diálisis. El Dr. Nils Alwall sumó la presión hidrostática negativa a la máquina de HD para agregar el proceso de ultrafiltración, importante avance que permitió la eliminación de agua además de las sustancias tóxicas. En 1960, Cimino y Brescia introdujeron la fístula arteriovenosa como acceso vascular crónico, que hoy en día continua siendo el de elección7.
19 sangre y las proteínas plasmáticas, se muevan con libertad en ambas direcciones (desde la sangre hacia la solución de diálisis y desde la solución hacia la sangre). La dirección del flujo depende de la concentración de las sustancias contenidas en las dos soluciones. En condiciones normales, los productos de desecho y el exceso de electrólitos presentes en la sangre se difunden hacia la solución de diálisis. Si es necesario remplazar o agregar sustancias a la sangre, como bicarbonato, pueden agregarse a la solución de diálisis17.
[image:24.612.190.422.419.663.2]Durante la diálisis la sangre se mueve desde una arteria hacia los tubos y la cámara con sangre de la máquina de diálisis para regresar al cuerpo por una vena. El acceso al sistema vascular se lleva a cabo a través de un cortocircuito arteriovenoso externo (un tubo implantado en una arteria y en una vena) o, con mayor frecuencia, a través de una fistula arteriovenosa interna (una anastomosis de una vena con una arteria, por lo general en el antebrazo). Se utiliza heparina para prevenir la coagulación durante la diálisis; este fármaco se puede administrar en forma continua o intermitente (Ver Figura 2). Los problemas que pueden asociarse con la diálisis, que dependen de las velocidades del flujo sanguíneo y de la eliminación de los solutos son hipertensión, náuseas, vómitos, calambres musculares, cefalea, dolor torácico y síndrome de desequilibrio17.
20 La mayoría de los pacientes se someten a diálisis tres veces por semana durante 3 a 4 horas: el tratamiento depende de los perfiles cinéticos, denominados valores Kt/V, que toman en cuenta el tamaño del aparato de diálisis, el material utilizado, la velocidad del flujo, el tiempo que dura la diálisis y el tamaño corporal17.
En la ERC, la HD debe ser iniciada cuando todavía existe un nivel de función renal residual capaz de evitar que haya uremia manifiesta. Los criterios que manejan las guías de NKF son depuración de creatinina de 15 ml/min y 10 ml/min, y concentraciones séricas de creatinina de 6 mg/dl y 8 mg/dl, para diabéticos y no diabéticos, respectivamente. La HD puede iniciarse en etapas anteriores si hay signos y síntomas de ERC incorregibles, como náusea, vómito, pérdida de peso, asterixis, síndrome de piernas inquietas, insuficiencia cardíaca congestiva irretractable o hiperkalemia7.
Diálisis Peritoneal
La DP se realizó por primera vez en la década de los 20 en Alemania; sin embargo, no fue hasta principios de los años 60 cuando se comenzó a usar para el tratamiento crónico de pacientes con ERCT, volviéndose una terapia común en los 70. El mayor avance de la DP ocurrió en 1977, cuando Mocrief y Popovich desarrollaron la DP continua ambulatoria (DPCA). Su relativa simplicidad, bajo costo y la facilidad con que puede realizarla el paciente en casa han contribuido a la gran popularidad de esta modalidad de diálisis. Para la década de los 80, ya se había convertido en la principal modalidad de terapia para la ERCT en muchos países, incluidos Canadá, Reino Unido y Estados Unidos, pero en los años 90, con el aumento de la disponibilidad de la HD, disminuyó su uso7.
Los mismos principios de difusión, ósmosis y ultrafiltración que se aplican a la HD sirven para la DP. La membrana serosa delgada de la cavidad peritoneal sirve como membrana dializante. Se implanta un catéter de silicona en la cavidad peritoneal por debajo del ombligo por medio de una cirugía para obtener una vía de acceso. Se tuneliza el catéter a través del tejido subcutáneo y se exterioriza en la parte del abdomen17.
21 finales del metabolismo y el líquido extracelular se difundan hacia la solución de diálisis. Al final del periodo prescrito se drena el líquido de diálisis fuera de la cavidad peritoneal por gravedad y se recoge en una bolsa estéril (Ver Figura 3). La presencia de glucosa en la solución de diálisis permite extraer el agua. Hay soluciones de diálisis comerciales con concentraciones de dextrosa al 1.5, 2.5 y 4.25 %. Las soluciones con concentraciones de dextrosa más elevadas aumentan la ósmosis y determinan la eliminación de una mayor cantidad de líquido. Al igual que en la HD, se utilizan los valores Kt/V para comprobar si el procedimiento es adecuado17.
Figura 3. Mecanismo de Acción de la DP 22
Las complicaciones que pueden surgir con la DP son infección, que puede ocurrir en el sitio por donde egresa el catéter, en el túnel subcutáneo o en la cavidad peritoneal (peritonitis), el funcionamiento inadecuado del catéter, la deshidratación producida por la extracción excesiva de líquido, la hiperglucemia y la aparición de hernias17.
Trasplante
22 abdomen, y generalmente se conecta la arteria y la vena renales del injerto a la arteria iliaca externa y la vena ilíaca del paciente, respectivamente. Así, la sangre del paciente fluye a través del riñón trasplantado y éste comienza a realizar sus funciones como producir orina, secretar eritropoyetina, etcétera17.
El trasplante renal es la única modalidad de tratamiento que realmente previene el desarrollo de uremia. Pero, desgraciadamente, no todos los pacientes con ERC son candidatos a trasplante renal7.
Las indicaciones de trasplante renal son múltiples. La mayoría se llevan a cabo para pacientes con glomerulonefritis, diabetes mellitus e hipertensión, que son las tres causas más comunes de la ERC. Otras patologías por las cuales se lleva a cabo un trasplante son enfermedades glomerulares, riñones poliquísticos, enfermedades congénitas, enfermedades tubulointersticiales, vasculares, neoplasia renal y falla de injerto previo. Las contraindicaciones para el trasplante renal incluyen; 1) receptores con esperanza de vida menor a 2 años; 2) condiciones que ponen en peligro la vida, como infecciones, cáncer, enfermedad cardiovascular no controlada, falta de apego al tratamiento y enfermedad psiquiátrica grave y; 3) la edad no es una contraindicación absoluta para un trasplante, sin embargo, en la población de edad avanzada se deben tomar en consideración un número mayor de variables por que la condición general de los pacientes y sus enfermedades concomitantes impactarán importantemente sobre la calidad de vida del trasplante y su sobrevivencia7.
Sin embargo, la disponibilidad de órganos de donantes sigue limitando la cantidad de trasplantes realizados por año. Los órganos de donantes se obtienen de cadáveres y de donantes vivos relacionados (padres, hermanos). (Porth, 2006) En México, en el 2011 se realizaron un total de 2’468 trasplantes de riñón, de los cuales en 1’889 (76.5%) de los casos el riñón provenía de algún familiar, y solo en 579 (23.5%) casos era de origen cadavérico23.
23 una citocina, cumple un papel esencial en la activación de los linfocitos T y B. La ciclosporina y el tacrolimus inhiben la respuesta de los linfocitos T a las interleucinas. También se dispone de anticuerpos creados por ingeniería genética que atacan receptores de interleucinas en forma selectiva17.
El rechazo, que puede clasificarse en agudo y crónico, puede producirse en cualquier momento. El rechazo agudo se desarrolla con mayor frecuencia durante los primeros meses posteriores al trasplante e implica una respuesta celular con proliferación de linfocitos T. El rechazo crónico puede producirse meses o años después del trasplante17. Como el
24
Relación de la enfermedad con la Nutrición
La desnutrición energético-proteica (DEP) es común en pacientes con ERCT en terapia de diálisis. Esta representa sólo un aspecto de una condición llamada síndrome complejo de malnutrición-inflamación, que comprende aspectos del estado nutricional y el estado de inflamación crónico que causa la ERCT. Sin embargo, el sobrepeso y la obesidad han ido incrementando en los mismos pacientes. Varios estudios observacionales relacionan a la obesidad con mejoras en los resultados de los pacientes en diálisis, mostrando mejores tasas de sobrevivencia25.
La malnutrición se presenta en la forma de desnutrición o sobrepeso u obesidad. La desnutrición es el resultado de una disminución en la ingesta energética y proteica, comparado con las necesidades actuales. Una de las posibles causas es la prescripción de dietas restrictivas, así como la presencia de anorexia y trastornos gastrointestinales. La prohibición sin sustento de varios grupos de alimentos, aunado a un plan de alimentación monótono, empeoran el estado nutricional de los pacientes25.
ERCT e Inflamación
Recientemente se ha identificado a la inflamación crónica como una condición que acompaña a la ERC, la cual predice los resultados clínicos del paciente con dicha patología.
La inflamación crónica es caracterizada por niveles circulantes elevados de marcadores inflamatorios y de reactantes de fase aguda. Esta condición tiene diversos efectos a nivel metabólico y nutricional. Se ha identificado que la progresión del daño renal, en pacientes que no están en terapia de sustitución renal, está asociada con la respuesta inflamatoria. El marcador de inflamación que ha sido ampliamente estudiado en población con ERC y con ERCT es la Proteína C Reactiva (PCR). No se conoce a ciencia cierta el mecanismo por el cual la pérdida de la función renal causa este fenómeno, aunque se ha propuesto que es debido a la acumulación de los componentes proinflamatorios productos del metabolismo proteico26.
25 interacción entre la sangre y las membranas regeneradas de celulosa, por ejemplo, conduce al desdoblamiento acelerado de las proteínas (catabolismo posdialítico). La activación del complemento y de los leucocitos inducida por las membranas dializadoras bioincompatibles puede conducir a la liberación de citocinas proinflamatorias (TNF, IL-1 y proteasas granulocíticas) y causar degradación muscular con liberación de aminoácidos27.
La infección es muy común en los pacientes con ERCT, tanto en HD como DP, y es una fuente importante de inflamación, provocando incrementos en los niveles séricos de PCR26.
Las consecuencias nutricionales y metabólicas son varias. En primer lugar, juegan un papel integral en el catabolismo proteico en varias enfermedades caracterizadas por la inflamación. Por ejemplo, los niveles elevados de IL-6 son asociados con un incremento en la proteólisis muscular, la cual desaparece si se administra anticuerpos receptores de IL-6
26.
La anorexia o la disminución/ supresión en la ingesta de alimentos es otro efecto de la inflamación, causado por las citocinas IL-1 y TNF-a. Dicha condición de anorexia, sumada al catabolismo proteico, dan como resultado un balance nitrogenado negativo, lo que predispone al paciente a una perdida muscular acelerada, y en consecuencia llevan al paciente a desnutrición26.
De forma indirecta, el estado inflamatorio contribuye al hipercatabolismo al inducir a mayores episodios de reposo en cama, lo que se interpreta como una disminución en la actividad muscular, que se asocia con atrofia muscular y balance de nitrógeno negativo, causando una mayor pérdida de masa muscular. Dicho estado se asocia también con una disminución en la hormona de crecimiento y en el factor de crecimiento similar a la insulina tipo 1, causando disminución en el anabolismo e incremento en las concentraciones de leptina, induciendo a condiciones de anorexia en el paciente 28.
26 Varías proteínas reactantes de fase aguda están directamente asociadas con la enfermedad vascular. Una de ellas es el fibrinógeno. Los niveles de fibrinógeno aumentan en los pacientes con inflamación y malnutrición y los niveles de esta proteína, como los de PCR y otros reactantes de fase aguda, varían con el tiempo entre los pacientes en diálisis. La inflamación también altera la expresión de moléculas de adhesión solubles (VCAM e ICAM-1), incrementándose la adherencia de plaquetas al endotelio30.
El aumento de los marcadores inflamatorios crónicos se asocia con un peor pronóstico y mayor mortalidad entre pacientes con ERC. Sin embargo, ni la infección ni la malnutrición son las principales causas de muerte en estos pacientes. Por el contrario, la mayoría de los individuos con ERC mueren de enfermedades cardiovasculares. Por lo tanto, el presunto vinculo de inflamación subyacente y disminución de supervivencia entre los pacientes renales, si existe, debe relacionarse con la inflamación y la ateroesclerosis, en lugar de la inflamación y la infección o malnutrición31.
El estrés oxidativo es una condición de desequilibrio entre la producción de radicales libres y su degradación por los sistemas antioxidantes, presentándose una acumulación de especies reactivas de oxígeno y especies reactivas de nitrógeno, los cuales se producen en la mitocondria de forma fisiológica, puesto que concentraciones bajas cumplen con diversas funciones fisiológicas, como reguladores de la síntesis de oxido nítrico, regulador de cascadas de señalización intracelulares, entre ellas de las citocinas, de factores de crecimiento, así como un efecto modulador en las respuestas inmunes, apoptosis y mutagénesis. Sin embargo, en concentraciones excesivas reaccionan con varias moléculas, como lípidos, hidratos de carbono, proteínas y ADN, alterando su estructura y función, causando daño celular que puede desencadenar aterosclerosis32.
Se ha encontrado que la presencia de inflamación, así como de estrés oxidativo, ocasionan resistencia a la insulina en pacientes con ERC33. Se ha correlacionado la presencia de
27
ERCT y Desnutrición
Diversos estudios han mostrado que la desnutrición se presenta en el 18-75% de los pacientes que se someten a HD. Se ha ligado la presencia de DEP al proceso inflamatorio que implica la ERC, el cual se relaciona con un incremento en el catabolismo de proteínas debido a altos niveles circulantes de citocinas proinflamatorias. La presencia de DEP se asocia con un incremento en la mortalidad así como incrementos en el riesgo cardiovascular35.
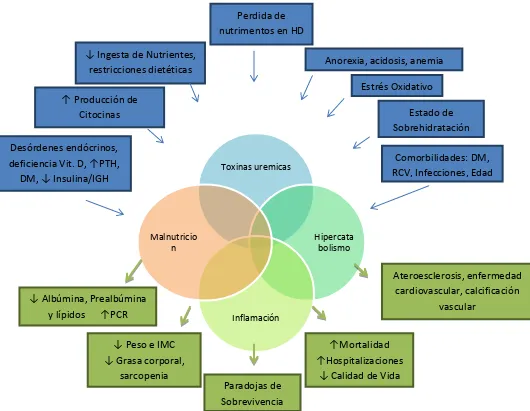
Se han detectado diversos factores que llevan al desarrollo de desnutrición (Ver Figura 4):
- Anorexia: causada por la uremia, el retraso en el vaciamiento gástrico, el proceso de inflamación o desordenes fisiológicos y emocionales.
- Restricción dietética: causada por prescripción de restricciones en la dieta, como baja en potasio, baja en fósforo. Relacionada también a situaciones de pobreza, o un soporte alimenticio inadecuado, o bien a incapacidad física que imposibilita a la persona a prepararse o adquirir sus alimentos.
- Pérdida de nutrimentos durante la diálisis: Pérdidas durante la DP, o durante la HD. - Hipercatabolismo causado por comorbilidades: Causado por la presencia de enfermedad
cardiovascular, complicaciones de la diabetes, infección o sepsis, y otras comorbilidades.
- Hipercatabolismo asociado al tratamiento: Causado por un balance negativo de proteína, o bien un balance energético negativo.
- Desordenes endocrinológicos relacionados a la uremia: Trastornos tales como resistencia a la insulina, resistencia a la hormona del crecimiento, incremento en los niveles séricos de glucagón o incremento en la sensibilidad al mismo, hiperparatiroidismo, y otros desordenes endocrinológicos.
28
Figura 4. Causas y manifestaciones del Síndrome de Desgaste Energético- Proteico en la ERC
Toxinas uremicas
Hipercata bolismo
Inflamación Malnutricio
n
Anorexia, acidosis, anemia Estrés Oxidativo
Estado de Sobrehidratación
↑ Producción de Citocinas
↓ Ingesta de Nutrientes, restricciones dietéticas
Perdida de nutrimentos en HD
Comorbilidades: DM, RCV, Infecciones, Edad Desórdenes endócrinos,
deficiencia Vit. D, ↑PTH, DM, ↓ I suli a/IGH
↓ Al ú i a, Preal ú i a y lípidos ↑PCR
↓ Peso e IMC ↓ Grasa orporal,
sarcopenia
Paradojas de Sobrevivencia
↑Mortalidad
↑Hospitalizaciones
↓ Calidad de Vida
Ateroesclerosis, enfermedad cardiovascular, calcificación
29 Recientemente se establecieron los criterios para hacer el diagnostico de DEP, también llamado desgaste energético proteico (Ver Tabla 1). Se recomiendan utilizar indicadores de 4 dominios (criterios bioquímicos, peso corporal, masa muscular e ingesta dietética de proteína y energía) para realizar el diagnóstico de esta condición, y no basarse únicamente en indicadores aislados36.
Tabla 1. Criterios de diagnóstico de DEP
Criterios Mediciones Bioquímicos Albumina <3.8 g/dL
Prealbúmina <30 mg/dL Colesterol < 100 mg/dL
Masa Corporal IMC <23
Perdida de peso involuntaria >5% en 3 meses Porcentaje de Grasa corporal <10%
Masa Muscular Desgaste muscular: Disminución de 5% de la masa muscular en los últimos 3 meses, o 10% en 6 meses.
Área Muscular del Brazo disminuida (reducción >10% respecto a la percentila 50) Aclaramiento de creatinina.
Ingesta
30 ERCT y Riesgo Cardiovascular
La enfermedad cardiovascular (CV) es la principal causa de muerte entre los pacientes con ERCT. Se ha encontrado una asociación entre falla renal y la progresión acelerada de aterosclerosis. En los individuos en programa de diálisis menores de 65 años, la mortalidad cardiovascular es de 10 a 500 veces superior a la de la población general, incluso después de ser ajustados por sexo, raza o la presencia de DM37.
Los mecanismos que condicionan el aumento de riesgo CV asociado a la ERC son en gran parte desconocidos. Sin embargo, se ha encontrado que la etiología es de carácter multifactorial, relacionado a la pre-existencia de enfermedades cardiovasculares, al nihilismo terapéutico relacionado a la presencia de ERC y a factores de riesgo CV tradicionales y no tradicionales38.
La enfermedad isquémica renal es una causa importante de ERC, y se ha desarrollado el concepto de que la función renal cuantifica el grado de aterosclerosis intrarrenal, la cual a su vez, puede ser un marcador de la carga aterosclerótica total del organismo. Se ha observado que en individuos que han experimentado un infarto agudo de miocardio, su pronóstico depende de un modo independiente de la TFG. Así, el riesgo de muerte o el riesgo combinado de muerte de causa CV, reinfarto, insuficiencia cardiaca congestiva, accidente cerebrovascular o resucitación, se incrementa conforme va disminuyendo la TFG39.
El nihilismo terapéutico se refiere a que los pacientes con ERC a menudo no reciben los tratamientos que mejoran el riesgo CV en la población general, como inhibidores de la enzima conversiva de la angiotensina, aspirina, estatinas, bloqueadores beta, o ser sometidos a angioplastia coronaria y recibir tratamientos adyuvantes. Incluso en la atención terciaria, el tratamiento de la hipertensión, la anemia, el hiperparatiroidismo secundario o la dislipidemia es inadecuado39.
31 así como una prevalencia elevada de HTA. Junto a estos factores, se presentan otras alteraciones circulatorias que acompañan a la ERC, denominados factores no tradicionales39.
Algunos de los factores no tradicionales son la disfunción endotelial, causada por la ateroesclerosis de desarrollo acelerado, las alteraciones plaquetarias, la hiperhomocisteinemia y la presencia de inhibidores endógenos de la síntesis de óxido nítrico, como ADMA (dimetilargininaasimétrica), cuyo aclaramiento se encuentra reducido. Otro factor es la hiperhomocisteinemia relacionada a la uremia, aunque la evidencia en pacientes en hemodiálisis no es clara, es aconsejable medir los niveles de homocisteína. El estrés oxidativo es un factor patogénico indiscutido en la ateroesclerosis de la población general. En el caso de la uremia, la impresión actual es que se trata de una situación con exceso de actividad oxidativa. Se ha establecido que el grado de oxidación de las lipoproteínas de baja densidad (LDL, por sus siglas en inglés) y la peroxidación lipídica, en general, están aumentadas en pacientes urémicos. Esto genera un incremento de los productos de glucosilación avanzada (AGE), tanto en pacientes urémicos diabéticos como no diabéticos; los AGE son capaces de inducir modificaciones estructurales y funcionales persistentes en diversas proteínas. Además las especies reactives del oxigeno pueden activar vías de señalización intracelular que conducen a la proliferación de la pared vascular y, en consecuencia, a la aterosclerosis. Finalmente, estas especies están directamente relacionadas con la disfunción endotelial y son un factor patogénico clave de la misma40. Se ha asociado a los niveles elevados de producto calcio-fósforo y valores de
32 ERCT y Obesidad
La obesidad está relacionada con la aparición temprana de glomerulomegalia, alteraciones hemodinámicas del riñón hiperfiltrante y aumento de la albuminuria; síntomas que son reversibles con una pérdida de peso. Por el contrario, las lesiones patológicas de la glomeruloesclerosis focal y segmentaria se desarrollan en modelos experimentales de obesidad mantenida y se observan en pacientes con obesidad mórbida que presentan proteinuria masiva. Además, diferentes estudios observacionales, transversales y longitudinales han demostrado que la obesidad supone un factor de riesgo independiente de la aparición, el empeoramiento, y la escasa respuesta al tratamiento de la ERC, incluso después de ajustar por variables de confusión, incluido el síndrome metabólico, la diabetes y la hipertensión, las principales causas de la ERC41-42.
El porcentaje de pacientes obesos en hemodiálisis parece estar aumentando. Aunque en la población general y, aparentemente, en la DP y trasplante renal existan indicios de que la obesidad (IMC >30) aumenta la tasa de mortalidad y de complicaciones cardiovasculares, se ha demostrado lo contrario en la población en HD. En esta población se ha encontrado una asociación entre IMC >30 con una mejora en la sobrevivencia, es decir, la obesidad ejerce un efecto protector, independientemente de las cifras de albúmina sérica y otros marcadores del estado nutricional. Se ha observado la misma asociación en presencia de HTA, hipercolesterolemia e hiperhomocisteinemia. A este fenómeno se la ha nombrado Epidemiología Inversa43.
33 Obesidad y Trasplante Renal
El candidato a trasplante renal es un individuo que se encuentra en tratamiento dialítico (HD o DP) o, más raramente, en tratamiento conservador. Por lo tanto, a este periodo se aplican los aspectos de riesgo nutricional existentes en esta población. A pesar del efecto protector de la obesidad en pacientes en HD, su presencia limita la oportunidad de recibir un trasplante renal exitoso45. Se estima que aproximadamente un 44% de la población en
espera de recibir un trasplante renal tienen un IMC >35 46.
La presencia de obesidad en pacientes candidatos a trasplante se asocia con un aumento de la morbimortalidad, al elevar el riesgo quirúrgico y el tiempo de hospitalización (al incrementarse la cantidad de complicaciones urológicas, circulatorias, infecciosas y las dehiscencias de la incisión) y predisponer a complicaciones como diabetes y episodios cardiovasculares. También se asocia con menor viabilidad del injerto y menor supervivencia del paciente cuando se le compara con sujetos no obesos. Además de las complicaciones perioperatorias, la obesidad puede afectar la eficacia terapéutica de los fármacos inmunosupresores47. Otros estudios, sin embargo, sugieren que la obesidad
anterior al trasplante ejerce un impacto modesto o carece de influencia y no podría ser considerara un criterio de exclusión de los receptores48.
Proceso de Cuidado Nutricio
34 PES (Problema detectado, etiología y signos y síntomas que evidencian dicho problema); 3) la ejecución de las intervenciones relevantes, las cuales ayudarán a que se resuelva el problema nutricional detectado. Estas se basan en dos componentes, planeación e implementación, la primera se refiere a planear la intervención buscando la mejor evidencia disponible para resolver el problema detectado, en ella se realiza la prescripción y el planteamiento de metas con el paciente, así como la frecuencia de las consultas. La implementación consiste en la propia planeación, así como en la forma de documentar, la resolución de dudas, las consultas subsecuentes con el paciente, y los ajustes en la intervención que sean necesarios en el transcurso de la terapia médico nutricia y 4) la monitorización y valoración de los resultados de la asistencia nutricional, es decir, evaluar el cumplimiento de los objetivos y las metas de la terapia médico nutricia49.
Evaluación del Estado Nutricional
La evaluación del estado nutricional tiene por finalidad identificar las causas de riesgo o deterioro del estado nutricional, para ayudar a definir la terapia específica y determinar las necesidades de cada nutrimento. Para prevenir la desnutrición, es importante efectuar el seguimiento del estado nutricional. Por lo tanto, los pacientes deben ser evaluados al comienzo del programa de hemodiálisis, y cada cuatro a seis meses27.
35 La evaluación antropométrica depende de la medición de las dimensiones físicas y la composición corporal del paciente. La antropometría es una técnica indispensable para evaluar el estado de nutrición, ya que permite identificar a individuos en riesgo nutricio o con problemas de deficiencias nutricias (de desnutrición a obesidad) y evaluar la efectividad de una terapia nutricia50.
Algunas mediciones de antropometría, como el porcentaje del peso habitual, el porcentaje del peso teórico, el porcentaje de variación de peso y el IMC, son más precisas que los pliegues cutáneos y la circunferencia del brazo. El monitoreo antropométrico longitudinal del mismo paciente puede proporcionar información valiosa sobre el estado nutricional50.
El estado de hidratación puede afectar significativamente la evaluación antropométrica27,
por lo que con frecuencia se vuelve difícil estimar el peso corporal del paciente debido a la presencia de ascitis o edema. Actualmente no existen en la literatura estándares de referencia respecto a que peso utilizar, por lo que se deberá utilizar el juicio clínico para utilizar las mediciones ya mencionadas (peso actual, peso seco en caso de edema, e historias de cambio de peso). Las interpretaciones dadas a dichas mediciones deberán hacerse con cautela, ya que las normas publicadas no están realizadas en poblaciones con ERC, y la significancia del peso teórico y el IMC no son extrapolables a la población en HD51.
En pacientes en HD, el peso postdiálisis se considera “peso seco” o “peso libre de edema”. Es de relevancia clínica el evaluar la evolución del peso seco en los últimos meses, para lo cual se utiliza el indicador de % de pérdida de peso, que se interpreta considerando que una pérdida de peso menor a 5% se considera como pequeña, una disminución entre 5 y 10% se considera potencialmente significativa y una mayor a 10% se considera significativa. Es importante considerar que la pérdida de peso debe evaluarse con base en la perspectiva de tiempo; no es lo mismo que la pérdida de peso se dé en un lapso de seis meses o que se presente en solo dos semanas51.
36 pacientes con obesidad, y agregando el 25% de peso a los pacientes con desnutrición. Se recomienda el cálculo cuando el porcentaje de peso teórico del paciente es menor a 95% o mayor a 115% 51.
Los pacientes en HD suelen ganar varios kg de líquidos entre cada sesión de tratamiento. Esta ganancia se le conoce como ganancia de peso interdialítica, la cual es importante evaluar, ya que cuando es mayor al 5% del peso corporal, debido a una ingesta excesiva de líquidos, puede causar valores de laboratorio falsos y desencadenar hipertensión, edema periférico y ascitis, mientras que una ganancia menor al 2% es el resultado de una ingesta deficiente de líquidos y alimentos. La ganancia de peso deficiente puede dar como resultado valores de laboratorio falsos debido a la deshidratación. Algunos autores recomiendan una ganancia de 2.0-2.5 kg de peso entre cada sesión o del 4.0-4.5 % del peso corporal52-53.
Es necesario tomar la estatura de todos los pacientes, y en aquellos que no pueden ponerse de pie, estimarla mediante las fórmulas de media brazada o bien determinando la altura rodilla. La estatura puede ir disminuyendo a consecuencia de la osteodistrofia53.
La complexión ósea se determina mediante la circunferencia de muñeca o la anchura de codo y la estatura del paciente, la cual clasifica al paciente según su complexión en pequeña, mediana y grande. Esta clasificación se utiliza para sacar el peso teórico del paciente utilizando las tablas publicadas por la Metropolitan Life Insurance. La Iniciativa para la Calidad de los Resultados de la insuficiencia renal de la Fundación Nacional del Riñón recomienda obtener el peso teórico con las tablas de la Encuesta Nacional de Examen de Salud y Nutrición (NHANES II). Una vez obtenido el peso teórico, se puede utilizar el indicador de % de peso teórico, el cual indica variaciones en el peso actual del paciente con respecto a su peso teórico, y permite evaluar si el peso del paciente es aceptable, está excedido o es deficiente54.
37 IMC mayor a 23 reduce el riesgo de morbilidad y mortalidad, asociando un IMC <20 al riesgo de mortalidad más elevado52.
Se puede estimar la composición corporal mediante varios métodos. Uno de los más utilizados son los pliegues cutáneos, los cuales sirven para medir la grasa corporal. Se recomienda realizar la medición de los pliegues bicipital (PCB), tricipital (PCT), subescapular (PCSE) y suprailíaco (PCSI) en el periodo postdiálisis y en el brazo contrario al acceso vascular a la HD. Los pliegues cutáneos del tríceps y del subescapular miden el espesor del tejido adiposo subcutáneo de los miembros y del tronco, y las circunferencias abdominal y de la cadera se usan como índices del tejido adiposo interno. La evaluación de las reservas de grasa en el organismo nos sirve para detectar la desnutrición temprana si se realizan mediciones continuas a lo largo del tiempo53.
La circunferencia media de brazo (CMB), correspondiente a la circunferencia del punto medio entre el acromion y el olécranon, se utiliza para estimar la masa muscular. Utilizando esta medida y el PCT se puede estimar el perímetro muscular del brazo (PMB), el cual se utiliza para medir la reserva muscular del brazo, y es considerado un predictor independiente de sobrevivencia en pacientes en HD53, 55.
El estudio de la composición corporal resulta imprescindible para comprender el efecto que tienen la dieta, el crecimiento, la actividad física, la enfermedad y otros factores del entorno sobre el organismo. Uno de los métodos más utilizados actualmente por su precisión, facilidad de aplicación y uso en la composición corporal es el del análisis de impedancia bioeléctrica (IBE). Esté método ofrece una evaluación no invasiva de la composición corporal humana, tanto para investigaciones clínicas como para la atención de pacientes. La técnica de IBE se basa en la medición de impedancia, la cual está compuesta de dos elementos: la resistencia y la reactancia a través de una o más frecuencias eléctricas. La resistencia es la oposición de un fluido a una corriente alterna, en este caso a través de las soluciones intra y extracelulares y la reactancia es la fuerza que se opone al paso de una corriente a causa de un conductor, dado también en este caso por la polaridad de las membranas celulares56. Este método se ha estudiado ampliamente en pacientes sometidos a
38 Existen otros métodos de estimación de la composición corporal, entre los que destacan: dilución de isotopos, densitométricos (peso bajo el agua o pletismógrafia), DEXA (dual energy X-ray absorptiometry por sus siglas en inglés) e imagen corporal (resonancia magnética o tomografía computarizada)57.
Los resultados de las pruebas de laboratorio proporcionan datos objetivos para usar en el proceso de terapia médico- nutricia con el fin de evaluar el estado nutricional, identificar los diagnósticos nutricionales y vigilar y evaluar los resultados de la terapia médico-nutricia.
Las proteínas en plasma y en el líquido extravascular representan aproximadamente el 3% de la proteína corporal total; las proteínas viscerales representan aproximadamente el 10 %. Algunas proteínas se han estudiado y han demostrado ser buenos indicadores del estado nutricional, tal es el caso de la albúmina, la cual se utiliza frecuentemente como marcador del estado proteico y es recomendado por la NFK-K/DOQI53.Sin embargo, la utilización de
este marcador en ocasiones se vuelve un problema, ya que es común ver en la práctica clínica a individuos con concentraciones de albúmina bajas y sin desnutrición, o individuos con niveles considerables de desnutrición y cifras normales de albúmina. Si bien es cierto que una restricción en la ingesta de proteína disminuye su síntesis, es bien sabido que, por ser un reactante de fase aguda, situaciones de inflamación y estrés, así como hemodilución influyen negativamente en su concentración, por lo que su interpretación deberá realizarse tomando en cuenta los factores que pudieran afectarla58.
Otra proteína que se utiliza para evaluar el estatus proteico de los pacientes con ERC es la prealbúmina, la cual, a diferencia de la albúmina es menos afectada por la enfermedad hepática o por condiciones de hidratación corporal. Sin embargo, puede estar falsamente elevada debido a que los riñones no excretan el producto degradado53.