Manejo y conservación del espermatozoide y óvulo bovino Curso Taller Manejo y Conservación del Espermatozoide y Ovulo Bovino Santafé de Bogotá (Colombia), 28 30 Sep 1994
Texto completo
(2) 4. CORPORACION COLOMBIANA DE INVESTIGACION AGROPECUARIA. (CORPOICA). SUBDIRECCION DE INVESTIGACION ESTRATEGICA PROGRAMA NACIONAL DE ECOFISIOLOGIA ANIMAL CRECED BACATA REGIONAL UNO. MEMORIAS CURSO-TALLER "MANEJO Y CONSERVACION DEL ESPERMATOZOIDE Y OVULO BOVINO". Mecanografiado por: NELY MORA M.. SEPTIEMBRE 28, 29 Y 30 DE 1994 CA. TIBAITATA, MOSQUERA.
(3) MEMORIAS CURSO-TALLER "MANEJO Y CONSERVACION DEL ESPERMATOZOIDE Y OVULO BOVINO CONTENIDO PRESENTACION CONFERENCIAS 1.. GAMETOGENESIS O GAMETOGENIA. 2.. LA OOGENESIS Y EL DESARROLLO FOLICULAR /. 3.. ASPECTOS FISIOLOGICOS DE ADAPTACION DE LOS BOVINOS AL TROPICO. 4.. EFECTO DE ESTRES CALORICO SOBRE EL DESARROLLO EMBRIONARIO EN BOVINOS -. S. EVALUACION DE LA FERTILIDAD EN TOROS 7 6. CRIOPRESERVACION DEL SEMEN BOVINO CONFERENCISTAS.
(4) PRESENTACION "La misión de la Corporación Colombiana de Investigación Agropecuaria es la de contribuir a mejorar el bienestar y la calidad de vida de la población colombiana, mediante el desarrollo de conocimientos y tecnologías que aseguren el aumento y la competitividad de la producción agropecuaria, al tiempo que garanticen el mantenimiento de la capacidad productiva de los recursos naturales en el largo plazo" CORPOICA tiene como objetivo a través de los programas (de nivel nacional, regional y local), generar tecnologías que permitan mejorar los sistemas de producción agropecuarios del país, aumentando la competitividad, buscando equitativamente integrar al pequeño próductor al proceso de cambio tecnológico, así como asegurar el desarrollo de una agricultura sostenible. El nuevo modelo corporativo esta diseñado para que esos tres niveles de organización dinamicen su propia transferencia al nivel inmediato que corresponda, y de este a los extensionistas, asistentes técnicos, UMATA, y productores, todo esto incluyendo la comunidad académica interesada en esos resultados. Y es dentro de este contexto que el Programa Nacional de Ecofisiología Animal se ha unido con el CRECED Bacatá Regional 1, para realizar este seminario taller sobre reproducción, con el propósito de capacitar a Asistentes Técnicos ofreciendo nuevas tecnologías aplicadas a la manipulación de gametos bovinos (óvulos y espermatozoides) como alternativas tecnológicas que contribuyan al sector agropecuario. Seguros de que este esfuerzo que realiza la Corporación va a contribuir decididamente en el fortalecimiento del conocimiento de quienes participan en este evento, para en un futuro cumplir con éxito su función como eslabones claves en el acercamiento y aplicación de la innovación tecnológica al productor, con el fin de mejorar su eficiencia en la producción agropecuaria nacional. No nos queda más que agradecerles su atenta respuesta al llamado del saber y desearles éxitos en el futuro.. JAIME CARDOZO CERQUERA Coordinador Programa Nacional Ecofisiología Animal. JUAN MANUEL GAV1RIA LEON Director CRECED Bacatá Regional Uno.
(5) GAMETOGENESIS 0 GAMETOGENIA.
(6) GAMETOGENESIS O GAMETOGENIA. José Guillermo Velásquez. INTRODUCCION La gametogénesis o gametogenia es definida por algunos autores como el desarrollo de elementos sexuales o gametos (Salvat 1983). Las investigaciones de la gametogénesis son de absoluta importancia para el entendimiento de los eventos reproductivos de cualquier especie. En el proceso de formación de las células sexuales se presentan cambios cuyo conocimiento es importante para entender el desarrollo de la fertilización y del embrión. En la gametogenésis se presentan en forma casi simultanea las divisiones celulares (mitosis) y reducción cromática (meiosis), lo cual nos indica que la gametogénesis se inicia de una célula madre con número completo de cromosomas (célula diploide), para dividirse por mitosis y meiosis hasta una célula haploide (célula que tiene la mitad de los cromosomas de la especie). Una de las caracteristicas que resaltan en la gametogenia, es que en la hembra de los mamiferos superiores desde el nacimiento ya cuenta con todas las células sexuales que necesitará en su vida adulta, en el macho para contar con las células sexuales necesita llegar a la pubertad, puesto que al nacer cuenta con células juveniles, gonocitos precursores de las células germinales, células de soporte precursoras de las células de Sertoli y células intersticiales. El proceso de gametogénesis en la hembra se conoce como ovogénesis que es el proceso de formación, crecimiento y maduración de los gametos femeninos y en el macho como espermatogénesis donde se compromete el gameto masculino "espermatozoide".. * DMV MSc, Investigador Programa Nacional de Ecofisiología Animal, Corporación Colombiana de Investigación Agropecuaria (CORPOICA) REGIONAL 8, Villavicencio - META, Teléfono 634452..
(7) La espermatogenésis es el proceso de desarrollo y evolución de la célula indeferenciada que se origina en un túbulo seminal "espermatogonia" que conllevan a la producción de espermatozoides. El propósito de este trabajo es presentar información anivel de revisión sobre espermatogénesis, tomando como marco base Hafez, 1987; McDonald, 1988; Galina, 1988; Mendigana 1990; Cardozo, 1990 y Velasquez, 1990. LA ESPERMATOGENESIS La espermatogénesis incluye la espermatocitogénesis o formación de espermatocitos primarios o secundarios de la espermatogonia tipo A y la espermiogénesis o formación de esperematozoides fértiles maduros desde espermatidas inmaduras (Cadavid 1991). LA ESPERMATOCITOGENESIS La espermatocitogénesis se produce en todos los túbulos seminíferos durante la vida sexual activa, la cual se inicia por la estimulación de las hormonas gonadotrópicas de la hipófisis glandular. Los túbulos seminiferos al nacimiento son pequeños y se encuentran rodeados de células mesenquimales mesodermales precursoras de las células de leydig o células intersticiales que son células poligonales encargadas de secretar la hormona testosterona, ademas se encuentran revestidos por un epitelio seminífero compuesto por dos tipos de células básicas: Las células no germinales intratubulares formadas de las células de soporte o indiferencíadas representadas por las células de Sertoli (Delahunta, 1985), las cuales tienen la función de nutrir los espermatozoides y mantenerlos sobre la fase de diferenciación son células grandes con nucleo y varios nucleolos ricas en glucogeno, glucoproteinas y lípidos ademas son blanco de hormonas como la FSH y los androgenos, y las células germinales que durante las primeras etapas del desarrollo embrionario son llamadas células germinales primordiales las cuales se trasladan desde la región del saco de la yema del embrión hasta las gonadas indiferenciadas. Después de llegar a las gonadas fetales, se dividen varias veces antes de formar células especiales llamadas gonocitos que sufren una diferenciación y dan origen a las espermatogonias justo antes de la pubertad (Clermont Citado por Austin, 1983)..
(8) La diferenciación celular se observa posterior a la apertura y ensanchamiento del lúmen del túbulo seminífero. Esta diferenciación celular se presenta primero por la presencia de espermatocitos primarios, los cuales por lo común, se degeneran en la fase de paquiteno, o sea que no pueden completar la meiosis por falta de estímulo hormonal. Los gonocitos se diferencian en espermatogonias Ao las cuales permanecen inactivas y sólo vuelven a dividirse cuando hay daños a nivel de túbulos (Hunfins y Oakberg citados por Austin 1983). Las células madre llamadas espermatogonias Ao originan otras células germinales, su division es progresiva en Al, A2, A3 y A4. La espermatogonia A4 se divide resultando las espematogonias intermedias, de las cuales se originan al dividirse las espematogonias tipo B. Estas espermatogonias tipo B se dividen 1 6 2 veces hasta la formación de los espermatocitos. Los espermatocitos primarios duplican su DNA y estos experimentan cambios nucleares de la profase meiótica, denominados preleptoteno, leptoteno, cigoteno, paquiteno y diploteno antes de dividirse y formar espermatocitos secundarios "primera división melótica". Los espermatocitos secundarios hacen su segunda división meiótica sin experimentar síntesis de DNA resultando en 4 células haploides llamadas espermátides (Hess, 1990). La espermatocitogénesis la cual incluye Estas divisiones celulares, la proliferación de la espermatogonia y las divisiones meióticas tienen una duración en el toro de aproximadamente 45 días (Figura 1). Braunhut, 1990 reporta que la hormona folículoestimulante (FSH), hormona estimulante de las celis intersticiales (ICSH) y triyodotironina (T4) influyen directamente o indirectamente el patron de proliferación celular mitótico y meiotico. Reportes de Jackson, 1988 y Mohan, 1990 señalan que la enzima convertidora de angiotensina (ACE) se ha encontrado presente en pulmón, cerebro, riñon, glándula adrenal y tracto gastrointestinal (TGI), pero su mayor actividad es a nivel testícular. Altas concentraciones de ACE se han encontrado en pollos prepuberes con gradual caida post-pubertad, indicando un posible papel en los primeros estadios de la espemiatogénesis..
(9) ESPERMIOGENESIS O ESPERMATELIOSIS La espermiogénesis consiste en la transformación de las espermátidas en espermatozoides, cambios que ocurren en el citoplasma de las células de sertoli. Estos cambios incluyen la condensación de la cromatina nuclear, la formación de la cola espermática o aparato flagelar, y el desarrollo del caparazón acrosómico y tiene una duración de 15 días. Dentro de este desarrollo se pueden observar 4 fases; de Golgi, del capuchón 'caparazón", acrosomica y de maduración (Figura 2). La fase de Golgi: esta fase se caracteriza por la formación de gránulos proacrosómicos, el ligamiento de los gránulos en uno solo, la adherencia de este gránulo acrosómico a la superficie nuclear y las etapas tempranas de la formación de la cola en el extremo opuesto del gránulo acrosórnico. Al nucleo se le aproxima el centriolo proximal, en donde parece que se forma una base para el ligamiento de la cola con la cabeza. La fase de capuchón: En esta fase se disemina el gránulo acrosómico adherente a la cubierta nuclear de la espermatide, una fina membrana de doble pared se adhiere íntimamente más o menos en un 60% de la porción anterior de cada nucleo, además los componentes axonémicos en desarrollo de la cola se alargan más allá de la periferia del citoplasma celular. La fase acrosómica: Esta fase involucra cambios en; a) Núcleo: estos cambios incluyen la condensación de la cromatina en granulos densos y reformación del núcleo esferoide en alargado y aplanado que parece que es moldeado por las células de sertoli. b) Acrosoma: se encuentra intimamente adherido al núcleo y sufre un proceso de condensación y alargamiento de modo que concuerda con el nucleo. La elongación nuclear espermátida y la condensación de la cromatina requiere una estímulación hormonal y una estrecha interacción con las células de Sertoli (Maddocks, 1990). Aqui tambien estan involucrados peptidos parecidos a GnRH y factores peptidicos de crecimiento como el factor de crecimiento seminífero (SGF), aFGF y factor de crecimiento fibroblástico a y b (aFGF y bFGF) I factor de crecimiento insulínico (IGF-1 y II), factor de crecimiento nervioso (NGF), factor de crecimiento transformante (TGF-a y TGF-b) (Braunhut, 1990) y el factor de crecimiento epidermal (EGF) (Falase, 1990)..
(10) e) Cola: la cola de las espermatides en crecimiento facilitan la rotación de cada espermatide consiguiendose que el acrosoma se dirija hacia la pared externa del túbulo seminifero y la cola hacia la luz. El citoplasma se desplaza hacia la parte caudal del núcleo. En el interior de este citoplasma, los microtubúlos se asocian y originan una vaina cilíndrica temporal llamada manguito. Dentro del manguito cilindrico, una estructura citoplásmatica especializada, llamada cuerpo cromatide, se condensa al rededor del axonema y da lugar a una estructura denominada anillo. El anillo primero se forma cerca del centriolo proximal y después, durante el desarrollo subsecuente, se traslada a lo largo de la cola. Las mitocondrias con anterioridad se distribuyen en el citoplasma de la espermátide e inician a concentrarse cerca del axonema y forman la vaina que caracteriza a la pieza media de la cola. La fase de maduración: Esta fase corresponde a la etapa final de la espermiogenesis donde se involucra la transformación última de las espermátides alargadas en células que se vertiran en la luz de los túbulos seminiferos. En el interior del núcleo, los gránulos de cromatina sufren una condensación progresiva formando un material uniforme, fino que ocupa con homogenidad todo el núcleo del espermatozoide. Durante la fase de maduración se forma una vaina fibrosa y las nueve fibras gruesas que recubren el axonema. La vaina fibrosa cubre al axonema desde el cuello hasta el inicio de la pieza terminal. El anillo se traslada distalmente desde su posición adyacente al núcleo y a lo largo de la cola hasta llegar un punto donde se separa la pieza media de la pieza principal de la cola. Las mitocondrias se fucionan y forman la vaina continua que se extiende desde el cuello hasta el anillo.. En la parte final de la espermiogénesis, el manguito desaparece y la célula de sertoli forma el citoplasma restante después de alargarse la espermátide en un lóbulo esferoide llamado cuerpo residual. La formación del cuerpo residual, completa la maduración final y las espermátides alargadas están listas para liberarse como espermatozoides. Steinberger y col., 1974 postularon que el proceso mitótico de la espermatogonia y las primeras fases de la meiosis en la rata normalmente no son dependientes. La división reductora final depende de testosterona y la diferenciación morfológica final de las espermatidas a espermatozoides requieren de FSH y posiblemente de testosterona..
(11) Arnann, 1983 reporta que durante el proceso de espermatogenesis un toro produce en promedio 140 espermatozoides/segundo/gramo de parenquima testícular. Las Figuras 3 y 4 representan fotográficamente las diferentes etapas de la espermatogénesis.. ESPERMIACION La espermiación se considera como la liberación de los espermatozoides desde el citoplasma de la célula de sertoli a la luz de los túbulos seminíferos. Esta liberación es enviada paulatinamente. Los lóbulos de citoplasma residual a través de los cuales están conectados grandes grupos sincitiales de espermatides por medio de puentes intercelulares permanecen incluidos en el epitelio. La extrusión de los componentes espermaticos prosigue sólo hasta que un fino tallo de citoplasma conecte el cuello de la espermatide con su cuerpo residual (Figura 5). El rompimiento del tallo genera la gota citoplasmática en el cuello del esperma liberado (gota proximal) y retención de los cuerpos residuales interconectados, los cuales son fagocitados por las células de sertoli dentro del proceso espermatógeno y éstas a su vez eliminan células germinales degeneradas. Es de anotar que el proceso espermatógeno es relativamente ineficiente, lo que ocasiona que gran número de células espermáticas degeneran antes de convertirse en espermatozoides. La espermiación origina espermatozoides inmaduros. Estas células espermáticas que son inmoviles son barridas de los túbulos seminiferos por secreciones que se originan en las células de sertoli. El transito dentro del epidídimo parece ser auxiliado por secreciones de la rete testis, por los elementos contractiles de los testículos (células mioides y capsula testícular) y por los cilios que recubren los conductos eferentes. Reportes de Bemdtson en 1989, indican que existe una alta correlación entre el tamaño testícular (número de células de sertoli por testículo) Vs producción espermática diaria y junto con la producción de espermatidas por espermatogonia A, se utilizan como medidas comunes de la eficiencia espermatogénetica. Estudios por Thomson, 1984 y Walker, 1984 muestran que la inmunización activa de los animales prepuberales contra esteroides testiculares incrementa la.
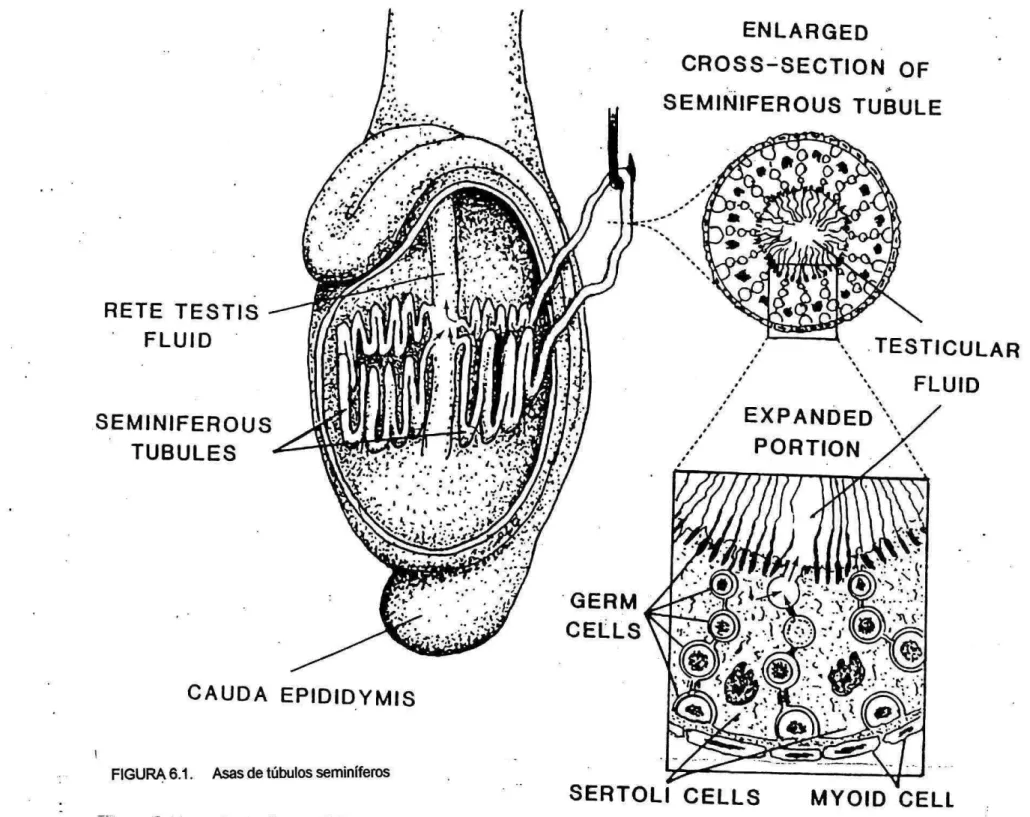
(12) producción espermática y el tamaño de los testículos en los animales postpuberales.. DURACION DE LA ESPERMATOGENESIS: Durante la espermatogénesis se hallan asociados ciertos tipos de células específicas desde la membrana basa¡ del túbulo seminifero ha su luz. Dentro del corte transversal del tubo seminifero las asociaciones celulares que se forman son bien definidas y sufren cambios cíclicos. Se han identificado 14 tipos de asociaciones o estadios celulares en algunas especies; En el toro, se han descrito 12 estadios del ciclo (Figura 2). Un ciclo completo, determinado por el tiempo de los estadios, llamado ciclo del epitelio seminífero, se define como una serie de cambios en una area dada del epitelio seminifero entre dos asociaciones celulares o estadios, según la especie se requieren de 4 a 5 ciclos antes de que la espermatogonia tipo A del primer ciclo haya completado la metamorfosis de la espermiogénesis. Los estadios del ciclo del epitelio seminífero cambian no sólo con el tiempo sino tambien con la longitud del asa tubular. Una porción de túbulo en un estadio, suele ser adyacente a porciones de túbulo en estadios anteriores o posteriores (Figura 6.1, 6.2). Este cambio secuencia¡ en el estadio del ciclo a lo largo del. túbulo ha dado en llamarse onda del epitelio seminífero o onda espermatógena. DISTRIBUCION DE LOS CROMOSOMAS SEXUALES EN EL ESPERMATOCITO SECUNDARIO. En cada espermatogonia de los pares de cromosomas se lleva información genética que establece el sexo del futuro descendiente. Este par está constituido por un cromosoma "X" que es el cromosoma femenino, y un cromosoma "Y" que es el cromosoma masculino. Durante la división melótica los cromosomas que establecen el sexo se distribuyen entre los espermatocitos secundarios, de manera que la mitad de los espermatozoos son masculinos, conteniendo el cromosoma "Y' ,, y la otra mitad son femeninos conteniendo el cromosoma "X". El sexo de la descendencia dependerá de cual de estos dos tipos de espermatozoides fertilice el óvulo. (Figura introducción).
(13) EFECTO DE LA TERMOREGULACION TESTICULAR SOBRE LA ESPERMATOGENESIS Los testículos de bovino cuentan con un mecanismo termoregulador, indispensable para una normal espermatogénesis y manutención de la fertilidad, en el cual intervienen el músculo cremaster, plexo pampiniforme, túnica dartus y glandulas sudoriparas. La sangre de la arteria espermática entra a la bolsa escrotal con 39 grados centígrados, pero cuando alcanza al testículo apenas tiene 34.8, porque es refrigerada por la vena espermática, que emerge del testículo con 33 grados centígrados y por su plexo con 38 grados. Este mecanismo fisiológico de termoregulación es el responsable de la eliminación del 60% del calor testícular excedente. Cuando la temperatura ambiente esta elevada, el músculo cremaster y dartus se relajan y ocurre una distensión de la bolsa escrotal, para as¡ contribuir con un 20% de la termoregulación testícular. Cuando la temperatura es fría se presenta retracción de la bolsa escrotal. Las glándulas sudoríparas contribuyen a eliminar el calor testicular (Findlay y Beakelly citados por Huertas, 1989). La Figura 7 ilustra el mecanismo termoregulador en cameros despiertos y anesteciados. La célula espermatica para su desarrollo requiere de una temperatura menor que la corporal en 3 a 4 grados, para lo cual cuenta de un sistema vascular de contracorriente en donde la sangre arterial es precongelada por intercambio calorico de la venosa, la cual es precalentada antes de retomar a la circulación general. Por este sistema también se controlan la presión sanguínea (120 mm/Hg a 84 mmlHg) en la sangre arterial (Robertson, 1986). Los cambios en la temperatura ocasionan; alteraciones espermiogéneticas por daño a proteinas termolabiles, anoxia por efecto de la vasodilatación o anormalidades de la secreción interna testícular y adrenocortical (HoDy, 1983). CONTROL ENDOCRINO DE LA ESPERMATOGENESIS La función testicular normal requiere de una estimulación hormonal por gonadotropinas que a su vez están controladas por la secreción pulsátil de la hormona liberadora de gonadotropina (GnRH) del hipotálamo descubierta.
(14) simultánea e independientemente por Guillermin y Schally en 1977, hecho que les valió el Premio Nobel, esta hormona controla la liberación de las dos gonadotropinas hipofisiarias, la LH y la FSH (Figura 8).. CONTROL ENDOCRINO DURANTE EL CRECIMIENTO Estudios de Amann, 1983; Deaver y Peters, 1988 señalan que en el bovino el periodo de transición del estado infantil al prepuber se presenta más o menos entre la 8-14 semanas de edad y es acompañado por un aumento en la frecuencia del pulso y amplitud de la LH. La prolactina realza la acción de la LH y se presume que actua a nivel de las células de leydig, pero su acción en el mantenimiento de la función testícular no es muy clara (Pomerantz y col., 1987, Steger y col., 1990). La FSH es una importante señal del inicio del crecimiento y desarrollo de la gónada, parece estar ligada especificamente a la célula de sertoli bovina. La información y reclutamiento de los receptores de FSH son inducidos por el incremento de las concentraciones de FSH en los terneros machos entre la cuarta y décima semana de edad. El reclutamiento de los receptores puede iniciar cambios bioquímicos dentro de las células de sertoli incluyendo mitosis y prepara estas células para la aparición de la espermatogénesis. La segunda alza de FSH en el plasma se ha observado entre la décima segunda y vigésima semana de edad, igualmente esta segunda alza de FSH inicia el incremento de testosterona y el grosor del testículo inmediatamente después de la décima cuarta semana (MacDonald y col., 1991, Johnson, 1991). En las ratas se ha demostrado que la FSH se une en los túbulos seminíferos primeramente a las célula de sertoli regulando las funciones de las mismas (Pomerantz, y col., 1987). El número de receptores para FSH en los túbulos es alto en fa etapa uno y bajo en las etapas sexta y octava de la esperrnatogénesis de la rata (Pomerantz y col., 1987).. EFECTOS DE LA FSH, LH Y TESTOSTERONA Algunos autores consideran que el papel de la FSH en la espermatogénesis no esta bien definido, debido a la capacidad que tiene fa testosterona para.
(15) mantener la espermatogénesis en ratas hipofisectomizadas (Cardozo, 1990). Aunque Hafez señala que la glándula hipófisis juega un papel importante en la esperrnatogénesis. En general existe un consenso en que la hormona FSH no promueve la espermatogenesis, pero si influye para que se complete el fenomeno de Meiosis (Galina, 1988). En cuanto se refiere a la testosterona el principal efecto de este andrógeno parece ejercerse más sobre la células de Sertoli que sobre las germinales. Las células mioides del tejido intersticial tambien son dependientes- de los andrógenos. Las células de leydig son estimuladas por pulsos de la LH ó ICSH, para segregar androgenos 'Testosterona", que ademas parece ser la responsable de la división mitotica de las espermatogonias en una célula que continuará dividiendose y otra que quedará como respuesta para una proxima división. Moger y col 1987, Pomerantz y col 1987. Señalan la importancia de LH en la regulación de la esteroidogenesis de las células de Leydig. Fitzgerald 1990 reporta que en corderos hay concordancia entre episodios de secreción de LH y las secreciones de Testosterona. Meidan, Msuch citados por Maddocks, 1990 muestran que se han identificado receptores específicos en las células de Leydig para péptidos inhibitorios de esteroidogénesis como el factor parecido a la arginina-vasotocina (AVF), factor de crecimiento epidemial (EGF), glucocorticoides y catecolaminas. Los androgenos se difunden a las células de sertoli adyacentes y son vertidos a la circulación sanguínea cuando éstos retroalimentan tanto al hipotálamo como a la hipófisis para bloquear la liberación de adicional. Aunque buena parte de la testosterona vertida en los túbulos seminíferos se convierte en dihidrotestosterona (DHT) por medio de una reductasa, parte de la testosterona es convertida en estrógenos por una aromatasa, Se requieren concentraciones altas de testosterona para la maduración espermátide, pero la función exacta de cada andrógeno sobre el proceso espermatogénico no está bien estudiada. La FSH estímula la producción de estrógenos los cuales son secretado por las células de Sertoli en animales inmaduros. Su papel en animales adultos es.
(16) mínima debido a la pérdida de actividad de aromatasa en la pubertad, lo que ocasiona que la mayor producción de esteroiodes en animales maduros toma lugar en las células de Leydig (Maddocks, 1990). La célula deserto¡¡ es blanco para FSH, la cual después de estimulada secreta proteína ligadora de androgenos testículares (ABP) hacia el epididimo. Las células de sertoli tienen tambien receptores para testosterona e igual secretan inhibina que ejerce un feedback negativo sobre la secreción de FSH. Reportes de Winters, 1990 indican que tambien existe contribución de inhibina por parte de las células de leydig y peritubulares mioides. PROTEINA LIGADORA DE ANDROGENOS (ABP) Russefl y col en 1989 reportan sobre la habilidad de las células de sertoli en cultivos para secretar ABP, lo que muestra que estas células estan genéticamente programadas y son capaces de realizar estas funciones independientemente de otro tipo de células. El ABP forma un complejo con el andrógeno y se transporta junto con los espermatozoides en el epididimo. Las células epiteliales del epidídimo requieren concentraciones relativamente altas de andrógeno y se transporta junto con los espermatozoides en el epididimo. Las células epiteliales del epidídimo requieren concentraciones relativamente altas de andrógeno para su función normal (Figura 9). LA INHIBNA La inhibina o foliculoestatina es un péptido gonadal de aproximadamente 31 a 32 KDa compuestos de 2 subunidades alfa y beta. la síntesis de la subunidad alfa es claramente FSH dependiente sin embargo la subunidad beta no esta definida (Byerley y col., 1990). En toros de carne la inmunización activa contra la subunidad alfa de la inhibina incrementa los niveles de FSH y la densidad espermática testicular (MacDonald y col., 1991, Schanbacher, 1990). La inhibina tiene 2 grupos que son independientes con cadenas alfa-beta(a) o alfabeta(b) que inhiben la liberación de FSH del lóbulo anterior de la pituitaria. La unión de 2 subunidades beta (beta(a) - beta(a); beta (a) - beta (b); beta (b) beta (b), dan origen a un potente estimulador de la secreción de FSH (Stewart, y col., 1988)..
(17) La inhibina parece jugar un papel importante en la regulación del feedback negativo de la FSH durante el periodo prepuberal en machos (Fitzgerald y col., 1990, Schanbachetr, 1990 y Jakubowiak y col., 1990) La inhibina produce un efecto de retroalimentación negativa sobre la secreción de FSH pero no sobre LH, la vía para actuar la inhibina parece que se produce en las células de sertoli; atraviesa la membrana basa¡ y pasan al sistema linfatico testicular y finalmente al sistema circulatorio y afectan el hipotalamo. Ademas de las células de sertoli otras células testículares y unas no gonadales han sido tambien implicadas en la producción de inhibina. Investigaciones de MacDonald, 1991 indican que durante el periodo de transición del estado infantil al prepuberal las concentraciones de inhibina plamática se incrementan y al administrar Naloxone se observa un elevado LH plasmático, pero no de FSH. Posterior a la 10 semana de edad en los bovinos se ha observado una relación inversa entre las concentraciones plasmáticas de inhibina y FSH. Las concentraciones de FSH se incrementan entre la 4 a 10 semana de edad, precediendo al aumento inicial de inhibina entre la 10 y 12 semana de edad, éste rápido incremento coincide con la baja de FSH. El segundo pico de FSH después de la 12 semana de edad se mantiene desde la 20 semana hasta la 32 semana de edad. mientras la inhibina decrece hacia la 36 semanan de edad. La concentración de T4 plasmática y longitud testícular aumentan simultáneamente con el segundo pico de FSH plasmática en la 14 sm de edad (MacDonald, 1991) En los bovinos la actividad sexual del macho se incrementará en los meses de invierno cuando la duración del día es más corta especialmente en el hemisferio norte (Sumano y col., 1986).. COMPOSICION DE LA LH Y FSH Tanto la LH como la FSH, así como el resto de las hormonas adenohipofisiarias, están constituidas por dos cadenas peptídicas denominadas subunidades alfa y beta. Al disociarse, ninguna de ellas retiene su actividad biológica pero, al recombinarse actúan, la alfa llevando la especificidad de la hormona y la beta como subunidad común a todas las hormonas de la adenohipofisis..
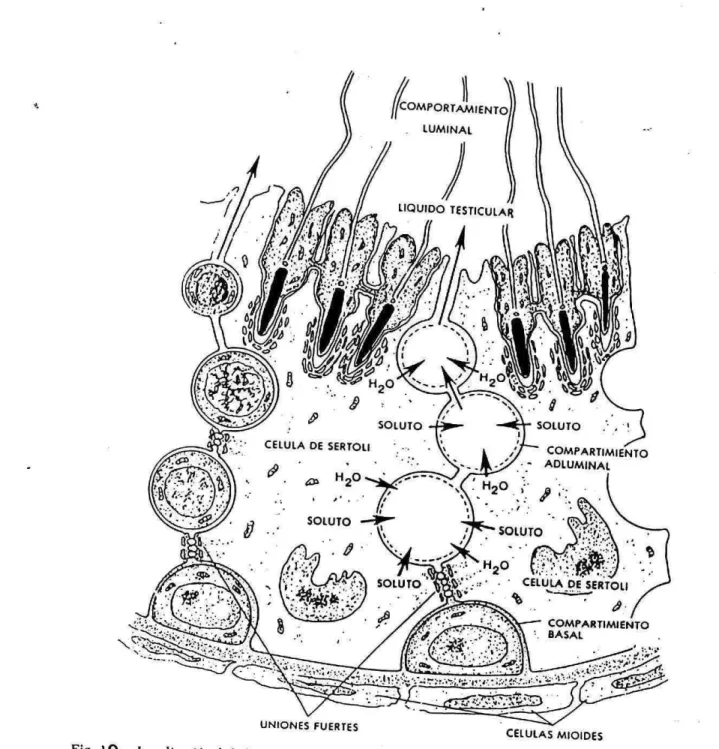
(18) PROTEINAS TRANSPORTADORAS EN LAS CELU LAS TESTICULARES Reportes de RAJAN 1990 señalan la presencia de 3 proteínas transportadoras en las células testículares RBP (proteína transpotadora de retinol plasmático) a nivel del túbulo seminifero, CRBP (Proteína transportadora de retinol celular) localizada en las células deserto¡¡ y la CRABP (Proteina transportadora de Acido retinoico celular) en células germinales; sus niveles se incrementan por acción de T4 y FSH. La presencia de CRBP en epididimo proximal sugiere un papel en la maduración espermática, aunque aún se desconoce. FACTORES INMUNOREGULATORIOS La respuesta inmune del bovino esta influida tanto por factores exógenos (estrés y nutrición) como endógenos (hormonas) (Hunter, 1989). El animal adquiere su vocabulario inmunológico de propio antes del nacimiento. Debido a que el esperma es producido en la pubertad y posee antigenos proteicos que son sintetizados durante la espermatogénesis, principalmente en el estado de espermatocito secundario el organismo puede reaccionar contra ellos (Cadavid, 1991). La respuesta inmune antiesperma ocurre como resultado de una ruptura o imbalance en los mecanismos protectores normales que incluyen: La barrera hematotesticular y los factores inmunosupresores y mecanismos inmunoreguladores. BARRERA HEMATOTESTICU LAR: Las células germinales en desarrollo están protegidas contra cambios químicos de la sangre por medio de una barrera de permeabilidad especializada, la barrera hematotestícular tiene dos componentes principales 1) la barrera parcial o incompleta de las células mioides que rodean el túbulo y 2) las uniones singulares entre células de sertoli adyacentes (Figura 10). La barrera hematotesticular no sólo impide la entrada a ciertas sustancias, sino que tambien parece funcionar en la retención específica de ciertas.
(19) concentraciones de sustancias como andrógenos unidos a proteina (ABP), linfocitos, proteinas de alto peso molecular, inmunoglobulinas, inhibina e inhibidores de enzimas dentro de los compartimientos luminales de los túbulos. Ademas las células de Sertoli fagocitan y degradan activamente espermatozoides dañados y productos residuales que serian fuente de estímulación antigénica si salieran de los túbulos seminiferos. La barrera puede romperse por trauma físico, químico, infeccioso, obstrucción de conductos o vasectomias resultando en exposición de los antigenos espermáticos al sistema inmune con la resultante respuesta inmune humoral y celular (Austin, 1983; Hunter, 1989; Pollanen 1990 y Cadavid, 1991).. FACTORES INMUNOSUPRESORES Y MECANISMOS INMUNOREGULADORES. Las células inmunes son reguladas localmente en el testículo por las células de Leydig, células de sertoli y macrofagos testículares. Estos efectos son mediados por muchos factores peptidicos: Factores parecidos a la IGF-1, TGF-b, NGF-b, EGF, GnRH, GH, SP (sustancia P) y Hormona Liberadora de la Tiroxina (TRH); Inhibina (INH), Activina, Transferrina, Derivados de los producidos por Células Leydig (POMC), Laminina, espermina y espermidina.. Células de Leydig: Se encuentran adyacentes a los macrofagos testículares in. vivo y fijan linfocitos y macrofagos inespecíficos a su membrana. Estas células suprimen la proliferación linfocítica por medio de la activina, a y b- endorfinas, aMSH (Hormona estimulante de los melanocitos), Met-encefalina, SP indicando un papel específico en la supervivencia de implantes (Pollanen, 1990).. Células de Sertoli: Estas células, al igual que las células germinales son. negativas para antigenos clase 1 del CMH en testículo de rata y humano, y para clase II en cordero, rata, humano y ratón. Esto probablemente, protege a las células espemiatogénicas de la destrucción por linfocitos CD8+.. Un factor parecido a la interleukina / alfa (tlL-l) es producido por estas células al. inicio de la pubertad bajo control hipofisiario con efectos de regulación de la espermatogenesis y mediador de los procesos inflamatorios, junto con INH, Transferrina, Laminina, Activina e IGF-1. Macrofagos: La ausencia de macrofagos en el testículo del camero no le. concede un estado inmunoprivilegiado como si ocurre en el hombre y la rata..
(20) Los macrofagos responden a la FSH para producir lactato, estan envueltos en la regulación de las células de Leydig; y, en la pared del túbulo y tejido intersticial previenen la exposición de autoantigenos a linfocitos CD4+.. La protectina: Previamente conocida como 'proteína inmunosupresiva testícular". se produce al inicio de la pubertad en toros, cerdos, conejos y ratón y su actividad es baja o ausente en el camero. Se conocen 4 isoformas de esta proteína.. La protectina puede bloquear receptores de células T y de IL-2, mediadores de la estímulación de linfocitos dependientes de un sistema de AMPc. El suero de yegua preñada (PMSG), la gonadotropina coriónica humano (hCG) y Estrógenos (E2) incrementan su actividad. La protectina juega un importante papel en la supervivencia prolongada de transplantes en testículo y puede estar involucrada en la regulacide la espermatognesis (Hunter, 1989 y Pollanen, 1990).. Espermatocitos y espermátidas: En el espermatozoide humano se han detectado antigenos específicos: LDH-C4, Acrosina, Hialuronidasa, Ag del grupo ABO y antígeno HY (Cadavid, 1991).. Anderon, 1987 reporta que el porcentaje de espermatozoides HY+ decrece durante el transporte desde el testículo hasta el conducto deferente. Welch, 1990 describe una proteina autoantigénica nuclear (NASP) presente en el núcleo del espermatocito temprano (leptoteno) que se pierde antes de la liberación del espermatozoide.. FACTORES QUE AFECTAN LA ESPERMATOGENESIS Dentro de los factores tenemos la radiación la cual produce mayor efecto en las etapas de división, las espermatogonias son mas sensibles que los espermatocitos. La herencia es un factor importante en la espermatogéflesis como es en el caso de hipoplasia testicular, en aplasia segmentaria de los conduntos de wolf y en la criptorquidia. La edad del animal es diferente de acuerdo con la especie para que se presente la espermatogeflesiS. La senitud afecta la espermatogénesis y si va acompañada de una deficiencia extrema de nutrición se suspende la espermatogenesiS. La deficiencia severa de vitamina A y E puede afectar la espermatogéfleSiS..
(21) Van Pelt, 1990 señala sobre la importancia de la vitamina A en le mantenimiento de la espemiatogénesis normal. Se ha comprobado que la deficiencia prolongada en ratas resulta en arresto espermatogénico en prelectoteno seguido por una pérdida extensiva de epitelio germinal. La deficiencia de minerales como el molibdeno, el zinc y el magnesio tambien la pueden afectar. La temperatura de igual manera.. RESPUESTA DEL FOTOPERIODO Por respuesta a la luz los animales domesticos pueden clasificarsen en 3 grupos. 1.. Aquellos en la que la pituitaria es activada por periodos de iluminación diaria cortos o decrecientes (corderos y cabros).. 2.. Aquellos en que es activada por periodos largos o crecientes (caballos y asnos).. 3.. Aquellos en los que la sensibilidad a la estimulación fotoperiódica es dificil de caracterizar (bovinos y cerdos).. En el toro la espermatogénesis y la esteroidogenesis resultan menos afectadas por las variaciones en el fotoperiodo diario. La mayoria de los investigadores han encontrado que la calidad del semen es inferior en el verano y superior en invierno o primavera. (Hansel, y McEntee, 1978, Pomerantz and Jansz, 1987).. TRANSITO EN EPIDIDIMO, MADURACION ESPERMATICA Y ALMACENAMIENTO El transporte de los espermatozoides se realiza a través del epididimo, que durante su transito sufre un proceso de maduración en el que adquiere la capacidad de fecundar el óvulo. Los espermatozoides son transportados en el toro en unos 7 días, el tiempo de tránsito puede reducirse de 10 a 20% al aumentar la frecuencia de eyaculados. Ademas Los cambios funcionales que ocurren durante el paso por el epidídimo incluyen el desarrollo de la capacidad de movilidad progresiva refleja, cambios.
(22) progresivos de flexibilidad y patrones de movimiento de sus flagelos Estos patrones se vuelven más prominentes a nivel de cola y conducto deferente. Vija Y Araghavan en 1990, reporta diferencias en el contenido de calcio en los espermatozoides de la cabeza y cola del epidídimo bovino junto con una mayor permeabilidad de la membrana de la pieza media. El paso de los espermatozoides a través de la cabeza del epididimo resulta en incremento de 20 veces su concentración, pH más ácido y la osmolandad se incrementa. Los iones de sodio, potasio y cloro disminuyen y los fosfatos aumentan. En la cabeza del epididimo el epitelio sintetiza y secreta proteínas al fluido que luego se involucran con la membrana plasmática de la espermátida ocasionando cambios metabolicos. v.g. la Galactosil-transferasa y proteínas de 18 y 24 KDa, las cuales son capaces de modificar la cinética y capacidad aceptora de la GT-asa (Moore, 1990). BeUve, 1990 reporta otras proteínas de las células germinales (tecinas) de 75 y 80 KDa presentes en espermatogenesis sufren un procesamiento proteolítico durante la maduración para dar origen a proteínas de 50 a 48 KDa (BelIve, 1990). Algunos estudios en animales de laboratorio indican que los componentes secretores de las células epiteliales que revisten el epidídimo involucran a sustancias como la inmovilina y al denominado factor de quietud en el toro en el prolongamiento de la supervivencia del espermatozoide al prevenir un metabolismo innecesario. La proteína parece desempeñar una función importante en la movilidad progresiva del espermatozoide de bovino. La alteración de las propiedades estructurales de los elementos de la cola se funda en las pruebas que indican que la formación de enlaces disulfuro se presentan durante el transito del epididimo. Durante este transito el AMPc aumenta al doble en el espermatozoidede bovino, hay cambios significativos en la cromatina del nucleo del espermatozoide, cambios en la maduración del acrosoma, a medida que aumenta la capacidad de movilidad progresiva, el espermatozoide sufre una pérdida progresiva de agua y un aumento correspondiente en su gravedad específica..
(23) DESARROLLO DEL POTENCIAL FECUNDANTE EN EL EPIDIDIMO ri. Los espermatozoides desarrollan su capacidad inicial de fecundar el óvulo durante su tranporte a través del epidídimo. El desarrollo de la capacidad fecundante corre pareja con cambios en varios aspectos de la integridad funcional del espermatozoide: a) adquisición del potencial de sostener la movilidad progresiva; b) alteración de los patrones metabólicos y el estado estructural de los organelos específicos de la cola; c) cambios en la cromatina nuclear; d) cambios en la naturaleza de la superficie de la membrana plasmática; e) movimiento y pérdida de la gota protoplásmatica y f) modificación, por lo menos en algunas especies, de la forma del acrosoma.. ESPERMATOZOIDE El espermatozoide es una célula altamente especializada que ha evolucionado para ejecutar como función única la fecundación del ovocito (Figura 11). La cabeza se halla especializada para penetrar en el ovocito y liberar su carga genética. La cola contiene la organización metabólica para producir energía y proporciona el mecanismo impulsor para la movilidad de la célula espermática. La cabeza del espermatozoide (Figura 12), es primariamente un núcleo ovalado y aplanado que contiene cromatina altamente compacta, cubierto en la parte anterior por el acrosoma "caperuza cefálica" que es un saco membranoso de doble pared, intimamente adherido al núcleo durante las últimas etapas de su formación. El segmento ecuatorial del acrosoma es importante porque forma parte del espermatozoide junto con la porción anterior de la región posacrosómica, la cual inicialmente se une con la membrana del oocito durante la fecundación La cola (Figura 13.1, 13.2, 13.3), esta compuesta de cuello, porción media, porción principal y pieza terminal. El corazón central de la pieza media, junto con toda la longitud de la cola, constituye el axonema. Este se compone de 9 pares de microtúbulos dispuestos en posición radial alrededor de dos filamentos centrales. Estos microtúbulos estan rodeados por 9 fibras densas o gruesas que parecen estar relacionadas con 9 parejas del axonema. El axonema y las fibras densas asociadas de la pieza media, están cubiertas en su periferia por numerosas mitocondrias que parece que son la fuente energética necesaria para la motilidad espermática..
(24) ESTRES Y SECRECION DE ANDROGENOS El estrés físico o sicológico resulta en la activación del sistema nervioso simpático incluyendo secreción de la médula adrenal si el estrés es severo. El papel de las catecolaminas en la respuesta testícular al estrés es dificil de interpretar ya que la secreción de otras hormonas especialmente ACTH y glucocorticoides también se afectan. La secreción testicular de testosterona es reducida por una gran variedad de estresores en vanas especies. El efecto del estrés no es inmediata pero una disminución en las concentraciones séricas de testosterona son usualmente vistas a pocas horas de la aplicación del estrés. La aplicación crónica de estrés intermitente reduce la concentración sérica de testosterona (Linconl and Ebling, 1985).. MASCU LINIZACION La diferenciación sexual empieza del día 25-35 de la gestación en el bovino y se completa a los 45 días donde ya es aparente la actividad esteroidogénica testícular (Ford and D'occhio, 1989). El segundo factor liberado por las gonadas es el factor de los androgenos testículares que producen masculinización. La masculinización de los organos sexuales de los fetos machos comienza en el bovino después del día 45 de gestación y es rapida hasta el día 70. La primera fase sensitiva para la diferenciación sexual del cerebro en el bovino parece ocurrir después del día 60 de la gestación. Como se sabe los principales esteroides testículares son: la androstenediona, testosterona y androsterona. El primero precursor del segundo y el último es el principal metabolito de excreción. En los fetos bovinos machos la concentración de androstenediona circulantes son mayores que las de testosterona hasta cerca del día 100 de la gestación..
(25) Despues delcual disminuye y se estabiliza hasta el nacimiento (Ford and D'occhio, 1989). Posiblemente en el bovino la androstenediona juega un papel más importante en la masculinización del cerebro. La testosterona se aumenta en los machos al día 240. Las concentraciones circulantes de androstenediona son más altas que las de testosterona del segundo al cuarto mes de edad después del nacimiento del macho..
(26) BIBLIOGRAFIA -. Amann, R.P. and Waiker, O.A. 1983. Changes in the pituitary-gonadal axis associated with puberty in Hoistein bulis. J. Anim Sci. 26:174.. -. Anderson, G.B. 1987. Identification of Embryonic Sex by detection of HY Antgen. Theriogenology. Vial 127 No 1:81-91.. - Austin, C. R. and Short. 1983. Reproduction in Mammals. Book 1 Germ Celis and Fertilization. Cambridge University Press London. 2th Edition. Beilve, A. and Chandrika, R. 1990. Polar distribution ontogeny and transition of a novel peptide domain dunng spermicgenesis and sperm maduration in the mouse. In Supplement 1. Biology of Reproduction. Vol 42. Abstract No 252. Berdtson, E.; lgboelt. G. Number of sertoli celis, quautitative rates of sperm production and the efficiency of spermatogenesis in relation to the daily sperm out and seminal quality of young beef bulls. Am.J.Vet.Res. 50(8):1193-1196. - Braunhut, S. J. and rufo,. G. 1990 . The seminíferous growth factor induces proliferation of TM$ cells in serum-free medium. Biol. Reprod. 42:639-648 -. Byerley, DA; Bertrand, J.K; Berardinelly, J.G. and Kiser, T.E. 1990. Testosterone and lutinizing hormone response to GnRH in yearling bulis of different libido. Theriogenology. vol. 34, No 6, pg 1041-1049.. -. Cadavid, A. 1991 Inmunobiología de la reproducción. Re y. Colombiana de Obstetricia y Ginecología. 42 (2): 103-106. -. Cardozo, J. y Jiménez, D. 1990. Endocrinología del macho. Posgrado Universidad Nacional de Colombia. Mimeografiado. sin publicar. - Deaver, D. and Peters, J. 1988. Age-related changes in secretion of LH and metabotism of hipotalamic amines in buli calves prior to puberty. Biol Repod. 39: 622..
(27) -. De Lahunta, A. and Naden, D. 1985. The embriology of domestic animal. Ed William and Wilkins USA.. -. Falase, E. and Koft, G. 1990. Comparative analysis of plasma EGF concentrations, hormonal profiles and semen parameters of fertility and subfertile males. Supplement 1 Biol Reprod. 42, Abstrac No 92.. - Fitzgerald, J.A. and Stellflug, J.N. 1990. Effects of melatonin on seansonal changes in reproduction of rams. Joumal of animal science, vol 69, pg 264-275. -. Ford, J.J. and D'occhio, M.J. 1989. Differentiation of sexual behavior in cattle, sheep and swine. Joumal of animal science, vol. 67, pg 18161823. -. Galina, C.; Santiel; Valencia, J.; Becerril, J.; Bustamante, G.; Calderon, A; Duchateau, A.; Fernández, S.; Olguín, A.; Paramo, R. Zarco, L. Reproducción de animales domesticas Ed. ¡¡musa S.A. 1988. primera edición. Mexico.. -. Hafez, E. S. E. 1989. Reproducción e Inseminación Artificial. Ed interamericana S.A. Sexta Edición. Mexico.. - Hansel, W. and McEntee, K 1978. Procesos reproductores masculinos (fisiología de los animales domésticos. Dukes y Wenson). Tomo II, Ediciones Aguilar, pg 1649-1701. - Hess, R.A. 1990- Quantitative and Qualitative characteristics of he stages and transitions in the cycle of the rat seminiferous epithelium: light microscopic observations of perfussion-fixed and plastic embedded testis. Biol. Reproduction 43:525-542. -. Holly, L. 1983. Bases Biológicas de la reproducción bovina. Ed. Acnbia. España.. -. Hunter, A.G. 1989. Syrnposium Reproductive lnmunology. lnmunology and Fertility in the bovine. J. of Dairy Science. 72:3353-3362.. -. Huertas, R. H. 1989. Propiedades fisiogeneticas de los bovinos criollos y su interacción con el ambiente. Memorias ACOVEZ 1989..
(28) -. Jackson, 1988. Angiotensyn 1 and II role in testis. Endocrinology. 123(1):50-55.. -. Jakubowiak, A; Janecki, A; Steinberger, A. 1990. Of inhibin secretion in static and superfused sertoly ceH cultures in response to follicle-stimulating hormone. Bilogy of reproduction, vol 43, pg 939945.. -. in equine differences Seansonal 1991. Larry. Johnson, spemiatocitogenesis. Biology of Reproduction, vol 44, pp 284-291.. - Linconi, G.A.; Ebling, F.J.P. 1985, Effects of constant release implants of melatonin on seasonalcycles in reproduction prolactin secretion and moulting in rams. Joumal Reproduction Fert. vol 73 pg 241-253. -. MacDocks, S.; Parvinen, M.; Soder, 0. 1990. Regulation of the testis, J. Reprod. lmmnol. 18: 33-49. -. McDonald, L. E. 1978. Reproducción y Endocrinología Veterinarias. Ed. Interamericana S. A. Segunda Edición. Mexico.. -. MacDonald. R.l.,D.; Deaver, D.E. and Schanbacher, B.D. 1991. In Holstein bu¡¡ calves: responses to castration and (or) estradiol. Joumal of Animal Science, vol 69, pg 276-282.. - Mendigana, C. y Díaz, C. A 1990. Función testícular y maduración seminiferous espermática. Posgrado Universidad Nacional de Colombia. mimeografiado. sin publicar. - Moger, W.H.; Anakwe, 0.0. and Murphy, P.R. 1987. Catecholamine effects on leydig celi steroidogenesis. Endocrinology and physiology of reproduction pg. 221-232. - Mohan, J.; Moudgal, R.P. 1990. Variation in angiotensyn onverting enzyme activity in the testis of prepubertal, pubertal and adult cockerels. Theriogenology. 34(2):319-324..
(29) Moore A. et al. 1990. An 18 kDa androgen-regulated protein that modifies galactosyltransferase activity is synthesized by the rat caput epididymis, but has no structural similanty to rat milk alphalactoalbumin. Biol. Reprod. 43: 497-506 -. Polfanen, P.; Euler, M.; Soder, 0. 1990. Testicular lmmunoregulatory factors. J. Reprod. Immunol. 18: 51-76. -. Pollanen, P.; Soder, 0. 1989. lnterleukin 1-a stimulation of sperrnatogonial proliferation in vivo. Reprod. Fertil. De y. 1:85-87. -. Pollanen, P.; Uksila J. 1990. Activation of the inmune system in testis. J. Reproduc. lmmunol 18:77-87.. the. Pomerantz, D. K and Jansz, G. F. 1987. Evidence for intratesticu lar factors which mediate the response of leydig cells to disruption of spemiatogenesis. Endocrinology and Physiology of Reproduction, pg 233-241 Rajan, N.; Sung, W.; Goodman, D. 1990. Localization of celular retinolbinding protein m-RNA in rat testis and epididymis and its stagedependent expression during the cycle of the epithelium. Biol. Reprod. 43: 835-842. -. Roberson, S. 1986. Veterinary Obstetrics and Genital diseases. (theriogenology). Ed. Edwards Brother INC. USA. 3th Edit.. - Russell, L.D., Steinberger, A. 1989. Sertoli cells in culture: Views from the perspectives of an in vivoist and an in vitroist. Biology of reproduction. Vol. 41, pp.571 .577. -. Salvat. 1983, Diccionario Terminológico de Ciencias Médicas. Edición Salvat España.. - Schanbacher, B.D. 1990. Pitutary and testicular responses of beef bu¡¡ to active immunization against inhib alpha. Joumal of animal science, vol 69, pg 252-257..
(30) - Steger, R.W. and Gay-Primel, E. 1990. Effects if melatonin inyections on the celulity of goldem hamsters pituitaries te secrete prolactin and luteinizing horrnne. Biology of reproduction, vol 42, pg 217-221. - Stewart, H.J.; Jones, D.S.C.; Pascall, J.C.; Popkin, R.M. and Flint, A.P.F. 1988. The contribution of recombinant DNA techniques to reproductive biology. Joumal reproduction fertility. vol 83, pg 1-57. -. Sumano, L. H.; Cambers, O.L. Farmacología veterinaria. Macgraw Hill México, D.F. pg 495-539.. - Thompson, D.L. and Southem, 1. 1984. Active inmunization of prepubertal boars agains T4: testicular and endocrine responses at 14 months of age. J. Animal Sci. 51(6):1498-1504. -. Van Pelt, M. 1990. Role of Vitamin A rat spermatogenesis. Biol. Reprod. 43(3): 363-367.. -. Velásquez, P. J. 1990. Espermatogénesis. Posgrado Universidad Nacional de Colombia. Mimeografiado. sin publicar.. - \fijayaraghavan, S. and Hoskins, D. D. 1990. Changes in mitocondrial calcium handling propierties during epididymal sperm maduration. Supplement 1 BicI, Reprod. Abstract No 251 Walker, M.P.; Thompson, D. L. Godke, R. A. and Honey, P.G. 1984. Active imunization of prepubertal bull against T4: Seminal and testicular characteristics after puberty. Theriogenology. 22(3)269278. -. Welch, J. 1990. Localization of nuclear autoantigenic protein. BicI. Reproduction 43(4)568-574.. -. Winters, E. 1990. Role of inhibin in Sertoli cells. J. Clinic. Endocrin metab. 70(2) 548-550..
(31) GAMETOGENESIS ESP E AM ATOG E N ESIS. OVOGENESIS. 0. E SP E AM ATOGONI_Q. OVOGONIA. ESPERMATOCITO PRIMARIO. OVOCITO PRIMARIO. ESPI SE. OVOCITO SECUNDARIO ler CUERPO POLAR. ESPI. OVULO MADURO. 2dos CUERPOS POLARES. CIGOTO -. xxx. MACHO. IFIG. INTRODUCCION1.
(32) FIG 1. REPRESENTACION DE LA ESPERMATOGENESIS. espermatogonia Memb. basa¡ Espermatogonia Al de) cond. seminitero A2 " espeatogonia en reposo. E Espermatogonia AS. - la,. 7. •,7. 5••••SS. mitosis (2n). Espermatogonia A4 Espermatogonia Intermedia. •Ó.....B Espermatogoni tipo Espermatocito primario - - ira Div. Meiotica espermatocito secundario 2da Div. Meiotica. 0119**. SS...... espermatides. Y? 00000 00. o.
(33) u. 0.(0 p'xI. PIVI. 2 pl». C) z ^'O 'D plIn. Fig. 2 - Pasos de la. TIPOS DE CELULAs. 4(QD O a u u. (ii. 5(0.. w. o. "1. LI. U. J. 12. 1. J. cspermatogénesis en ci toro; se inicia con la esperrnatogonia tipo A. El recuadro central indíci, lo uociacjón celular de las 12 etapas del ciclo del epitelio seminífero. Los tipos de células son: A, In. II. etapas sucesivas de espermutogon1us PL, espermatocito en fase de preleptoteno, L, esperma t ocito leptoteno; Z, espermatocito cigoteno; P, espermatocito paqulteno de las etapas 1, V y X. II,espermatocito secundario; de¡ 1 al 14 son los pasos de la espermiogénesis en los que se muestra la fase de Colgi (pasos 1 a 3), la fase de ca pichón (pasos 4 u 7), la fase acrosómica (pasos 8 a 12) y la fase de maduración (pasos 13 y 14). (Adaptado de licrncitsun, SV.E. y Desjardins, C. Am. J. Anat., 140. 167-180.).
(34) t. r. -s . JJ, jr. .. .' h, hhc: u . Ji ti Iht,hh:3'j JiIL pi y 'ru .1 uJn;J JI a; y ;ip hIi ;nn ;ptIupJ '1hInJ JthJU (nIJIJ Ip hIuIJ)iJtn u';1r ophini n apu í injh P" Il hhi'aJ Shil I J •4. ,j:,nid ?j ILuhu!. (O9 X) Wfljj SVd *3 lu3"jd riluanDU? ? iptií tp ou.pnbd 9 p z:j ua 5cIwuc1 2 DL Z'JI I 13S) !l' P tIfl) Yri J dopix,j uc., (1IY S np ) SOh?fl' ¶( UtitWp n nnj 9 u JrIp. vlZ'nJLuo. -. np Oipi.tV. (001- Xi WTlalQIU(( SVd ( hP(0 1WPC1 uOJlLuJ.aÓs'a riir,4 U9ttItIp U un(o ap u.td t 0W0J Isa altI;pi.a (301 !(Ol,I ap tjfl() VI UO uooVjuJ n 'OpeJIlpruJ11 N() V0p10703 uda oi ap Vi(npe ul4 ,,. Cf1C \i UIO4.tUIIJØJyUI.f P UOl.)JIJipp 9' 9 J9t1. ii)JJfl OI1dn l " (1) oJciouO.) lS d'h 'P 9"P p 9 i ii nu Iyd wlIuIUrit cilIIJpti p oU uIw 2a''9uc. (r. ••'. .,. 0. o. o.
(35) La. .. n6el ap U 9 PU WO3 'P Vfl9O. Vd (:qIJ) ü9 x) Wfl3QW 1 3p 330 $LIQp P )JWi3 p oudiu J) IP U DI7UI pi1uLL3d. w 4 opuqunt!Q sowiSu ira s7pedruIP utLlu0Du (S) !Y-w4 evq cuciqww q !Yi npS. o s-i x1n1 o$auo ( pi.id '-i oii30. Z!U1 l0 I 3IdW tnI) U uI!3OIWrI XI !)Ud J3XI .3fflid wp,owua 'oInil9y p UU Jo 1!Jgfld51j JIUW3#U p333.13q33d i 3P0WW!IS. ..-... o-. •'. •-•'k'. -. .1091 V, ou3o-u ; !I) O 1e tU H (SI 50p0%03tU53 .1 1 53 1 °P p U) 3!)O I .WJ5 3 • (SJ !I0I.3 S Ç3 5(fl( uJ -Wi'd3() soIJ3cid fl&I 31 S- cJn2tzj °•I UQ oJJuuiwJs o(rJqçJl I p i('! I" 1I1(1 (tzq. 1091 ) U!30U1II'03 0W0I4 U3WO I aP U0!J q1 . Jo(nqI13J]UI J 3 Ir3I2. 1.101O.JIII0Jd c l 310u oppnpaJ oa 3s oç3'iJ p oiu3d -I vqnd:d Job 0UILJ01. C).
(36) b. )V\. /. Fig. Liberación de espermatozoides en mamíferos. Las etapas consecuentes muestran la extrusión gradual de la espermáude alargada en la luz, con retención do los cuerpos residuales interconectados. l.n liberación se debe a la atenuación del tallo del citoplasma que conecta la espermátide al cuerpo residual. Una vez que se separa el cuerpo residual, la célula se convierte en espermatozoide. (De Fawcett, D.W. (1975). En: llun dbook of Physiology, Vol. V. 110. Creep y E.B. Astwood [cds.) J3cthesda, American Physiologlcal Sovk-I y.). e.
(37) EN LA RGED CROSS-SECTION OF SEMIÑIFEROUS TUBULE. RETE TESTIS FLUID. ¡sise. \ TESTICULAR F L 1.1 1 D. SEMINIFEROUS TUBULES. GERM CELLS. CAUDA EPIDIDYMIS FIGURA 6.1. Asas de túbulos seminíferos. SERTOLI CELLS. MYOID 'CELL.
(38) FIGURA 6.2 Túbulo seminífero en el que se representa de manera esquemática la onda del epitelio sminífero en toda su longitud.. SPE.RMATOGENIC WAVE. rete testis—.-_-_._j_. ¡. tubuhjs redus u. p m a o. lx. :. vi. u. y. u,. C w a y e. ft?. -CC:.. x. u.. vi. CC. -. Vi. xi. 1e i. Nw. ninifi tubuje.
(39) 1 •• 39.8 (0). . ... 39.8. .. . .. Recto. .. .. Anestesiado. •.. •. Aorta. 1. 20±2'61.Anillo inguinal externo 38.6 • (5). •.• ....Arteria c permát ica interna 1. Vena es permática lntcrfl8. --. (. •. Cordón .• esp ermtCO. 364 () .,. \1 1O 2 ct. • :•I....... Espiral arterial : .• termina. .•. á.. 34 (1l. 3.3 4 (7;. (7). •(2).•. .'. Músculo cremáster. •. Vena testicular (5) .. . ........,. . . .. .. 34.2 (9. • •:. : •.. <. •. ••.a.. 5., Aiterja sobre el • testículo. :. L1,. Tejido testicular Tejido subcutáneo. del escroto :. r. V. •. Túnica vaginal. 21 ± 4 c Temperatura del aire (70±7F) delescrojo. •:. ? Lugares de medición y comparaciones de las teinpciatuius registradas en carneros despiertos y anestesiados. Cara lateral. Se ha inyectado hasta plenitud con Neopreno la arteria espermática interna qoedando expuesta-la zona inyectada por extirpación d e¡ plcxo pampiniforme y de la cúfica albugínea situada sobre la arteliá en el testiculo. Las cifras entre paréntesis indican ci número de temperaturas a partir de las cuales se obtuvo el promedio. * Lzs mediciones subcutáneas del escroto s hicieron debajo de la piel de la región posterior y no de la interior,' como se indica en la figura con flncs de ilustración solamente, (Waitcs, C M. H. y Moule, E. R. J Rcprod. Fertil. 2:217 196L) . ..
(40) CONTROL HORMONAL DE LA ESPERMATOGENESIS HIPOTALAMO_____ Gn—RH 1 Hipofisis anterior Retroalimentacion negativa de androgenos. LH 1. FSH. Retroalimentacion negativa de inhibina. 5 > \ESPERMATOZOIDES 6 MEIOSI\ Celulas de Leydig 3 Testosterona. 4. El. CUERPOS RESIDUALES. Celulas de SertoIj----. ESPERMATOGONIA. Cellutas germinales. 01. CR. ABP_____ ilca. 1. Prodiccion de factores de liberacion 7. Fagocitosis de CR p or las cela. de sertoli 2. Prosduccion LH estimulo celula Leydig 8. Produccion Inhibina para suprimir FSH 3. Produccjon testosterona estmulo espermatogonja y estimujacion LH 4. Division espermatogonja hasta meiosis 5. FSH estimuIaMejosjs 6. Espermatozoides maduros abandonan tubulo seminifero y dejan cuerpos residuales FIGURA 8.
(41) Leydlg ceH. Seminlferoua tubule. eminiferous tubule. Leydig ceil. (b). Fig. 3 (a) td (b). The horrnonaj rgu1rion of the test¡* funcnons in othcr tiuucl. ABP• md ogen-bjndj protein; AC, anci of adenyIaecycLase; C choleiterol; DHT, 5Z ..dihYcfroce,tOg terone; E, oetradoI; MC, myoid ccli; R. receptor.. FSH.
(42) ÇOMPARTIMJ ENTO ADLUMINAL. CELuIA DESERTOLI - COMPARTIMIENTO 8ASAL. N. UNIONES FUERTES. CELULAS MIOIDES. Fig. 10 Localización de la barrera hematoitisticular en la compartimentacjón de los espacios entre las células de Seriuli udyuecntcs. Las fuertes uron espaciaIiza4v, on(e hu cálulas da Sartuli forman la principal barrera de lcrmeabilidad entre sangre y testículos en casi Lodos los animales de granja. Estas uniones ocluyen. tos 5iepuran los espuetos ubicados entro las células de Serio¡¡ y forman los compartimientos basa¡ y adluminal. El COlnpurtilIIjeflh() bl está ucupudo por esperinutogonlas y cspermatocitos de etapa prcicptoteno; el acm. partimiento adiuminal contiene etapas ms avanzadas de espermatoclios y esperm4tldes. El compartimíent udituninal se comunica libremente con la luz de los Lóbulos semirdferos. Probablemente la secreción de Iit1ii ido te-sticular íavorec. e el transporte activo del soluto (iones). Se cree que las células de Serio¡¡ bombean el soluto en el coIul)arilnllent() adiuzninal, con lo que se crea un gradiente osmótico que podría dar origen al movimienlo (le i.guu. La secreción de líquidos fluye hacia el compartimiento luminal, en donde elabora la secreción llamada líquido testicular. (De Fawcctt 1975) En: Handbook of Physioloi, Sec. 7., Endocrinology. Vol. V. Niale Reproductive Systen R. 0. Grcep y E. B. Astwood [eds.), Washington. D.C., American Phy. siologicul Socicty.).
(43) SPERMATOZOA. ri6 u. GENERAL MORPHOLOGY (FAWCETTI DEVELOPI BIOL.• 44, 394-436 1975) COMPARISON. MAN RAT LOCK. BUIL eOAR RAM IIORSE. 1 JJ. .. HEAD.f. 1 f. Í ¡. .. .]ACROSOM1L CAP J.POSTACROSOMALREG4ON y... NECK. Í. ...... ¡ . .... }M;DDLEPIECE ANMULUS-. .... PRINCiPAL P$ECE. END PECE. BOVINE SPEJ (HAFEZ, REPRODI IN. E'.D PIECE.
(44) TO UNDERSTAND THE BASIC COMPONENTS OF THE SPERM ANO TFIEIR FUNCTIONS. TO UNDERSTAND THE OVERALL CHARACTERISTICS ANO FUNCTtONS OF SPERM. 1-IEAD STRUCTURE OF BOVINE SPERMATOZOA. ?IITOCHONDRIAL HELIX APICAL RIDGE. A CROS OM E PLASMA MEMBRANE. POST NUCLL CP. Nt) C LEUS.
(45) ¡. J. •. •. HEAD. :.. IMPLANTATION. , ' SOCKET. ."'. CAPITULUM. MITOCHONDRIAL HELIX. ... ,,.. 1. ......... •. • -. •. •. • .:'•. T*IG. 13.1. 9 OUTER COARSE FIBERS +2INNER DOUBE' • •.. TIJBULES. ;Ji i. The Tau. •. •.
(46) MC. LE. Fig. 13.1 lllIsIrauÓn grIic pie restlrn& las Car;rctefiIics IllIrI (l4ks de b JdC1 Iiltcrtfle(Ija clon ¡luitericri tic I. jica principal. Con objeto cic ritos. trar la csrrlrci ura inlcrna se ha extirpado parcilnteuc la membrana celular seccionando el flagelo. Membrana cc. hilar (CM): hélice unitocondrjal (Mil): crestas milocon. driales (MC): audili, <le Jenaco (IR), Indice Iihrt,s;u (FI 1); eIclt1cI1I0 lnuugii ti cli ical (LE); haz de la libra axial (A F13), t i ll e C1tlIsI;i de las flhICvC libr.s externas Krtiesas. las ""'!v" hihi:n i iii ruina ir <II>Iblc icz y el P Ur central tic fibras. (Scgiiit Saurke, R. (. y Alm1uiat. J . 0: Aun, J Anal. . /fl:1U5, ItJli'l.).
(47) Fig.¡3.2. 1 lsi racin g tl ica de I&* terminal. Se ha eliminado la membrana Cebilar y seccio. nado la pic.a principal para mostrar la esLrIctttra in terna, lllke niitoconcfraI (Mil); anillo de Jeitaen iJRj; par central Ile lil)rSs (CP); doblcte (1)); elemenin lorigi. t;ilin;il (l,E); tItIILL' lIr.,ia (¡1 1): IIiC,. terttiin;il (IP), (Según Sa;ukc. R. G. y A1nu1iiit. J . O. Am. J . A,i;tt. 115. 1litI, 11J64.).
(48) LA OOGENESIS Y EL DESARROLLO FOLICULAR.
(49) LA OOGENESIS Y EL DESARROLLO FOLICULAR. Alvaro Castro Hemández*. INTRODUCCION A las células sexuales, el espermatozoide y el óvulo, las cuales se unen para iniciar el desarrollo de un nuevo individuo, se les conoce con el nombre genérico de gameto. En el caso de todos los organismos superiores los gametos son producidos por individuos sexualmente diferenciados. La función de la reproducción, en primera instancia, es hacer que estos dos tipos de gametos se junten en condiciones óptimas para que se produzca un nuevo individuo, con el cual se perpetua la especie. En segunda instancia la reproducción mantiene indefinidamente el paquete genético de la especie que va siendo transmitido y heredado a las siguientes generaciones mediante la fusión exitosa de los gametos. Los gametos y las células de las cuales se originan constituyen el Plasma germinal. Este plasma, a diferencia del Plasma Somático, puede vivir indefinidamente en generaciones sucesivas, pero para que esto suceda tiene que haber una unión exitosa de una célula sexual del macho (espermatozoide) con una sexual de la hembra (óvulo). Estos dos gametos conjugados pasan al nuevo individuo la dote hereditaria completa de la especie (25). Las células de las cuales se originan los gametos, se llaman las Células Germinales Primordiales, las cuales aparecen muy temprano en el desarrollo embrionario de los vertebrados (25).. * M.V.Z., Ph.D., Investigador Principal Programa Nacional de Ecofisiología Animal, Corporación Colombiana de Investigación Agropecuaria (CORPOICA) REGIONAL UNO. C. l. Tibaitatá. Teléfono 286 00 21..
(50) HISTORIA DEL PLASMA GERMINAL EN EL CUERPO DEL VERTEBRADO. Las células germinales primordiales en los vertebrados son reconocidas en forma definitiva a una edad sorprendentemente temprana en el desarrollo embrionario. Esto ocurre aún antes de saber si el embrión va a ser un macho o una hembra, pues todavía las gonadas no han comenzado a tomar forma como órganos definitivos (25). Se ha encontrado que las célula germinales primordiales en los mamíferos se originan del endodermo, apareciendo en el humano en el epitelio del saco vitelino (Figura 1) entre la tercera y la cuarta semana del desarrollo embrionario (2, 14). Estas células son más grandes (Figura 2) que las células somáticas y poseen núcleos grandes, redondos conteniendo nucleolos prominentes (2, 4). Desde el sitio de aparición estas células emigran hacia los rebordes o crestas gonadales, ayudadas por enzimas lFticas y mediante movimientos ameboideos (4, 15). Se ha postulado que los rebordes gonadales secretan una sustancia quimiotáctica ("Teleferon » ) la cual atrae las células germinales (2, 29, 35). Algunas de estas células ocasionalmente pueden viajar pasivamente a través de la circulación sanguínea y anclarsen en la gónada en formación (2) (Figura 3). No todas las células germinales primordiales llegan a los rebordes gonadales. Algunas se pierden durante la migración y otras se degeneran en el camino (2). Durante la emigración las células germinales se multiplican por mitosis aumentando su número considerablemente cuando han colonizado la gonada (2). COLONIZACION DE LA GONADA PRIMORDIAL Las gónadas en los vertebrados se desarrollan como una agregación celular del borde superior de la capa visceral (somática) del mesodermo lateral, en la mitad posterior del cuerpo embrionario (Figura 3). Más tarde, la conección entre esta masa celular y la pared peritoneal (celómica) se constriñe lateralmente y la gónada queda suspendida de la pared peritoneal únicamente por una capa doble de peritoneo, el mesorquio o mesovano (6). La gónada primordial consiste de una capa de epitelio celómico (mesodérmico) engrosado que se situa en la cavidad corporal, lateral al mesenterio dorsal, cubriendo un núcleo de tejido mesenquimal. Al llegar las células primordiales al reborde gonadal se situan en la corteza y/o en la parte medular del reborde gonadal (2, 6). En general, en términos.
(51) CAVIDAD AMNIQT:CA. CEREBRO r. coP2. ALANTOIDES. 1. CELULAS GERMINALES PRIMORDIALES. SACO VELIN0. Fig. 1. Embrión humano de 24 días con su amnios. Las cltlas germinales primordiales (puntos negros) estan agrupadas en el techo del saco vitelino y en la pared ventral del intestino primitivo posterior. (Tomado de C.R. Austin y R.V. Short I. Germ Celis and FertilizaciOn. la . ed. 1972. London. p. 4)..
(52) Fig. 2. Una sección de un embrión humano de aproximadamente 31 días mostrando las células germinales primordiales en la pared del intestino primitivo posterior y en el mesenterio intestinal. Las células con más grandes que las células somáticas vecinas y una de ellas (flecha) esta en metafase mitótica (Tomado de C.R. Austin R.V. Short: I. Gerra Celis artd Fertilization, la. ed. 1972, London, p.2)..
(53) CORDON ESPINAL. PLACA. -{:•;;,. MUSCULAR. NOT000RDA.. 3. SE LOCALIZA EN LA GONADA. çr. AORTA -. MESENTERIO DORSAL. \ I NTESTINO. CAVIDAD CORMRIL. 1). RIÑON EMBRIONARIO. 2. MIGRAN A TRA VES DEL MESENTERIO 1. LAS CELULAS SEXUALES P RIMORDIALES SE RECONOCEN. !A. EN EL ENDODERMO DEL SACO. VrTELIP4O. -. Fig. 3. Sección esquemática a través de la parte rnc.dia corporal de un embrión joven, ilustrando la n:anera corno las células germinales primordiales se originan en el endodermo del sacc vitelino y emigran a la gonada en crecimiento (Tomado de B.M. Patten: Er1y Embryology of the Chick.5a cd. 1971. New York. p.13.).
(54) morfológicos, las células permanecen en la corteza si la gónada primordial se va a diferenciar en un ovario, mientras que el paso de las células a la médula (mesenquima) esta asociada con la diferenciación en un testículo (1,2). En los estadios tempranos de la diferenciación gonadal el sexo del embrión únicamente se puede diferenciar por estudios citogenéticos (X o Y); en términos de morfología e histología general la gónada esta indiferenciada y su diferenciación puede conducir a la formación de un ovario o un testículo de acuerdo a su constitución genética (2)(Figura 4). Puesto que el proceso que conduce a la formación de los gametos ocurre antes de la diferenciación sexual, podemos tomar las células germinales primordiales como un punto de partida común para la formación de los dos tipos de gametos (masculino y femenino)(Figura 5). Esta conferencia va a considerar únicamente la formación del gameto femenino. Por lo tanto nos vamos a limitar solamente a la formación del gameto femenino (oogénesis) en los mamíferos. OOGENESIS La oogenesis (Figura 6) puede ser mejor definida como la formación, desarrollo y maduración del gameto femenino. Este proceso comienza en la vida embrionaria y continua hasta el tiempo de la ovulación en la vida adulta (2, 4). La gónada indiferenciada de la hembra rápidamente toma la forma de la glándula del adulto, aunque diminuta (inmediatamente después del nacimiento en la mayoría de las especies). La población de células germinales rápidamente se transforman en oogonias en la gónada diferenciada. Las oogonias se multiplican rápidamente por mitosis. Así en el humano, de 1.700 células germinales que hay durante la emigración en el primer mes de gestación, se incrementa a 600.000 durante el segundo mes de gestación y cerca a 7 millones en el quinto mes. Luego esta población declina rápidamente a 2 millones al nacimiento por el proceso de atresia, pero otro factor que contribuye a esta declinación es el eventual cese de mitosis en las oogonias y su transformación en oocitos unas pocas semanas después del nacimiento en la mayoría de los mamíferos. De este punto en adelante los oocitos son incapaces de aumentar su número y por lo tanto el número de células germinales puede únicamente reducirse y esto ocurre con.
Figure



Documento similar
La expresión de OATP1C1, DIO2 y DIO3 en los somas de la glía radial, en las células precursoras de la zona ventricular y subventricular, en las células en migración en la
La coalición Herri Batasuna, tras el bache sufrido en 1980, en que pierde 35.000 votos respecto a las elecciones provinciales de abril de 1979, recupera en estos dos últimos años
4.10.3 Hospital Marina Mazatlán define como política que el profesional Médico de Guardia en turno deberá realizar la idoneidad de la prescripción a partir del perfil
1. LAS GARANTÍAS CONSTITUCIONALES.—2. C) La reforma constitucional de 1994. D) Las tres etapas del amparo argentino. F) Las vías previas al amparo. H) La acción es judicial en
Volviendo a la jurisprudencia del Tribunal de Justicia, conviene recor- dar que, con el tiempo, este órgano se vio en la necesidad de determinar si los actos de los Estados
Para alcanzar un verdadero desarrollo sostenible dentro del contexto de Gestión de Recursos Naturales debe existir procesos participativos y movilizadores de las
- Cada caja metálica se encuentra protegida con un doble embolsado estéril perfectamente etiquetado con información relevante, entre la que se encuentra la dosis de NC1 que
Esas adaptaciones requerirán conciliar la regulación de actividades abiertas a una competencia plena o acotada con los llamados servicios uni- versales sin alterar el modelo de