INSTITUTO POLITÉCNICO NACIONAL
Escuela Superior de Ingeniería Mecánica y Eléctrica
Sección de Estudios de Posgrado e Investigación
Unidad Profesional Adolfo López Mateos
“
ESTUDIO DE LA COMBUSTIÓN ENTRE UN
HIDROCARBURO Y OXÍGENO A PRESIÓN ATMOSFÉRICA
”
T E S I S
QUE PARA OBTENER EL GRADO DE MAESTRO EN CIENCIAS EN
INGENIERÍA MECÁNICA.
PRESENTA
ING. MIGUEL ADRIÁN MONTEJO EHUÁN
DIRECTOR DE TESIS DR. GEORGIY POLUPAN
INSTITUTO POLITÉCNICO NACIONAL
SEcRETAnín
oe
rNVESTrGecróruy
poscRADo
'r$.lP,fi{ililr.
ACTA DE REVISIÓN DE TESIS
En la Ciudad de México. D. F. siendo
las
17:00
horas deldía 25
del mes deFebrero
del
2014 ss reunieron los miembros de la Comisión Revisora de la Tesis, designada por el Colegio de Profesores de Estudios de Posgrado e lnvestigación depara examinar la tesis titulada:
.,ESTUDIO DE LA COMBUSTIÓN ENTRE UN HIDROCARBURO Y
E.S.I,M.E.
OXIGENO A PRESION ATMOSFERICA".
Presentada por el alumno:
MONTEJO EHUÁN MIGUEL ADRIÁN
Apellido paterno
aspirante de:
Apellido materno Nombre(s)
Con registro:
Alll2l0l415l2
MAESTRO EN CIENCIAS EN INGENIER|A UECÁruICR
Después de intercambiar opiniones los miembros de la Comisión manifestaron SU APROBACION DE LA
IESTS, en virtud de que satisface los requisitos señalados por las disposiciones reglamentarias vigentes.
LA COMISIÓN REVISORA
Director(a) de tesis
DRA. CLAUDIA DEL
PRESIDENTE DEL
TNS
TITU
TO
POLITECNI
CONACIONAL
sECRETAni,e »nNwsrueluóN
yposcnArro
zARTA
crs¡ó¡v
on
DERECHay
En la Ciudad de México, D.F. el dfa 25 del mes de Febrero del año 2014, el (la) que
suscribe Miguel A4riá4 Montejo Ehurtn alumno(a) del Programa de Maestría en Ciencias e{r lneeniería Mecánica, con número de registro
Al2!!52,
adscrito(a)a
Sección de estudios de Possr "ado e Iflvestigaciéq, manifiesto(a) que es el (la) auto(a) intelectual del presente trabqio de Tesis bajo la dirección del (de la, de los) Dr. Georeiy Poluoan y cedelos derechos del uabajo titulado "Estudio ds la combuptión entre un hidrocarburo y oxígeno
a
presión atmosférica",al
lnstituto Politécnico Nacional para su difusión, con fines académicos y de investigación.Los usuarios de la información no deben reproducir el contenido textual, gnáficas o datos del trabajo sin el permiso expreso del (de la) autor(a) y/o directo(es) del trabajo. Este puede ser obtenido escribiendo a las siguientes direcciones miguelmpntejoSS@.gmail.com, goolupan@ipn.{nx.
Si el
permiso se otorga,el
usuario deberá darel
agradecimiento correspondiente y citar la fi¡ente del mismo.AGRADACIMIENTOS
Agradezco a mi familia porque siempre me han apoyado en la realización de mis metas y han estado conmigo tanto en tiempos de abundancia como en tiempos de necesidad.
Agradezco a los amigos que he encontrado en cada etapa de mi vida, por su apoyo y el tiempo que hemos compartido.
CONTENIDO
NOMENCLATURA I
RESUMEN IV
ABSTRACT V
INTRODUCCIÓN VI
CAPÍTULO 1. GENERALIDADES
1.1 CONSIDERACIONES BÁSICAS 2
1.2 PROCESO DE COMBUSTIÓN 3
1.2.1 Relaciones aire-combustible 4
1.2.2 Análisis de primera y segunda ley en la combustión 4
1.2.3 Tipos de llama en la combustión 5
1.2.4 Límites de inflamabilidad 8
1.2.5 Temperatura adiabática de la llama 8
1.2.6 Fracción de mezcla 9
1.2.7 Longitud de la llama de difusión 10
1.3 PROPIEDADES TERMODINÁMICAS DE LOS GASES 11 1.3.1 Ecuaciones rectoras de los gases ideales 12 1.4 ESTUDIOS EXPERIMENTALES EN LA COMBUSTIÓN 13 1.5 APLICACIONES DE LOS GENERADORES DE VAPOR EN LA
INDUSTRIA PETROLERA 15
1.6 COMBUSTIÓN IN SITU 16
1.6.1 Combustión convencional 17
1.6.2 Combustión en reverso 18
1.6.3 Combustión húmeda 18
1.7 PANORAMA ACTUAL 20
CAPÍTULO 2. DESARROLLO DEL DISEÑO Y CONSTRUCCIÓN
2.1 COMPOSICIÓN DE LOS HIDROCARBUROS 23
2.1.1 Metano 23
2.2 CANTIDAD DE LOS REACTIVOS Y LOS PRODUCTOS 25
2.3 DISEÑO DE LOS QUEMADORES 26
2.3.1 Antecedentes 27
2.3.2 Flujo másico 27
2.3.3 Quemadores para gas licuado de petróleo 28
2.4 INSTRUMENTOS DE MEDICIÓN DE LOS FLUJOS DE GASES 34
2.4.1 Rotámetros 35
2.4.1.1 Factor de corrección por temperatura y presión 37 2.4.1.2 Factor de corrección por tipo de gas 38
2.4.2 Manómetros 39
2.5 ESTACIÓN METEOROLÓGICA 40
2.6 CÁMARA TERMOGRÁFICA 41
2.6.1 SmartView 42
2.7 CONSTRUCCIÓN DEL EQUIPO EXPERIMENTAL 43 2.7.1 Construcción de quemadores con conductos de alimentación 44
2.7.2 Estructura del banco 47
2.7.3 Fondo con escala graduada 48
2.7.4 Banco de quemadores 49
2.8 HERRAMIENTAS PARA EL ANÁLISIS DE DATOS 50
2.8.1 Media geométrica 50
2.8.2 Desviación estándar 50
2.8.3 Parábola de mínimos cuadrados 51
CAPÍTULO 3. RESULTADOS EXPERIMENTALES
3.1 CARACTERIZACIÓN DE LOS FLUJOS UTILIZADOS DURANTE
EL PROCESO EXPERIMENTAL 53
3.1.1 Flujo volumétrico para el gas licuado de petróleo 53
3.1.2 Flujo volumétrico para oxígeno 53
3.2 CARACTERIZACIÓN DE IMÁGENES DE LLAMA 58
3.3 PROCESO DE COMBUSTIÓN 58
3.3.1 Velocidad de gas licuado de petróleo uGLP = 5 m/s 60
3.3.2 Velocidad de gas licuado de petróleo uGLP = 10 m/s 63
CAPÍTULO 4. ANÁLISIS DE RESULTADOS
4.1 LONGITUD DE LLAMA DE DIFUSIÓN TEÓRICA 70 4.2 COMPARACIÓN DE LONGITUD MÁXIMA DE LLAMA TEÓRICA
CONTRA LLAMA EXPERIMENTAL 73
4.3 LONGITUDES DE LLAMAS DE DIFUSIÓN EXPERIMENTALES 76 4.4 DISCUSIÓN DE LOS RESULTADOS EXPERIMENTALES 88
CONCLUSIONES 89
RECOMENDACIONES 91
REFERENCIAS 92
ANEXO A. COEFICIENTES DE LA REACCIÓN QUÍMICA DE
COMBUSTIÓN 94
ANEXO B. MEDICIONES RELATIVAS DE LAS LONGITUDES
CARACTERÍSTICAS 96
ANEXO C. MEDIAS GEOMÉTRICAS RELATIVAS DE LAS
LONGITUDES CARACTERÍSTICAS 112
ANEXO D. DIBUJOS DEL BANCO DE QUEMADORES 116
ANEXO E. USO DE LA CÁMARA TERMOGRÁFICA IR TI55 123
RELACIÓN DE FIGURAS
Figura Título Página
1.1 Instalación común para la generación de vapor 2 1.2 Mechero de bunsen que presenta dos tipos diferentes de llamas 6
1.3 Llama laminar de difusión 7
1.4 Llama turbulenta de difusión 7
1.5 Apariencia de la llama visible para combustible 14
1.6 Bosquejo del problema, sistema coordenado, campo de velocidad parabólico 15
1.7 Esquema de combustión convencional 17
1.8 Esquema de combustión en reverso 18
1.9 Esquema del generador diseñado por Rao 19 1.10 Plataforma Akal-B situada en el golfo de México 20
2.1 Boquilla de metano 27
2.2 Boquilla #1 33
2.3 Boquilla #2 33
2.4 Boquilla #3 34
2.5 Fuerzas existentes en un flotador de un rotámetro 35 2.6 Rotámetro utilizado para medir el flujo de gas licuado de petróleo 36
2.7 Rotámetros para oxígeno 36
2.8 Nomograma para corrección de flujo en rotámetro por presión manométrica 37
2.9 Nomograma para corrección de flujo en rotámetro por gravedad específica 38
2.10 Manómetro utilizado para medir la presión en los gases reactivos de combustión 40
2.11 Estación meteorológica Paroscientific Digiquartz 40
2.12 Cámara termográfica Ti55 41
2.13 Ventana principal del software SmartView 42
2.14 Ventana secundaria que permite cambiar los parámetros ambientales en SmartView 42
2.18 Cortadora de tubo 46
2.19 Quemador #3 terminado 47
2.20 Estructura de soporte 48
2.21 Fondo con escala graduada 48
2.22 Banco de quemadores terminado 49
3.1 Imágenes del proceso de combustión 58
3.2 Dimensiones medidas en las termografías tomadas a las llamas del proceso de combustión 59
3.3 Pruebas realizadas para la boquilla #1 con velocidad uGLP = 5 m/s 60
3.4 Pruebas realizadas para la boquilla #2 con velocidad uGLP = 10 m/s 63
3.5 Pruebas realizadas para la boquilla #3 con velocidad uGLP = 15 m/s 66
4.1 Curvas de tendencia para longitudes de llama teórica 73 4.2 Curvas de tendencia de L*máx para uGLP = 5 m/s y Le = 0 y 1 77
4.3 Curvas de tendencia de L*nuc para uGLP = 5 m/s y Le = 0, 1, 4, 6 y 10 79
4.4 Curvas de tendencia de L*máx para uGLP = 10 m/s y Le = 0 y 1 81
4.5 Curvas de tendencia de L*nuc para uGLP = 10 m/s y Le = 0, 1, 4, 6 y 10 83
4.6 Curvas de tendencia de L*máx para uGLP = 15 m/s y Le = 0, 1 y 4 84
4.7 Curvas de tendencia de L*nuc para uGLP = 15 m/s y Le = 0, 1, 4, 6 y 10 87
E.1 Inserción de la batería en la cámara termográfica 124 E.2 Encendido de la cámara termográfica 124 E.3 Inserción de la tarjeta de memoria en la cámara termográfica 125 E.4 Procedimiento de enfoque de la cámara termográfica 125
E.5 Establecimiento del intervalo de temperatura y nivel en la cámara termográfica 126
RELACIÓN DE TABLAS
Tabla Título Página
2.1 Propiedades del metano 23
2.2 Propiedades del GLP 24
2.3 Propiedades del propano 24
2.4 Propiedades del butano 25
2.5 Medidas de la geometría de la boquilla de metano 27 2.6 Medidas de la geometría para las boquillas de GLP 32 2.7 Brocas utilizadas para fabricar las boquillas 45 2.8 Tipos de tuberías utilizadas en el quemador 46 2.9 Accesorios utilizados en la línea de alimentación de los gases reactivos 47
2.10 Accesorios usados para situar el manómetro en las líneas de alimentación de gases 49 3.1 Velocidades y flujos másicos para GLP 53 3.2 Coeficientes de la reacción de combustión para α = 0.98 54 3.3 Coeficientes de la reacción de combustión para α = 1.09 55 3.4 Velocidad de GLP y su correspondiente flujo másico 55 3.5 Flujo másico respecto a valores de uGLPy α 56
3.6 Velocidades de oxígeno con respecto a la velocidad uGLP y α 56
3.7 Flujos volumétricos de oxígeno con respecto a la velocidad
uGLP y α 57
3.8 Equivalencia de flujos de oxígeno para uGLP= 10 y 5 m/s 57
3.9 Equivalencia de flujos de oxígeno para uGLP= 15 m/s 57
3.10 Medias geométricas de las mediciones realizadas para los quemadores #1, #2 y #3 a
uGLP = 5 m/s 62
3.11 Medias geométricas de las mediciones realizadas para los quemadores #1, #2 y #3 a
uGLP = 10 m/s 64
3.12 Medias geométricas de las mediciones realizadas para los quemadores #1, #2 y #3 a
uGLP = 15 m/s 67
4.1 Temperaturas de llama adiabática para cada valor de α 71 4.2 Número de Reynolds por velocidad de chorro de combustible
uGLP 71
4.3 Relación correspondiente a cada valor de oxidante-combustible y fracción molar
α 72
4.4 Volumen, masa y densidad para cada valor de α 72 4.5 Longitudes de llama teórica para uGLP = 5 y 10 m/s 72
4.6 Longitudes de llama teórica para uGLP = 15 m/s 72
4.7 Comparación de Lmáx y Lf para uGLP = 5 m/s 74
4.8 Comparación de Lmáx y Lf para uGLP = 10 m/s 75
4.9 Comparación de Lmáx y Lf para uGLP = 15 m/s 76
4.10 Máximas mediciones relativas de L*máx y L*nuc 87
4.11 Mínimas mediciones relativas de L*máx y L*nuc 87
A.1 Coeficientes de reacción química de combustión para el intervalo 0.976 ≥
B.1 Mediciones relativas de las longitudes características para uGLP
= 5 m/s y Le= 0 97
B.2 Mediciones relativas de las longitudes características para uGLP
= 10 m/s y Le= 0 98
B.3 Mediciones relativas de las longitudes características para uGLP
= 15 m/s y Le= 0 99
B.4 Mediciones relativas de las longitudes características para uGLP
= 5 m/s y Le= 1 100
B.5 Mediciones relativas de las longitudes características para uGLP
= 10 m/s y Le= 1 101
B.6 Mediciones relativas de las longitudes características para uGLP
= 15 m/s y Le= 1 102
B.7 Mediciones relativas de las longitudes características para uGLP
= 5 m/s y Le= 4 103
B.8 Mediciones relativas de las longitudes características para uGLP
= 10 m/s y Le= 4 104
B.9 Mediciones relativas de las longitudes características para uGLP
= 15 m/s y Le= 4 105
B.10 Mediciones relativas de las longitudes características para uGLP
= 5 m/s y Le= 6 106
B.11 Mediciones relativas de las longitudes características para uGLP
= 10 m/s y Le= 6 107
B.12 Mediciones relativas de las longitudes características para uGLP
= 15 m/s y Le= 6 108
B.13 Mediciones relativas de las longitudes características para uGLP
= 5 m/s y Le= 10 109
B.14 Mediciones relativas de las longitudes características para uGLP
= 10 m/s y Le= 10 110
B.15 Mediciones relativas de las longitudes características para uGLP
= 15 m/s y Le= 10 111
C.1 Medias relativas de las longitudes características para uGLP = 5
m/s 113
C.2 Medias relativas de las longitudes características para uGLP =
10 m/s 114
C.3 Medias relativas de las longitudes características para uGLP =
I
Nomenclatura
Símbolo Nombre Unidades
# Tipo de quemador -
A Área m2
Ac Área del chorro de un fluido m2
AC Cociente aire-combustible en base másica kg/kg
AC Cociente aire-combustible en base molar kmol/kmol
4
CH
A Área de la boquilla de metano m2
AGLP Área de la boquilla de gas licuado de petróleo m2
C Carbono -
Cd Coeficiente de arrastre de un fluido sobre el flotador -
4
CH
D Diámetro de la boquilla de metano m
DGLP Diámetro de la boquilla de gas licuado de petróleo m
2
O
D Diámetro de la boquilla de oxígeno m
D*ZCA Razón del diámetro de la zona de combustión activa entre el diámetro del quemador m/m
E Fuerza de arrastre del fluido sobre el flotador N
E Energía liberada por unidad de tiempo kJ/s
e Energía específica liberada por unidad de tiempo kJ/kg·s
f Fracción de mezcla kmol/kmol
F Fuerza requerida para deslizar un cuerpo sobre un
fluido N
Frf Número de Froude para una llama -
g Aceleración de la gravedad 9.81 m/s2
G Media geométrica -
GLP Gas licuado de petróleo -
h Altura del canal m
w
h Espesor de la pared del canal m
h Entalpía sensible en el estado especificado kJ/kmol
o f
h Entalpía de formación en el estado de referencia estándar kJ/kmol
H2 Hidrógeno -
l Distancia de separación entre dos placas que se mueven en sentido opuestos m
L* Longitud adimensional para determinar la longitud real
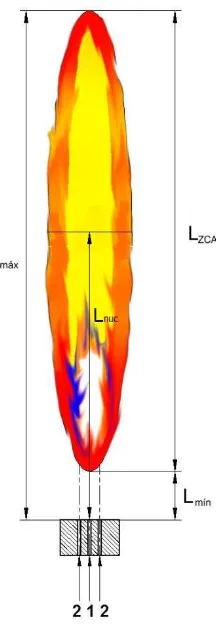
de la llama m/m
Lf Longitud teórica de llama m
Lf,t Longitud teórica de llama para un flujo turbulento m
LGLP Longitud del ducto de gas licuado de petróleo m
L*max Razón de la longitud máxima de la llama entre el
diámetro del quemador m/m
L*min Razón de la longitud mínima de la llama entre el
L*nuc Razón de posición de la temperatura máxima registrada en la llama entre el diámetro del quemador m/m
L*ZCA Razón de la longitud de la zona de combustión activa
de la llama entre el diámetro del quemador m/m
2
O
L Longitud del ducto de oxígeno m
m Masa de un gas kg
m Flujo másico de un gas kg/s
Maire Cantidad de sustancia de aire kmol
Mcombustible Cantidad de sustancia de combustible kmol
NA Coeficiente de cantidad de sustancia kmol
Ne Coeficiente de cantidad de sustancia en la entrada de
un flujo kmol
Np Coeficiente de cantidad de sustancia en los productos
de combustión kmol
Nr Coeficiente de cantidad de sustancia en los reactivos
de combustión kmol
Ns Coeficiente de cantidad de sustancia en la salida de un
flujo kmol
O2 Oxígeno -
P1 Presión absoluta en el fluido que pasa por el
manómetro kPa
P2 Presión estándar de calibración del rotámetro 101.325 kPa
PCI Poder calorífico inferior kJ/kg
i
P Presión parcial de un gas ideal kPa
Pm Presión en la cantidad de sustancia de un gas kPa
Po Presión estándar 101.325 kPa
Q1 Lectura observada del flujo en el rotámetro L/min
Q2 Lectura real del flujo en el manómetro L/min
QGLP Caudal del flujo de gas licuado del petróleo m3/s
QGLP, T Caudal del flujo de gas licuado del petróleo L/min
Qk Energía liberada por un proceso de combustión kJ
Qsal Energía liberada de un sistema kJ
R Constante particular de gas ideal kJ/kg·K
Ru Constante universal de gas ideal molar kJ/kmol·K
s Desviación estándar -
S Relación oxidante-combustible kmol/kmol
SCFH Pie cúbico estándar de aire por hora ft3/h
Sgen Entropía generada en un sistema kJ/K
Sp Entropía de los productos de combustión kJ/K
Sr Entropía de los reactivos de combustión kJ/K
i
s Entropía específica de un gas ideal kJ/kg·K
o i
s Entropía específica de un gas ideal en condiciones de referencia kJ/kg·K
T1 Temperatura absoluta del medio ambiente K
III
Tk Temperatura en la frontera donde QK cruza K
U Velocidad de combustible en un canal m/s
f
u Velocidad de un fluido m/s
GLP
u Velocidad del gas licuado de petróleo m/s
prom
u Velocidad promedio de un fluido m/s
2
O
u Velocidad del oxígeno m/s
V Volumen ocupado por un fluido m3
X Media aritmética -
Letras griegas
Símbolo Nombre Unidades
Coeficiente de oxígeno -
Valor de temperatura adimensional K/K
Viscosidad dinámica o absoluta del gas Pa∙s
Relación estequiométrica oxidante a combustible kmol/kmol
Densidad del gas kg/m3
Relación de equivalencia oxidante combustible kmol/kmol
RESUMEN
En esta tesis se estudiaron las características geométricas de una llama producto de la combustión de oxígeno y gas licuado de petróleo. En las investigaciones realizadas se mantuvieron contantes las velocidades uGLP = 5, 10 y 15 m/s y
fueron modificadas las variables de cantidad de oxígeno α y el tamaño de la longitud de cámara de combustión Le.
Se rediseñaron tres tipos de quemadores de metano para ser usados con gas licuado de petróleo (GLP) con diferentes configuraciones de longitud de ducto a fin de conocer las variaciones en la geometría de la llama. Se diseñó y construyó un banco de pruebas para quemadores de GLP el cual contó con manómetros para medir la presión y rotámetros para medir el caudal de los fluidos. Una escala graduada fue construida y montada en la estructura del banco de pruebas que permitió tener un punto de comparación y medir las longitudes características de las llamas. Una cámara termográfica fue usada para apreciar de una mejor manera el contorno de la llama en comparación a una cámara fotográfica.
V
ABSTRACT
In this thesis the geometric characteristics of a flame resulting from the combustion of oxygen and liquefied petroleum gas were studied. Investigations in the uGLP = 5, 10 and 15 m/sec and remained constants variables as the amount of oxygen and the α size combustor length Le was modified.
Three types of methane burners for use with liquefied petroleum gas (LPG) with different configurations of duct length to know the variations in the geometry of the flame were redesigned. We designed and built a testbed for LPG burners which had gauges to measure pressure and flowmeters to measure the flow of fluids. A Grad scale was built and mounted on the structure of the test allowed to have a baseline and measure the characteristic lengths of the flames. A thermal imaging camera was used to assess in a better way the outline of the flame compared to a camera.
INTRODUCCIÓN
En la actualidad se cuenta de una gran demanda de energéticos, por lo que en la industria es muy importante el uso eficiente de los mismos. La mayoría de los combustibles utilizados en el mundo son aquellos basados en hidrocarburos provenientes de la destilación del crudo de petróleo. Existe una gran industria en todo el globo terrestre que se dedica a extraer petróleo del subsuelo, el cual se encuentra cada vez a mayores profundidades.
Una de las forma para obtener petróleo del subsuelo es mediante generadores de vapor en los fondos del pozo, en los cual se requiere tener un conocimiento previo sobre el proceso de evaporación mediante combustión in situ.
Se cuenta con una amplia variedad de estudios realizados a las propiedades termodinámicas de los reactivos y productos de combustión, tanto considerándoles gases ideales así como también gases reales. Son comunes de encontrar los valores de energía interna, entalpía y entropía a diferentes temperaturas y presiones dadas. En menor grado es también posible hallar propiedades como la densidad y la viscosidad. En la bibliografía pertinente se encuentran diversos modelos matemáticos con los cuales se pueden obtener los valores de las propiedades.
Por otro lado, parámetros físicos como las dimensiones de la llama deben ser medidos por métodos experimentales para conocer su comportamiento cuando las dimensiones de los inyectores del combustible y el comburente son cambiados en los quemadores del generador.
El objetivo de esta tesis es estudiar el proceso de combustión entre el oxígeno y un hidrocarburo a presión atmosférica obteniendo los parámetros geométricos de la llama generada para el desarrollo del quemador en el generador de vapor en el fondo de un pozo petrolífero.
Se construirán tres tipos diferentes de quemadores los cuales se montaran en un banco con un fondo de escala graduada. Se usaran diferentes valores de mezclas de gas licuado de petróleo y oxígeno, así como diferentes longitudes de cámara de combustión para caracterizar las longitudes de llama obtenidas en los procesos de combustión.
VII
En el capítulo 1 se describe el fenómeno de la combustión así como de la clasificación de las diferentes llamas que se producen por la interacción química de un agente oxidante y un combustible gaseoso. También se describe como la combustión ha ayudado a la industria petrolera en la extracción de crudo en los yacimientos cambiando las propiedades físicas del fluido.
En el capítulo 2 se plantea el rediseño para los quemadores de gas licuado de petróleo a partir de la información conocida del metano. También se explica la construcción de los tres tipos de quemadores utilizados, así como del banco construido para las pruebas. Por último, se explica la metodología usada para el análisis de los resultados experimentales obtenidos del proceso de combustión.
El capítulo 3 contiene los resultados del cálculo previo a la experimentación para el flujo de gas licuado de petróleo y oxígeno determinados parar obtener diferentes relaciones de combustible-oxidante. La segunda parte consiste en una recopilación de las mediciones obtenidas durante el proceso de pruebas de combustión y realizar su posterior análisis.
En el capítulo 4 se hizo un análisis de los resultados obtenidos en las pruebas experimentales de combustión. Una primer parte constó de una comparación entre una llama teórica y su equivalente experimental. En la segunda parte del capítulo se construyeron gráficas con curvas de tendencia de los resultados experimentales por el método de los mínimos cuadrados parabólicos.
CAPÍTULO 1
Generalidades
2
1.1 CONSIDERACIONES BÁSICAS
Existen múltiples técnicas en la recuperación en yacimientos de petróleo, entre ellas se encuentra presente el empuje por agua, empuje por gas en solución, empuje por capa de gas, drenaje por gravedad, inyección de gas e inyección de vapor de agua. Esta última técnica consiste en evaporar agua desde un recipiente situado en la superficie por medio de una caldera e inyectar directamente a un pozo de petróleo por medio de una diferencia de presiones. Dicho procedimiento contribuye a ayudar a la recuperación de petróleo crudo, en especial de los hidrocarburos viscosos y pesados [1].
El vapor utilizado en tales técnicas se obtiene calentando agua tratada por medio de un proceso de combustión. Los generadores de vapor actuales son alimentados por gas natural o hidrocarburos líquidos (fig. 1.1, Donaldson), e incluso existen algunos que son alimentados con carbón mineral.
Fig. 1.1 Instalación común para la generación de vapor [1].
Estados Unidos de América y Rusia a generar nuevas tecnologías capaces de producir vapor a profundidades cada vez mayores. Se puede destacar que algunas de estas consisten en generar el vapor directamente en el pozo para evitar la mayor pérdida de calor por transferencia al medio y la energía suministrada por el vapor sea la suficiente para afectar las propiedades físicas del hidrocarburo y permitan su fácil extracción.
1.2 PROCESO DE COMBUSTIÓN
Se conoce como combustión a una reacción química de oxidación donde un material denominado combustible arde mientras que otro llamado comburente facilita la oxidación del primero. El comburente por excelencia es el oxígeno (O2)
[2].
En la reacción de combustión existe una liberación de energía principalmente en dos formas: Calor y luz. El calor procedente de la combustión es utilizado en diferentes aplicaciones, por ejemplo en la industria de la generación eléctrica para calentar agua hasta su estado de vapor y producir el movimiento de los alabes de una turbina acoplada a un generador eléctrico.
Los tipos más comunes de combustibles son aquellos provenientes de los hidrocarburos, que son sustancias formadas de hidrogeno y carbono, provenientes de la descomposición de residuos orgánicos durante millones de años
Dependiendo de los reactivos y productos de la combustión esta puede ser clasificada de dos formas. Cuando el combustible reacciona por completo con el oxígeno se le denomina combustión completa, para este caso se tiene dióxido de carbono y agua como productos para el caso de los hidrocarburos. Si el combustible no reacciona por completo con el oxígeno porqué este último es insuficiente, se conoce como combustión incompleta [3].
4 obtendrá al final como producto la misma cantidad de nitrógeno que al inicio, con la diferencia de un cambio en su temperatura.
1.2.1 Relaciones aire-combustible
Dos correlaciones utilizadas en el cálculo de las cantidades necesarias de combustible y aire son la relación aire – combustible y su reciproco, la relación combustible – aire. Estas dos relaciones son razones entre las masas moleculares de aire y combustible, determinadas de la siguiente manera:
moles de aire masa de aire
masa de combustible moles de combustible moles de aire
moles de combustible
aire comb aire comb M M M M aire comb M AC AC
M (1.1)
1.2.2 Análisis de la primera y segunda ley en la combustión
Debido a que la combustión en un proceso químico donde la energía del combustible se ve transformada, conviene escribir las relaciones de primera y segunda ley en relaciones de balance y energía.
La entalpía de una sustancia presente en la combustión se expresa por unidad de mol (ecuación (1.2))
Entalpía = o
o
f
h h h (1.2)
o o
o osal r f r p f p
Q N h h h N h h h (1.3)
El balance de entropía de un proceso de combustión se expresa como:
kgen p r k
Q
S S S
T (1.4)
Para condiciones diferentes a una presión de 1 atm el valor de la entropía para un gas ideal puede quedar especificado por la ecuación (1.5).
o
0
0 ( , ) ( , ) ln i m
i i i u
y P
s T P s T P R
P (1.5)
El trabajo reversible, que implica el máximo trabajo posible que puede obtenerse, para un proceso de combustión queda definida en la ecuación (1.6).
o o
o o0 0
rev r f r p f p
W N h h h T s N h h h T s (1.6)
1.2.3 Tipos de llama en la combustión
Se describe a la llama como una zona de reacción de combustión la cual se desplaza con respecto a la línea de gas que la alimenta [4].
Al respecto de las llamas, estas se dividen en dos tipos, dependiendo de su interacción con el oxidante.
a) Son llamas premezcladas donde los reactivos se mezclan antes de acercarse a la zona activa de combustión. Estas llamas sólo se obtienen si el combustible inicial y el oxidante se encuentran entre ciertas fronteras de composición llamados los límites de composición de inflamabilidad [4]. b) Las llamas de difusión se producen en cuando tanto la mezcla de
combustible y agente oxidante y la combustión se ocurren en la misma interfaz [4].
6 interior el combustible y el aire se mezclan y viajan a través del tubo hasta el exterior. Esta clase de dispositivo puede presentar dos tipos de llamas. Como se puede observar en la fig. 1.2 existe un cono interior donde se produce una llama de premezclado, en la parte exterior, cuando la combustión produce CO y la velocidad de la reacción lo permite, el producto anterior se mezcla con oxígeno en el aire y produce un tipo de llama por difusión [5].
Fig. 1.2 Mechero de bunsen que presenta dos tipos diferentes de llamas [5].
Fig. 1.3. Llama laminar de difusión [5].
En la figura 1.4 se ilustra una llama turbulenta de difusión, esta clase de llama son generalmente más luminosas que su contraparte premezclada debido al hollín presente. En este tipo de llama la velocidad del flujo de combustible y el diámetro de la boquilla influyen de manera significativa en la longitud que la misma presentará.
8 Para flujos donde las llamas son laminares la longitud dependen únicamente de la velocidad del fluido, mas no del diámetro de la boquilla. Durante la etapa de transición, mientras la turbulencia se empieza a incrementar, la longitud de la llama decrece. Cuando se encuentra en régimen turbulento pueden ocurrir dos casos. El primero que la longitud de la llama se mantenga constante lo cual ocurre para diámetro de boquillas 3.38 mm. El segundo caso ocurre cuando las boquillas se encuentran tienen un diámetro de 3.86 mm o superior, en este caso la longitud se incrementa a tasas decrecientes.
Se debe mencionar que cuando la velocidad del flujo es lo suficientemente baja, la base de la llama estará prácticamente pegada a la boquilla. Cuando la velocidad empieza a aumentar se empieza a generar un agujero entre el inicio de la llama y la boquilla. Con el incremento de la velocidad tal agujero empieza separar completamente la boquilla de la llama, fenómeno conocido como despegue. Si la velocidad es lo suficientemente alta existe la probabilidad de que la llama se apague.
1.2.4 Límites de inflamabilidad
Cuando se añade combustible a un medio oxidante, a medida que el combustible aumente en porcentaje se encontrarán dos puntos de interés para el estudio de la combustión. Al comienzo la mezcla no ardera hasta alcanzar un punto mínimo que es conocido como límite inferior de inflamabilidad. A medida que se aumente la cantidad de combustible se llega al segundo punto de interés conocido como límite superior de inflamabilidad, para el cual no tendremos mayor reacción de combustión que la que el oxidante presente nos permita.
1.2.5 Temperatura adiabática de la llama
energía por transferencia de calor mayor será la energía transportada por los productos, lo que a su vez incrementará la temperatura de los mismos, la que es conocida como temperatura de combustión adiabática.
Esta temperatura puede ser determinada por un balance de masa y energía como aparece en la ecuación (1.7).
o
os f e f
P s R e
N h h N h h (1.7)
1.2.6 Fracción de mezcla
Para un flujo de combustible puro y un flujo de oxidante puro existe una relación de mezcla llamado fracción másica y se expresa de la forma:
masa del material teniendo su origen en el flujo de combustible masa de la mezcla
f (1.8)
La fracción de masa puede ser definida en términos del combustible, el oxidante y la fracción másica de los productos en cualquier parte del flujo como:
f (1) YF
Fracción másica del material teniendo su origen en el flujo de combustible
kg de material combustible
kg de combustible
kg de combustible kg de mezcla
Pr 1 (0)
1 Y YOx
kg de material combustible
kg de productos
kg de productos kg de mezcla
kg de material combustible kg de oxidante
kg de oxidante kg de mezcla
10 Pr
1 1
F
f Y Y
(1.9)
1.2.7 Longitud de la llamade difusión
Los experimentos desarrollados por Roper dieron como resultados una serie de relaciones para diferentes tipos de geometrías del quemador en llamas de chorro laminar [5]. La relación para la longitud de la llama de difusión laminar queda expresada de dos formas, una obtenida teóricamente (ec. 1.10) y la otra experimentalmente (ec. 1.11)
0.067
,
/
4 ln 1 1/
F F
l t
f
Q T T T
L
D S T
(1.10)
,
/ 1330
ln 1 1/
F F
l t
Q T T L
S
(1.11)
En una llama de difusión turbulenta con un chorro de combustible que desemboca en un ambiente en reposo, existen cuatro factores que se deben de tomar en cuenta para determinar la longitud de llama:
• Importancia relativa del momentum del flujo inicial del chorro y las fuerzas de flotación que actúan sobre la flama o el número de Froude, Frf
• Estequiometria, fs
• Relación del gas en la boquilla respecto de la densidad del gas en el ambiente, ρe/ρ∞
• Diámetro inicial del chorro, dj
El número de Froude para una llama de chorro turbulento es:
3/2
1/ 4 s s 1/2
En las investigaciones se encontró una relación conocida como longitud adimensional (ec. 1.14) que corresponde a los otros tres factores mencionados que se deben tomar en cuenta para determinar la longitud de llama.
1/2 ( / ) f s j e L f L
d
(1.14)
Donde 1 1 s f S
(1.15)
Analizando los resultados experimentales en este tipo de llama por difusión se observaron dos tipos diferentes de regímenes. Un régimen dominado por la flotabilidad se expresa como
2/5 1/5 2 13.5 1 0.007 f f Fr L Fr Frf < 5 (1.16)
El otro régimen es dominado por el momentum, y se define como
23
L Frf > 5 (1.17)
1.3 PROPIEDADES TERMODINÁMICAS DE LOS GASES
12 La densidad es una propiedad que representa la razón de la masa propia del sistema entre el volumen que ocupa en el espacio:
m
V (1.18)
Cuando existe un movimiento aparente entre dos cuerpos que se rozan, existe una fuerza entre ellos que se opone a dicho movimiento. En los cuerpos solidos la magnitud de dicha fuerza depende del coeficiente de fricción, mientras que entre un sólido y un fluido o entre dos fluidos la propiedad que representa esta oposición es conocida como viscosidad absoluta o dinámica, la cual se puede representar como
Fl
AV (1.19)
En donde F es la fuerza requerida para mover un cuerpo con respecto a otro a una velocidad V separados por una distancia l y A es el área de contacto entre el cuerpo y el fluido.
1.3.1 Ecuaciones rectoras de los gases ideales
Existen diferentes formas de calcular las propiedades de densidad y viscosidad dinámica para los diferentes fluidos, dependiendo de la necesidad y el acceso a la información que se tenga. Por ejemplo, para el estado gaseoso la forma más sencilla de determinar estas características es considerándole un gas ideal, para lo cual se supone que las moléculas que lo componen son esféricas y no presentan interacciones entre ellas. El resultado que se obtiene entre un gas ideal y un gas real aumenta conforme los valores de temperatura y presión a la cuál sea calculada la propiedad se incrementen.
Las propiedades de un gas ideal pueden ser obtenidas a partir de la ecuación (1.20a):
pV mRT (1.20a)
En el caso de cantidad de materia, se puede evaluar también usando la ecuación (1.20b):
m m m m
P V NR T (1.20b)
Las moléculas que conforman un gas ideal son consideradas esféricas y en este caso en particular la presión a la que se encuentra sometido el gas no afecta en su viscosidad. Para el caso de una molécula esférica donde no interviene la presión en la viscosidad, esta propiedad puede ser determinada mediante la ecuación (1.21):
1/2
1/2 2
5 16
u
A
MR T
N (1.21)
1.4 ESTUDIOS EXPERIMENTALES EN LA COMBUSTIÓN
En cuanto a estudios de combustión se han realizado diferentes tipos de experimento para obtener parámetros geométricos y físicos de las llamas reproducidas.
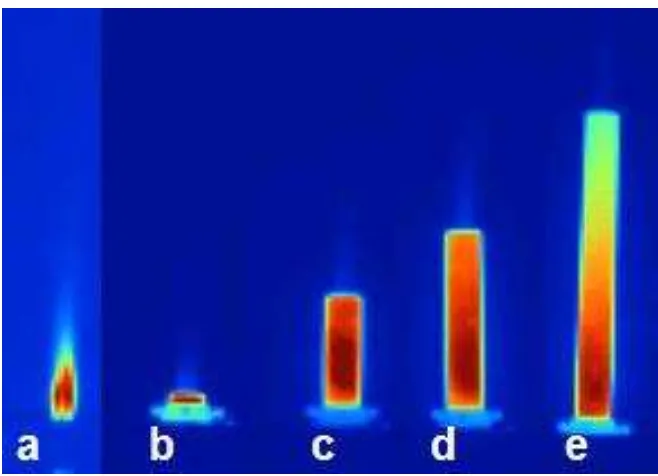
Kim, Oh y Yoon realizaron un experimento donde estudiaron la influencia de la composición de combustible en la longitud de la llama a partir de una combustión por difusión de una mezcla de chorros turbulentos de hidrogeno diluido y aire cuya dirección y sentido fueron coaxiales. El aire coaxial aumento la velocidad de mezclado con el combustible lo cual influyo en la longitud de la llama producida. Se usaron cuatro composiciones en volumen de combustible las cuales fueron: 100% H2, 80% H2/20% N2, 80% H2/20% CO2, y 80% H2/20% CH4. De igual forma
el fenómeno fue investigado con velocidades de uf = 86 – 309 m/s y ua = 7 – 14
m/s. El bosquejo de la definición de longitud de llamas y llamas obtenidas durante las pruebas para las diferentes combinaciones de combustible a uf = 86 m/s y uA =
14 en ambas mezclas el 100% de sus componentes fue un combustibles. En los casos de 80% H2/20% N2, y 80% H2/20% CO2 la altura de llama fue menor al
presentar una sustancia no reactiva y que actuó como lastre durante el proceso de combustión, disminuyendo a su vez la temperatura de la reacción [6].
Fig. 1.5 Apariencia de la llama visible para combustible compuesto: (a) 100% H2, (b) 80% H2/20% N2, (c) 80% H2/20% CO2, y (d) 80% H2/20% CH4. (e) Es la definición de longitud de llama utilizada [6].
llama se extingue dentro de un intervalo finito de valores de caudal, mientras que para Le> 1 no puede existir la llama para caudales mayores o menores que algunos valores críticos.
También se realizó un análisis de estabilidad lineal de llamas de dos dimensiones en estado estacionario. Se encontró que para las llamas simétricas con un bajo número de Lewis las pérdidas de calor producen un efecto de estabilización, mientras que para las llamas con un alto número de Lewis el aumento de las pérdidas de calor tiende a la desestabilización oscilatoria.
Fig. 1.6 Bosquejo del problema, sistema coordenado, campo de velocidad parabólico (U0> 0), curvas de nivel de velocidad de reacción típicas (mitad inferior: ω = 15, 30 y 45) e isotermas (mitad superior, θ a intervalos de 0.1, de θ = 0.1 a 0.9, θmax = 0.9667) calculado para el caso de la llama simétrica (d = 40, Le = 1, b = 0.03 y m = 0.8).
1.5 APLICACIONES DE LOS GENERADORES DE VAPOR EN LA INDUSTRIA PETROLERA
En la década de los 60 se construyeron y diseñaron generadores de vapor de un solo paso para uso en la industria petrolera. Debido a que no contaban con un cilindro de separación de vapor y sedimentos, la calidad del vapor debía ser de 80% para evitar la precipitación [1]. Finalmente este tipo de generadores no obtuvieran mucha aceptación en la industria.
16 en la tubería y de incrustaciones, así como también bajos niveles de óxidos de nitrógeno.
Tiempo después los esfuerzos se enfocaron en el uso de generadores alimentados por combustible líquido que alcanzo un 90% de la producción de vapor en la industria. En ellos el proceso de generación comienza con el envio del agua tratada al generador por las bombas de alimentación a la presión necesaria para inyectar el vapor en el pozo. Normalmente el agua es precalentada antes de pasar a el intercambiador de calor donde se dará el proceso de vaporización, aunque no se considera un paso necesario si el intercambiador ha sido diseñado para entrar en contacto con agua tratada a baja temperatura. El agua presente en los gases de combustión es reducida en temperatura y utilizada como medio para precalentar el agua de alimentación. Los gases de combustión pasan por una serie de tubos que se encuentran dentro de un área conocida como zona de convección. En un área conocida como zona de radiación los tubos ceden calor al agua precalentada la cual es transformada en vapor.
Los equipos modernos de generación de vapor presentan una serie de sistemas y dispositivos para incrementar la seguridad de su uso así como disponer de una eficiente entrega de vapor. Con las nuevas tecnologías se ha podido controlar las velocidades de combustible, aire y agua así como mantener una calidad uniforme de vapor con lo que la eficiencia del sistema se optimiza.
1.6 COMBUSTIÓN IN SITU
En la extracción de petróleo existen métodos conocidos como combustión in situ los cuales presentan dos características representativas de sus sistemas. En primer lugar, cerca de un 10% de los hidrocarburos presentes en el yacimiento petrolífero son quemados como combustible para la producción gases de combustión. La otra particularidad consiste en que un quemador es bajado al pozo de inyección para comenzar la combustión, y una vez logrado el encendido y los alrededores del pozo se hayan calentado el quemador es extraído mientras que se sigue inyectando aire para continuar con el proceso de combustión [8].
Existen tres tipos básicos de combustión in situ:
Combustión en reverso, en donde la zona de combustión avanza en forma inversa a los flujos de fluidos;
Y la combustión húmeda, en la cual se inyectan alternadamente vapor y agua a fin de lograr vapor que contribuye a una mejor distribución de calor.
1.6.1 Combustión convencional
La combustión convencional es también conocida como combustión seca debido a que existe nula inyección de agua en el proceso. En ella la ignición comienza cerca del pozo inyector de combustible desde donde comienza a avanzar hasta el poso productor (fig. 1.7).
Fig. 1.7 Esquema de combustión convencional [8].
18 1.6.2 Combustión en reverso
Para el caso de combustión en reverso el proceso comienza en el pozo producto y no en los inyectores, como el caso de la combustión convencional, lo cual queda ilustrado en la fig. 1.8.
Fig. 1.8 Esquema de combustión en reverso [8].
La zona de combustión en reverso se mueva en sentido contrario del flujo de aire, hacia donde el oxígeno aumenta. Este tipo de técnica es muy eficaz en petróleos muy viscosos, debido a que la viscosidad del crudo puede decaer en un factor de 10, o más [8].
Debido a que una parte del petróleo a extraer es quemado durante la combustión en reverso no es tan eficiente como la convencional además de requerir el doble de aire.
1.6.3 Combustión húmeda
una cantidad mayor a la mitad de la energía calorífica se encuentra entre el frente de combustión y el inyector de aire.
La técnica consiste en inyectar agua ya sea junto con el aire o intermitentemente y durante el proceso toda o parte del líquido se vaporiza con lo que se transfiere calor delante del frente de combustión.
Fig. 1.9 Esquema del generador diseñado por Rao [9].
En la misma familia de sistemas de combustión húmeda se encuentra el de Rao, el cual consiste tanto en un método de evaporación directa de agua dentro del pozo, así como el prototipo para realizar dicho efecto. Este sistema utiliza una mezcla de un combustible con aire o con oxígeno (O2). Se recomienda usar aire
enriquecido, debido a que el nitrógeno presente en éste es inerte durante la combustión, pero debe calentarse también, lo que impide alcanzar temperaturas altas en un corto periodo de tiempo. Es por ello que es preferible el uso de O2, y
20
1.7 PANORAMA ACTUAL
En México, gran parte de las zonas productoras de hidrocarburos (petróleo y gas natural en su mayoría) están localizados en la plataforma continental del Golfo de México y en la planicie costera. En la figura 1.10 se puede observar una de las plataformas situadas en el Golfo de México la cual es utilizada en la actualidad en la extracción de éste producto. Estudios realizados por Estados Unidos y emanaciones de aceite divisadas en el Golfo de México han identificado yacimientos en zonas profundas en esa área, zona donde se encuentra la mayoría de la actividad petrolera en México.
Fig. 1.10 Plataforma Akal-B situada en el golfo de México.
Existen dos problemas que México debe de tener en cuenta en cuanto en lo que a producción de petróleo se refiere. En primer lugar, de seguir utilizando las tecnologías convencionales para el año 2021 se tendrá un déficit en la producción de 500 mil barriles de petróleo diarios, comparados con el nivel de los últimos años que ha llegado hasta 3.1 millones de barriles diarios. El segundo problema emana del primero, pues el déficit diario en barriles de crudo se puede evitar explotando los yacimientos encontrados a profundidades mayores a las que se acostumbra, sin embargo los países dueños de la tecnología necesaria para aguas profundas no venden esa clase de sistemas y su renta a precio actual oscila entre los 500 mil dólares diarios.
cantidad de pozos superior a la que ha hecho en toda su historia en un tiempo menor. La otra posible solución es el desarrollo de una tecnología nacional similar a los prototipos desarrollados por Estados Unidos y Rusia para explotación de recursos de hidrocarburos en aguas profundas, como el hallado en Tuxpan, Veracruz a inicios de 2012 en el pozo exploratorio Puskon-1.
CAPÍTULO 2
DESARROLLO DEL DISEÑO Y
CONSTRUCCIÓN
En el presente capítulo se plantea el rediseño para los quemadores de gas licuado de petróleo a partir de la información conocida del metano. También se explica la construcción de los tres tipos de quemadores utilizados, así como del banco construido para las pruebas.
Por último se explica la metodología usada para el análisis de los resultados experimentales obtenidos del proceso de combustión.
2.1 COMPOSICIÓN DE LOS HIDROCARBUROS
Los hidrocarburos son compuesto orgánicos que contienen únicamente hidrogeno y carbono en sus moléculas. Existen diferentes aplicaciones para cada tipo de hidrocarburo, la más común es usándolas como combustibles.
El combustible planeado para usar durante la fase de experimentación fue el metano, pero debido a su alto costo por unidad de masa se prefirió usar un hidrocarburo compuesto (gas licuado de petróleo) cuya disponibilidad es mayor.
2.1.1 Metano
El metano es un gas inodoro e incoloro que bajo ciertas condiciones de presión llega a la fase líquida. Es empleado como combustible y representa por encima del 80% de la composición del gas natural. Algunas de sus propiedades más relevantes se enlistan en la tabla 2.1.
Tabla 2.1 Propiedades del metano.
Propiedad Valor Fórmula
química
CH4
M 16 kmol Temperatura
de autoignición
595 °C
PCI 50,050 kJ/kg
2.1.2 Gas licuado de petróleo
24 gases inodoros se le debe añadir un odorizante para lograr identificar posibles focos de fugas. Las características más representativas del GLP distribuido por PEMEX se encuentran enlistadas en la tabla 2.2 [10].
Tabla 2.2 Propiedades del GLP.
Propiedad Valor
Fórmula química C3H8 + C4H10
Composición másica de propano (C3H8) 60%
Composición másica de butano (C4H10) 40%
Composición molar de propano (C3H8) 53.2%
Composición molar de butano (C4H10) 46.8%
Para rediseñar los parámetros geométricos de los quemadores para metano en su equivalente a GLP utilizados durante la experimentación se necesitó conocer las propiedades de cada componente de la mezcla de hidrocarburos.
El propano es un alcano inodoro e incoloro, inerte con la mayoría de los materiales a temperatura ambiente. Forma la parte dominante de GLP con un 60% del volumen. Sus propiedades más representativas se encuentran enlistadas en la tabla 2.3
Tabla 2.3 Propiedades del propano.
Propiedad Valor Fórmula
química
C3H8
M 44 kmol Temperatura
de autoignición
540ºC
PCI 45,370 kJ/kg
Tabla 2.4 Propiedades del butano.
Propiedad Valor Fórmula
química
C4H10
M 58 kmol Temperatura
de autoignición
405ºC
PCI 46,340 kJ/kg
El GLP presenta límites de inflamabilidad muy próximos entre sí y cercanos al 100% de oxígeno, los cuales quedan definidos por el propano. Para dicho gas, se tiene un límite inferior de 2.4% (97.6%) por debajo de la mezcla estequiométrica y 9.6 por encima de ella (109.6%) [11].
2.2 CANTIDAD DE LOS REACTIVOS Y LOS PRODUCTOS
Cuando producimos algo es deseable saber cuánta cantidad de materia prima necesitamos para tener cierto número de productos, o viceversa, cuanto producto podemos obtener teniendo cierta cantidad de materia prima. En química para analizar una reacción en s forma cuantitativa es necesario conocer las masas molares y aplicar el concepto de mol. Todo lo anterior se
logra por medio de la estequiometría que “es el estudio cuantitativo de reactivos y productos en una reacción química” [12].
Existe un proceso de combustión ideal durante el cual todo el combustible suministrado al sistema es quemado por completo con el aire teórico conocido como combustión estequiométrica o teórica de dicho combustible. La combustión teórica del metano es:
4 2 2 3.76 2 2 2 2 7.52 2
CH O N CO H O N (2.1)
El mismo modelo se aplicó al GLP usando oxígeno puro en lugar de aire para obtener una combustión completa dando como resultado
2 3 8 4 10 2 2
5.6O 0.532C H 0.468C H 3.4CO 4.4H O (2.2)
26 con el combustible para formar la molécula de dióxido de carbono por lo que se trata de una combustión incompleta. La ecuación para el GLP con defecto de oxígeno es
2 3 8 4 10 2
aO bC H cC H dCO eH O (2.3)
En la otra forma se puede obtener un proceso en el que la cantidad de oxidante sea mayor que la estequiométrica, y como resultado de la misma dentro de los productos de combustión existe una cantidad de oxígeno que no reacciona durante el proceso y funge como un lastre puesto que disminuye la temperatura de los gases combustión. Para GLP con exceso de oxígeno la ecuación es
2 3 8 4 10 2 2 2
iO jC H kC H lCO mO nH O (2.4)
El mol es la unidad de cantidad de materia utilizada en química durante el balanceo de ecuaciones químicas. Cada coeficiente que aparece durante la ecuación perteneciente a los compuestos son cantidades molares, y regularmente es necesaria su conversión a otro tipo de unidades para ser útiles en términos ingenieriles, casi siempre gramos o los derivados de esa magnitud. Se deben seguir los siguientes pasos para el balanceo de ecuaciones químicas y la respectiva conversión de las cantidades molares a otras unidades:
1) La ecuación química es escrita incluyendo los coeficientes desconocidos como incógnitas, luego se realiza el balance por medio de ecuaciones algebraicas.
2) Se necesita tener en moles toda cantidad de sustancia que interactúa durante el proceso químico, por lo que se deben convertir a esta magnitud.
3) Se utilizan los moles de las cantidades conocidas para balancear los moles de las cantidades desconocidas.
4) Una vez obtenidos todos los coeficientes molares se convierten en cantidades según las unidades en que se requieran para llevar a la práctica.
2.3 DISEÑO DE LOS QUEMADORES
2.3.1 Antecedentes
En la configuración propuesta de los quemadores para metano se usaron unas medidas específicas para las velocidades uf = uO = 5 m/s. Las medidas
aparecen reflejadas en la tabla 2.5.
Tabla 2.5 Medidas de la geometría de la boquilla de metano.
Diámetro del quemador
Diámetro de la boquilla de
CH4
Diámetro de la boquilla de
O2
25.4 mm 1.48 mm 4.15 mm
El diseño original conto con una salida o boquilla central de oxígeno y cuatro boquillas de alimentación de metano en una configuración en cruz (fig. 2.1)
Fig. 2.1 Boquilla de metano.
2.3.2 Flujo másico
El flujo másico mes la cantidad de masa que fluye por una sección transversal
28 fluye a través de una sección transversal por cada unidad de tiempo y se encuentran relacionados de la siguiente forma:
c prom
m V A u (2.5)
Otra relación importante ligada al flujo másico es la liberación de energía por unidad de tiempo de la manera que se encuentra representada en la ecuación (2.6).
E me (2.6)
2.3.3 Quemadores para gas licuado de petróleo
Con asistencia de los datos de apartados anteriores se procedió al rediseño de los quemadores para adecuarse al GLP.
Para el rediseño de los quemadores e decidió igualar la cantidad de flujo másico de los quemadores de metano con el de GLP. Un primer paso a realizar fue conocer la densidad de ambos gases, GLP y metano, considerando una temperatura de 15.5°C (288.65 K) y una presión de descarga de 101.325 kPa. El GLP posee una densidad a esas condiciones igual a 2.01 la del aire [10], por lo que se requirió calcular la densidad del aire a la temperatura y presión indicadas como gas ideal.
air air
P R T
(2.7)
101.325 0.287(288.65) air 3 1.207 kg/m air
Realizando el producto de la densidad de aire por el coeficiente de equivalencia a densidad del GLP
2.01
GLP air
(2.8)
3 2.01(1.207 kg/m )
Consecutivamente se determinó el valor de la densidad del gas metano como gas ideal a las mismas condiciones de presión y temperatura usadas para el aire 4 4 CH CH P R T
(2.9)
4 101.325 0.5182(288.65) CH 4 3 0.668 kg/m CH
A partir del conocimiento del valor de la densidad del metano se calculó el flujo másico en una boquilla del combustible. Se partió de conocer el área de la sección transversal de la boquilla cuyo diámetro fue 0.00148 mm
4 4
2 4
CH CH
A D (2.10)
4
2 (0.00148) 4
CH
A
4
6 2
1.7203 10 m
CH
A
Conociendo el área de la sección transversal y la densidad del metano se determinó el flujo másico a una velocidad uf = 5 m/s
4 4 4
CH CH CH f
m A u (2.11)
4
6
(0.668)(5)(1.7203 10 )
CH
m
4
6
5.746 10 kg/s
CH
m
Para tener una misma cantidad de flujo másico se recalculó el diámetro a partir despejando el área en la ecuación para flujo másico y usando los valores propios de GLP.
4
CH GLP
GLP
GLP f GLP f
m m
A
u u
(2.12)
6 5.746 10 (2.426)(5) GLP A 7 2
4.7368 10 m
GLP
30 Finalmente el nuevo valor del diámetro se obtuvo al despejar el diámetro de la circunferencia
2 4
GLP GLP
A D (2.13)
4 GLP GLP A D 7
4(4.7368 10 )
GLP D 4 7.76 10 m
GLP
D
O lo que es lo mismo
0.776 mm
GLP
D
Y para términos técnicos fue preferible redondear al siguiente decimal de una sola cifra y simplificar la manufactura del mismo, lo que finalmente resulto en
0.8 mm
GLP
D para una boquilla de GLP.
Conociendo el valor de la ecuación estequiométrica balanceada para la mezcla propano-butano que forma el GLP, se realizó un balance de masa para conocer el diámetro equivalente para el oxígeno a fin de obtener una combustión estequiométrica.
Se partió de conocer la ecuación balanceada propano-butano
2 3 8 4 10 2 2
5.6O 0.532C H 0.468C H 3.4CO 4.4H O (2.2)
Con los coeficientes molares conocidos se calcularon las masas equivalentes para el GLP en la ecuación. La masa del GLP se obtuvo de la siguiente manera
GLP 0.532(12 3 1 8) 0.468(12 4 1 10)
GLP 50.552 g
La masa del oxígeno se determinó de la misma forma que para el GLP
2
O 5.6 32
2
O 179.2 g
2 179.2 50.552 O GLP m m
2 3.544 (g/g)
O
GLP
m
m
Con la relación de masas y sabiendo el valor del flujo másico para una boquilla de GLP se procedió a encontrar el flujo másico equivalente para un chorro de oxígeno a fin de obtener combustión estequiométrica con cuatro chorros de combustible
2 3.544 g/s
g/s O GLP m m 2 3.544 O GLP
m m
2
3
3.544(4)(5.746 10 )
O
m
2
3
81.475 10 g/s
O
m
2
6
81.475 10 kg/s
O
m
El área de la boquilla de oxígeno fue despejada de la definición de flujo másico
2 2 2 2
O O O O
m V Au (2.14)
2 2 2 O O O m A u
La densidad del oxígeno fue calculada como gas ideal
2 100.325 (0.2598)(288.65) O 2 3 1.33 kg/m O
Una vez conocido el valor de la densidad, de calculó el área del oxígeno
6 81.475 10 1.33(5) A 6 2
1.2252 10 m
A
32 2 2 4 O O A D
(2.15)
2
6
4(1.2252 10 )
O D 2 3
3.94 10 m
O
D
2 3.94 mm
O
D
De igual manera se prefirió redondear al siguiente número entero más cercano a fin de simplificar la manufactura del quemador, por lo que el diámetro del oxígeno se aproximó a
2 4 mm
O
D .
Se decidió fabricar 3 tipos de boquillas diferente con relaciones de longitud entre diámetro con valores asignados de 1, 3 y 6 para conocer el efecto del conducto del gas en la longitud de la llama, dichas longitudes se encuentran plasmadas en la tabla 2.6.
Tabla 2.6 Medidas de la geometría para las boquillas de GLP.
# DGLP DO2 LGLP LO2
1 0.8 4 0.8 4
2 0.8 4 2.4 12
3 0.8 4 4.8 24
Fig. 2.2 Boquilla #1(Anexo D). La relación L/D asignada es de un valor de 1.
34
Fig. 2.4 Boquilla #3 (Anexo D). La relación L/D asignada es de un valor de 6.
Para la fabricación de las boquillas se eligió como material latón al 70% de cobre. Este material es una aleación de 70% cobre y 30% zinc, convirtiéndolo en un material fácil de maquinar, que fue conveniente para el caso estudiado, debido a los pequeños diámetro utilizados para el GLP. Otro parámetro benéfico fue la temperatura del punto de fusión del latón, que es de 955°C (1228.15 K), lo que posibilitó no presentar deformación por parte del metal durante el proceso de combustión pues la temperatura no ascendió hasta ese nivel.
Aunque las boquillas fueron diseñadas a una velocidad de 5 m/s para el GLP, también se utilizaron velocidades de 10 m/s y 15 m/s, por lo tanto el oxígeno también presento esas velocidades. Además se usaron velocidades diferentes para obtener mezclas de combustible-oxidante para los límites de inflamabilidad del GLP.
2.4 INSTRUMENTOS DE MEDICIÓN DE LOS FLUJOS DE GASES