Extracción y caracterización de metabolitos secundarios a partir de Bacillus thuringiensis
Texto completo
(2) R E S U M E N La búsqueda de microorganismos productores de compuestos biológicamente activos a partir de diversas fuentes naturales ha sido el fundamento de programas de investigación en antibióticos durante más de 30 años. Las especies de Bacillus son capaces de producir un amplio rango de metabolitos secundarios de naturaleza y estructura muy diferente mostrando un amplio espectro de actividades. Los metabolitos primarios son aquellos que se producen en la fase exponencial de crecimiento de un microorganismo y son necesarios para la sobrevivencia del microorganismo. Mientras que los metabolitos secundarios son moléculas sintetizadas por determinados microorganismos, que se producen en la fase estacionaria y aunque no son imprescindibles para el microorganismo, juegan papeles como la protección y supervivencia propia en el ambiente que lo rodea. La amplia variabilidad estructural de estos compuestos ha atraído la curiosidad de químicos y las actividades biológicas que poseen estos productos naturales han inspirado a la industria farmacéutica para buscar nuevas estructuras en cultivos microbianos así como en plantas. Muchos de los productos microbianos que tienen un gran valor comercial y económico son metabolitos secundarios.. El objetivo general de este trabajo es la extracción y caracterizacion de metabolitos secundarios y su purificación a partir de un extracto crudo de un cultivo celular de Bacillus thuringiensis cepa ELI52. A partir del extracto crudo se han logrado separar, purificar e identificar cuatro dicetopiperazinas: ciclo(L-Pro-L-Leu), ciclo(L-Pro-L-Val), ciclo(L-Pro-LPhe) y ciclo(L-Pro-L-Tyr) utilizando técnicas cromatográficas en columna, TLC y placa preparativa. Las estructuras de estos compuestos se lograron establecer por métodos espectroscópicos tales como RMN 1H, RMN 13C, COSY, HSQC y HR-MS.. 2.
(3) A B S T R A C T. The search for microorganisms producing biologically active compounds from various natural sources has been the foundation of research programs antibiotics for more than 30 years. Bacillus species are able to produce a wide range of secondary metabolites of very different nature and structure showing a broad spectrum of activities. Primary metabolites are those which occur in the exponential growth phase of a microorganism and are necessary for the survival of the microorganism. While secondary metabolites are synthesized by certain microorganisms, and are produced in the stationary phase and although they are not essential for the organism, they play roles as the protection and survival in the environment that surrounds they. The wide structural variability of these compounds has attracted the curiosity of chemists and biological activities of these natural products have inspired the pharmaceutical industry to find new structures in microbial cultures and plants. Many microbial products that have great commercial and economic value are secondary metabolites. The overall objective of this work is to obtain and purify secondary metabolites from a crude extract of a cell culture of Bacillus thuringiensis strain ELI52. From the crude extract has been separated, purified and identified four diketopiperazines: cyclo (L-Pro-LLeu), cyclo (L-Pro-L-Val), cyclo (L-Pro-L-Phe) and cyclo (L-Pro-L-Tyr) using chromatographic techniques such as column, and preparative TLC plates. The structures of these compounds were successfully established by spectroscopic methods such as NMR 1H, NMR 13C, COSY, HSQC y HR-MS.. 3.
(4) Í N D I C E Página Abreviaturas 1. Introducción 2. Antecedentes 2.1. Metabolismo secundario: fuente de productos antibactericidas y antifúngicos 2.2. Bacillus thuringiensis como agente de control biológico 2.3. Melanina, un pigmento fotoprotector 2.4. Dicetopiperazinas 3. Objetivos 3.1. Objetivo general 3.2. Objetivos particulares 4. Discusión de resultados 4.1. Obtención del extracto crudo 4.2. Análisis de la solubilidad del extracto crudo 4.3. Elucidación del ciclo (L-Pro-L-Leu) 4.4. Elucidación del ciclo (L-Pro-L-Val) 4.5. Elucidación del ciclo (L-Pro-L-Phe) 4.6. Elucidación del ciclo (L-Pro-L-Tyr) 4.7. Prueba de la actividad antibacteriana de los compuestos obtenidos 5. Conclusiones 6. Desarrollo experimental 6.1. Diagrama general de trabajo 6.2. Materiales y métodos 6.3. Extracción de metabolitos secundarios de B. thuringiensis cepa ELI52 6.4. Purificación y caracterización de los compuestos obtenidos de B. thuringiensis 6.4.1. Purificación y caracterización del ciclo (L-Pro-L-Leu) 6.4.2. Purificación y caracterización del ciclo (L-Pro-L-Val) 6.4.3. Purificación y caracterización del ciclo (L-Pro-L-Phe) 6.4.4. Purificación y caracterización del ciclo (L-Pro-L-Tyr) 6.4.5. Purificación y caracterización del ciclo (L-Pro-L-Tyr) 6.5. Prueba de la actividad antibacteriana de los compuestos obtenidos 7. Referencias. 5 7 9 9 14 17 21 22 22 23 24 30 37 45 50 60 62 64 65 66 67 68 70 72 74 76 78 79. 4.
(5) A B R E V I A T U R A S °C. Grados centígrados. Bt. Bacillus thuringiensis. CDCl3. Cloroformo deuterado. cm. Centímetros. COSY correlación). Correlation SpectroscopY (Espectroscopía de. DCPs. Dicetopiperazinas. DEPT. Distortionless Enhancement by Polarization Transfer. DMF. Dimetilformamida. DMSO. Dimetilsulfóxido. HRMS. Espectrometría de masas de alta resolución. HSQC. Heteronuclear Singular Quantum Coherence. Hz. Hertz. IR. Infrarrojo. J. Constante de acoplamiento. K. pneumoniae. Klebsiella pneumoniae. L. Litro. L. monocytogenes. Listeria monocytogenes. LB. Luria Bertani. MHz. Megahertz. min. Minutos. mL. Mililitro. 5.
(6) p.f. punto de fusión. ppm. Partes por millón. Rf. Retention factor (Factor de retención). RMN 13C. Resonancia Magnética Nuclear de 13C. RMN 1H. Resonancia Magnética Nuclear de 1H. RMN. Resonancia Magnética Nuclear. rpm. Revoluciones por minuto. Shigella spp. Shigella sin especie. TLC fina). Thin Layer Chromatography (cromatografía en capa. TSB soya). Tripticaseine Soy Broth (caldo de tripticaseína de. V. cholerae. Vibrio cholerae. V. parahemoliticus. Vibrio parahemolitycus Desplazamiento químico (ppm) RMN. 6.
(7) 1. I N T R O D U C C I Ó N La biotecnología emplea la biología, la microbiología, la química y otras áreas, con gran uso en agricultura, farmacia, ciencia de los alimentos, ciencias forestales y medicina. A partir de estas áreas se pudo descubrir nuevos fármacos de diferente origen, como son del mundo marino, de plantas o de animales, que tienen capacidad terapéutica en enfermedades ya conocidas o nuevas. Por otro lado, varios estudios han demostrado que ciertos patrones de uso indiscriminado de los antibióticos que están actualmente en uso provocan la aparición continua de organismos resistentes a estos antibióticos. Esta resistencia antibiótica demanda que se haga un renovado esfuerzo para buscar agentes antibacterianos efectivos contra las bacterias patógenas resistentes a los antibióticos actuales, por ello, la búsqueda de microorganismos productores de compuestos biológicamente activos a partir de diversas fuentes naturales ha sido el fundamento de programas de investigación en antibióticos durante más de 30 años. Dentro de todos los microorganismos, concretamente dentro de las bacterias, el género Bacillus, es capaz de producir un amplio rango de metabolitos secundarios de naturaleza y estructura muy diferente mostrando un amplio espectro de actividades. Estos metabolitos incluyen antibióticos, pigmentos, toxinas, promotores de crecimiento y otros compuestos bioactivos y están diseñados para capacitar a la bacteria para sobrevivir en su ambiente natural. Esta amplia variabilidad de estructuras y actividades de los compuestos secundarios expande el potencial de la importancia industrial y biotecnológica del género Bacillus con sus especies relacionadas.. 7.
(8) Nuestro grupo de investigación aisló una bacteria de Bacillus thuringiensis de un suelo de Mérida Yucatán que mostró una coloración marrón en placas de cultivo en crecimiento. Se pudo comprobar que esta cepa llamada ELI52 producía melanina, que es un agente fotoprotector lo cual fue corroborado por un IR comparado con la melanina estándar. El interés en esta cepa llevó a realizar varios estudios de antagonismo contra varias bacterias dando una fuerte actividad antagónica e inhibitoria contra bacterias muy importantes a nivel hospitalario. Por ello se sospechó que esta cepa podía tener metabolitos secundarios con actividad biológica, por lo que se propuso extraer y purificar metabolitos secundarios de esta cepa e identificarlos por diferentes técnicas espectroscópicas. Por lo que en este trabajo se propuso la extracción de metabolitos secundarios y su purificación a partir de un extracto crudo de un cultivo celular de Bacillus thuringiensis cepa ELI52. A partir del extracto crudo se han logrado separar, purificar e identificar cuatro dicetopiperazinas: ciclo(L-Pro-L-Leu), ciclo(L-Pro-L-Val), ciclo(L-Pro-L-Phe) y ciclo(LPro-L-Tyr) utilizando técnicas cromatográficas en columna, TLC y placa preparativa. Las estructuras de estos compuestos se lograron establecer por métodos espectroscópicos tales como RMN 1H, RMN 13C, COSY, HSQC y HR-MS.. 8.
(9) 2. A N T E C E D E N T E S La biotecnología se refiere a toda aplicación tecnológica que utilice sistemas biológicos y organismos vivos o sus derivados para la creación o modificación de productos o procesos para usos específicos. Las aplicaciones de la biotecnología son numerosas y entre las diferentes biotecnologías se encuentra la Biotecnología roja que se aplica a la utilización de biotecnología en procesos médicos. Algunos ejemplos son el diseño de organismos para producir antibióticos, el desarrollo de vacunas y nuevos fármacos, los diagnósticos moleculares, las terapias regenerativas y el desarrollo de la ingeniería genética para curar enfermedades a través de la terapia génica. 2.1 Metabolismo secundario: fuente de productos antibactericidas y antifúngicos Por definición, los metabolitos primarios son aquellos que se producen en la fase exponencial de crecimiento de un microorganismo y son necesarios para la sobrevivencia del microorganismo. Mientras que los metabolitos secundarios son moléculas sintetizadas por determinados microorganismos, que se producen en la fase estacionaria y aunque no son imprescindibles para el microorganismo, juegan papeles como la protección y supervivencia propia en el ambiente que lo rodea. Sus características son: No son necesarios para el crecimiento del microorganismo que los produce. En estado natural, sus funciones se hallan ordenadas a la supervivencia de la especie, pero cuando los microorganismos que los producen se desarrollan en cultivo puro, los metabolitos secundarios no desempeñan esa misión. Generalmente se producen como mezclas de productos muy relacionados químicamente entre sí. Cada uno de estos productos es producido por un grupo muy reducido de organismos. La producción puede perderse fácilmente por mutación espontánea (degeneración de la raza), por lo que son muy importantes las técnicas de conservación de estos microorganismos. 9.
(10) De todos los productos tradicionales obtenidos por fermentación, los más importantes para la salud humana son los metabolitos secundarios. Donde se incluyen, además de los antibióticos, ciertas toxinas, alcaloides, factores de crecimiento vegetal y pigmentos. Kossel en 1891, definió los metabolitos secundarios por exclusión, es decir aquellos que no pertenecían a los metabolitos primarios, provocando una fuerte crítica que aún hoy en día no cesa. Actualmente el concepto aceptado, es que los metabolitos primarios son compuestos químicos provenientes de organismos vivos (plantas, microorganismos o animales) que son vitales para su funcionamiento mientras que los secundarios son compuestos prescindibles. Estos metabolitos secundarios tienen gran diversidad estructural y cada uno de los compuestos es producido por un número pequeño de especies. 1 Por muchos años, el metabolismo secundario fue ignorado; el estudio de este tipo de metabolismo no esencial se dejó para los científicos de las industrias y los químicos académicos. Hoy en día la situación es diferente. La amplia variabilidad estructural de estos compuestos ha atraído la curiosidad de químicos y las actividades biológicas que poseen estos productos naturales han inspirado a la industria farmacéutica para buscar nuevas estructuras en cultivos microbianos así como en plantas. Muchos de los productos microbianos que tienen un gran valor comercial y económico son metabolitos secundarios. La exploración de la diversidad microbiana y la cantidad de metabolitos secundarios producidos por bacterias ha llevado a considerarlos como una fuente importante de productos naturales con propiedades biológicas como antibacterianos, antifúngicos, antitumorales, hipocolesterolémicos, inmunosupresores, antiparasitarios, herbicidas e insecticidas, entre otros. Los metabolitos secundarios son definidos como sustancias de bajo peso molecular, que no se producen en la vía metabólica primaria y que no juegan un papel fundamental en las funciones primarias o de crecimiento 2. A diferencia de los metabolitos primarios, los cuales son comunes en todos los sistemas biológicos, los 10.
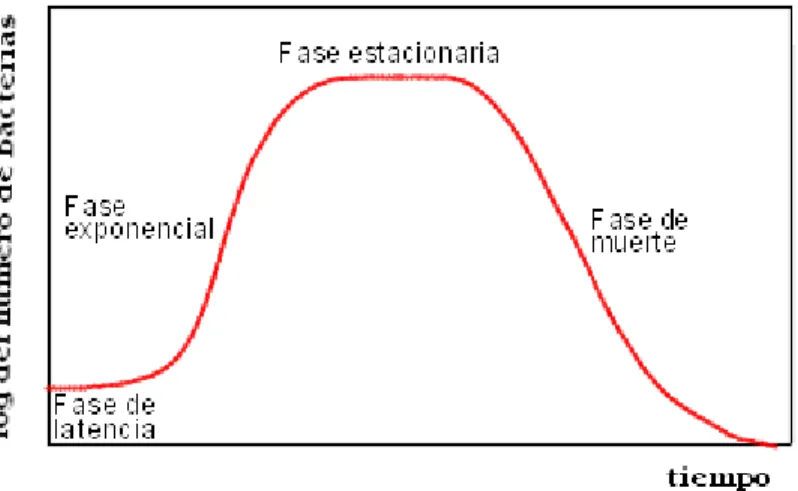
(11) metabolitos secundarios, son química y taxonómicamente diversos, presentando funciones desconocidas3. Los metabolitos secundarios son aquellos compuestos orgánicos sintetizados por el organismo que no tienen un rol directo en el crecimiento o reproducción del mismo y se producen en la fase estacionaria de crecimiento. A diferencia de lo que sucede con los metabolitos primarios, la ausencia de algún metabolito secundario no le impide la supervivencia y son producidos en la fase exponencial de crecimiento (Figura 1).. Figura 1: Curva de crecimiento bacteriano. Los metabolitos secundarios mejor conocidos son los antibióticos, se producen en la fase estacionaria. Para que se produzca el metabolito secundario, primero hay que asegurar unas condiciones óptimas durante la fase exponencial. Como mecanismo de defensa, la producción de metabolitos secundarios no se produce inmediatamente después de la conclusión de la fase exponencial. Primero, al comienzo de la fase estacionaria, deben hacerse resistentes a sus propios antibióticos. Se sabe que el paso de fase exponencial a fase estacionaria se produce cuando algún nutriente del medio es limitante. Suele tratarse de C, N o P. Al faltar algunos de estos factores, se altera la producción de metabolitos primarios y se originan inductores de enzimas que darán lugar a metabolitos secundarios. 11.
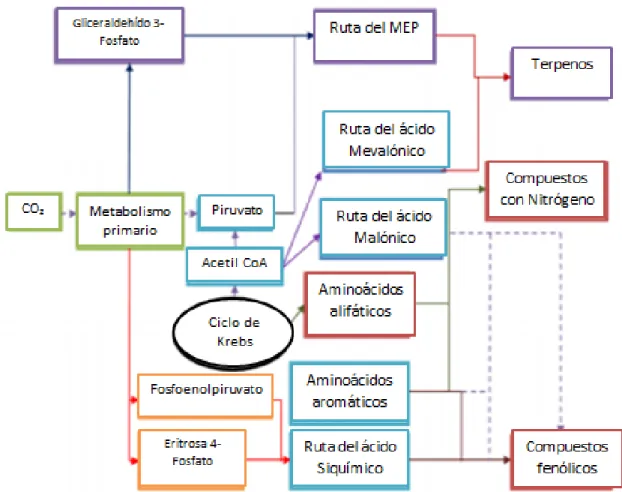
(12) En la siguiente figura 2 se muestra la interconexión existente entre el metabolismo primario y secundario, en este caso los metabolitos secundarios se dividen a grandes rasgos y considerando únicamente los grupos de mayor importancia en tres grupos: compuestos terpénicos, compuestos fenólicos y compuestos con nitrógeno.. Figura 2. Interconexión existente entre el metabolismo Primario y Secundario.. Las relaciones existentes entre estas rutas y los grupos de metabolitos secundarios son las siguientes: Los compuestos terpenoides se biosintetizan por las rutas MEP o MVA. Los compuestos fenólicos por la ruta del ácido siquímico. Los compuestos de nitrógeno fundamentalmente provienen de los aminoácidos aromáticos y/o alifáticos.. 12.
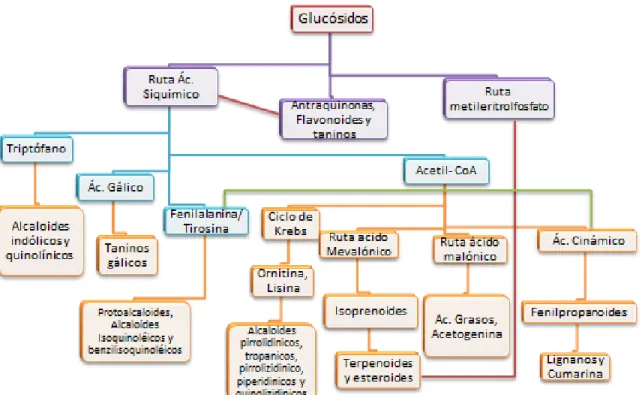
(13) En la figura 3 se muestra de manera más detallada los metabolitos secundarios y las rutas metabólicas que le dan origen. Sin embargo, en este caso ya se detallan algunos ejemplos de grupos de metabolitos:. Figura 3. Detalle de algunos metabolitos secundarios. Las especies de Bacillus son capaces de producir un amplio rango de metabolitos secundarios de naturaleza y estructura muy diferente mostrando un amplio espectro de actividades. Estos metabolitos incluyen antibióticos, pigmentos, toxinas, promotores de crecimiento y otros compuestos bioactivos y están diseñados para capacitar a la bacteria para sobrevivir en su ambiente natural.4 En general estos metabolitos sirven como: armas competitivas usadas contra otras bacterias, hongos, amebas, plantas e insectos, agentes transportadores de metales, efectores de simbiosis, hormonas sexuales y factores de diferenciación. 5 Esta amplia variabilidad de estructuras y actividades de los compuestos secundarios expande el potencial de la importancia industrial y biotecnológica del género Bacillus con sus especies relacionadas.6. 13.
(14) Bacillus thuringiensis es una bacteria privilegiada, ya que produce esporas como mecanismo de sobrevivencia, forma cristales proteínicos que tienen una importante función insecticida y además en sus fases de crecimiento cuenta con una fase estacionaria (en la que produce la espora y el cristal) en donde se produce el metabolismo secundario, como los metabolitos que se observan en la Figura 4. NH2. OH H2C O. N. N. O. N. N. HO. CH2. HOOC O. OPO3H2 COOH H2N. OH OH. O. O N H. OH. OH. H N O NH2. O. NH2. NH2. OH OH OH OH. OH. OH. Zwittermicina A -Exotoxina (Thuringiensina). O. O. H N. HO. OH. OH. O O O. HN O. O. O. NH. N H. O. OH O. HO. COOH O. O N H. OH. N H. OH. HN. Petrobactina. OH O. Bacillibactina. N. OH O. OH. N H. HO. OH H N O. NH O N H. Kurstakina O. H N. O. O O. HO. H N. OH. NH. OH. O. H N. N H. O. O O. O. O. HN N H. NH2 O. acido 3,4-dihidroxibenzoico (3,4-DHB) O. NH2. Figura 4: Metabolitos secundarios encontrados en B.thuringiensis.. 2.2 Bacillus thuringiensis como agente de control biológico Se estima que anualmente los insectos plaga ocasionan pérdidas del 20 al 30% de la producción total de algunos cultivos y para controlar este problema los métodos de control de plagas han sido dominados por el uso de insecticidas químicos sintéticos. Sin embargo, el uso indiscriminado de éstos ha seleccionado el desarrollo de altos niveles de resistencia en las plagas blanco, alta mortalidad en insectos benéficos y contaminación en 14.
(15) el medio ambiente. En un intento por disminuir estos problemas, los gobiernos, la industria y los científicos han tenido que desarrollar métodos de control de plagas más compatibles ambientalmente, que deben cumplir con ciertos requisitos como ser altamente tóxicos para el organismo blanco, tener la capacidad de ser producidos en masa a escala industrial y tener una vida media larga. Para el control de insectos y evitar la diseminación de enfermedades, se han usado los insecticidas orgánicos sintéticos como métodos químicos de combate de plagas. Sin embargo, las múltiples propiedades que hacen esos productos utilizables (larga acción residual y toxicidad para un amplio espectro de organismos) han provocado serios problemas ambientales, como la contaminación del ambiente, la pérdida de efectividad de los insecticidas y la reducción de la biodiversidad entre otros. Entre los agentes de control biológico destacan las bacterias entomopatógenas. En los últimos años se han desarrollado los bioinsecticidas basados en la bacteria Bacillus thuringiensis, cuya actividad insecticida se basa en la producción de cristales tóxicos para los insectos. 7,8 Bacillus thuringiensis fue aislado por primera vez por el bacteriólogo japonés Ishiwata en 1901, a partir de larvas del lepidóptero Bombyx mori. Fue descrita y nombrada por Berliner en 1911 quien aisló de larvas enfermas de Ephestia kuehniella, recogidas en Thüringen, Alemania.8 Bacillus thuringiensis es una bacteria Gram-positiva, aerobia estricta, que durante su ciclo de vida presenta dos fases principales: Crecimiento vegetativo, donde las bacterias se duplican por bipartición, y Esporulación, donde al terminarse los nutrientes del medio comienza a esporular como un mecanismo de sobrevivencia.8. 15.
(16) Figura 5: Microscopia de contraste de fase en donde se observan las esporas y cristales de B.thuringiensis. B. thuringiensis es una bacteria grampositiva, cuyo hábitat principal es el suelo, donde es considerado parte de la población bacteriana zimógena9, aunque también ha sido aislada de superficies de plantas, cadáveres de insectos y polvo de productos almacenados. Es una bacteria usada como el ingrediente activo para la agricultura en los insecticidas biológicos y para el control de vectores de enfermedades como son los mosquitos y moscas negras en el caso de la variedad israelensis. Su ciclo de vida es simple. Cuando los nutrientes y las condiciones ambientales son suficientes para crecer, las esporas germinan produciendo células vegetativas que crecen y se reproducen por fisión binaria. Las células continúan multiplicándose hasta que uno o más nutrientes, como los azúcares, aminoácidos u oxígeno se vuelven insuficientes para continuar su crecimiento vegetativo. Bajo esas condiciones, la bacteria esporula produciendo una endospora y un cuerpo parasporal o cuerpo de inclusión (cristal) en donde radica su actividad bioinsecticida. Estos cristales están constituidos de las denominadas -endotoxinas o proteínas Cry, que se liberan sólo bajo lisis celular y se encuentran codificadas en plásmidos extracromosomales que se pueden replicar independientemente. Se han encontrado -endotoxinas activas contra insectos lepidópteros (mariposas), coleópteros (escarabajos), dípteros (mosquitos), himenópteros (hormigas), ácaros y también contra otros invertebrados como nematodos, gusanos planos y protozoarios. 8. 16.
(17) 2.3 Melanina, un pigmento fotoprotector. Las melaninas son pigmentos hidrofóbicos negativamente cargados, de alto peso molecular que contienen compuestos fenólicos y/o indólicos polimerizados.10 Las melaninas son producidas por muchos organismos. Entre los biopolímeros, las melaninas son únicas en muchos aspectos. Algunos biopolímeros esenciales (proteínas, ácidos nucléicos y los hidratos de carbono) han sido químicamente bien caracterizados utilizando metodologías analíticas establecidas. Por el contrario, no hay métodos en la actualidad disponibles que permitan determinar de una manera precisa las características químicas de la melanina. 11 De hecho, estos pigmentos son insolubles en un amplio rango de solventes y pH, como también difíciles de purificar como resultado de su heterogeneidad estructural. La melanina de mamíferos existe en dos formas distintas: la eumelanina que va de color marrón a negra, y la feomelanina que va de amarillo a naranja (Figura 6). La melanina obtenida de la sepia (Sepia officinalis) contiene más de 98% de eumelanina y por tanto es usada como material estándar en el análisis de la melanina negra. Consecuentemente, la información que se tiene de las diferentes melaninas proviene de los análisis de sus productos de degradación y de los análisis espectroscópicos. Característicamente las melaninas son de color oscuro, insolubles en líquidos acuosos u orgánicos, resistente a ácidos concentrados y susceptible de blanquearse con agentes oxidantes.11 Las melaninas generadas a partir de 3,4-dihidrofenilalanina (L-DOPA) por las fenoloxidasas son referidas como eumelaninas, las cuales son negras o marrones. Las melaninas de color amarillo son feomelaninas e incorporan cisteína con L-DOPA. Las melaninas de color marrón derivadas del ácido homogenístico por la tirosinasa son llamadas piomelaninas. Las melaninas formadas del acetato son típicamente negras o marrones y son referidas como dihidroxinaftalen melaninas.. 17.
(18) OH. H N. O. OH N. S HO O. NH2 HO. O. O OH. S N. N O. OH. S. O. O HO. N H. HO. N H. O. O O H2N Feomelanina. O. OH. OH. OH O. N H. OH. OH Eumelanina CO2H. OH O N OH H 5,6-dihidroxiindol monomero de los polímeros de neuromelanina. O Benzoquinoacetato monomero de la piomelanina. Figura 6: Estructuras químicas de la A) feomelanina y la B) eumelanina. Las melaninas confieren resistencia a la luz UV ya que absorben un rango amplio del espectro electromagnético y previenen el daño fotoinducido. Consecuentemente las melaninas son comercialmente usadas en cremas fotoprotectoras y en gafas de sol. La melanina protege a varios organismos de la luz UV, solar o radiación gamma. Una producción incrementada de melanina está relacionada con una resistencia mayor del organismo a la radiación.11 El uso de B. thuringiensis como insecticidas está limitado tal y como ya se ha mencionado debido a que las esporas y toxinas son inactivadas por la radiación solar. Varias formulaciones se han mostrado inestables en condiciones de campo y rápidamente pierden sus actividades biológicas. Varios intentos para proteger a B. thuringiensis del daño por radiación UV bajo condiciones de campo han rendido limitado éxito. Se han desarrollado diferentes formulaciones con la adición de varios protectores químicos contra la luz UV; sin embargo, estos protectores químicos tienen un efecto negativo en el medio ambiente.. 18.
(19) Liu y colaboradores han reportado que la producción de melanina por varios microorganismos, los protege al daño oxidativo causado por la luz UV y por la radiación ionizante atrapando los radicales libres. Por lo cual, la melanina se ha clasificado como un agente fotoprotector natural lo que llevó a estos investigadores a proteger a Bacillus thuringiensis de la radiación UV con melanina producida por estreptomicetos. Esto eliminó el uso externo de agentes externos fotoprotectores no amigables con el medio ambiente y resultó en formulaciones de B. thuringiensis estables,12 demostrando que la melanina es un excelente agente fotoprotector. En cambio, Saxena y colaboradores obtuvieron mutantes que producen melanina de diferentes subespecies de B. thuringiensis pues ellos consiguieron las mutantes después de tratar a B. thuringiensis con rondas sucesivas de radiación UV. Aunque comparadas con sus cepas parentales, estas mutantes mostraron mayor resistencia a la luz UV, algunas de ellas perdieron genes que codifican para las toxinas Cry.13 Patel y colaboradores también consiguieron mutantes después de varias rondas sucesivas de tratar a B. thuringiensis con luz UV.14 Por otro lado Hoti y Balaraman han conseguido mutantes mediante mutagénesis química o agentes mutagénicos químicos, ya que ellos consiguieron aislar una mutante de B. thuringiensis productora de melanina después de mutagénesis química e incluso detectaron L-DOPA en el medio de cultivo indicando que la síntesis de la melanina era vía L-DOPA.15 Vilas-Boas y colaboradores, utilizaron etil metano sulfonato como agente químico mutagenizante para obtener la mutante productora de melanina.16 Nuestro grupo de investigación aisló una bacteria de Bacillus thuringiensis de un suelo de Mérida Yucatán que mostró una coloración marrón en placas de cultivo en crecimiento. Se pudo comprobar que esta cepa llamada ELI52 producía melanina, que es un agente fotoprotector10 lo cual fue corroborado por un IR comparado con la melanina estándar (Figura 7).17. 19.
(20) Figura 7: El espectro de IR del pigmento producido por la cepa de Bt ELI52 y la melanina estándar.. El interés en esta cepa llevó a realizar varios estudios de antagonismo contra varias bacterias dando una fuerte actividad antagónica e inhibitoria contra bacterias muy importantes a nivel hospitalario (Figura 8). Por ello se sospechó que esta cepa podía tener metabolitos secundarios con actividad biológica, por lo que se propuso extraer y purificar metabolitos secundarios de esta cepa e identificarlos por diferentes técnicas espectroscópicas. a. c. b. d. Figura 8. Ensayo de inhibición de extracto crudo ELI52 contra diferentes bacterias.. 20.
(21) 2.4 Dicetopiperazinas Las dicetopiperazinas son compuestos relativamente simples que se encuentran en la naturaleza.18 Son dipéptidos cíclicos obtenidos por condensación de dos. aminoácidos y. aislados de microorganismos, esponjas y de tejidos y fluidos corporales. Pueden incluso ser parte de otras estructuras más complejas en una variedad de microorganismos. Poseen diferentes actividades biológicas tal como, antitumoral, antifúngico y antibactericida, y además tienen la habilidad de unirse a una amplia variedad de receptores por lo que estas estructuras se vuelven atractivas para el descubrimiento de nuevos compuestos como agentes terapéuticos. Son pequeños bloques heterocíclicos conformacionalmente restringidos en los cuales la diversidad puede ser introducida hasta en seis posiciones, la estereoquímica puede ser controlada hasta en cuatro posiciones y son estables a la proteólisis.19 Son importantes en el descubrimiento de nuevos fármacos debido a que tiene una estructura rígida la cual imita la conformación preferencial de los péptidos y contiene aminoácidos restringidos embebidos dentro de la estructura sin tener las propiedades físicas no deseadas.20 Estos esqueletos moleculares teniendo diferentes grupos sustituyentes han vencido una de las limitaciones de los agentes medicinales convencionales que es la típica planalidad encontrada en ellos. Estas moléculas quiralmente enriquecidas son fácilmente sintetizadas a partir de. -aminoácidos. disponibles utilizando reacciones relativamente sencillas y han sido usados como núcleos para construir librerías en química combinacional. 21,22 Las dicetopiperazinas han sido aisladas individualmente o como mezclas de los sobrenadantes de cultivos de microorganismos diversos como son, P. aeruginosa, P. fluorescens, P. putida, P. alcaligenes, Proteus mirabilis, Enterrobacter agglomerans, Vibrio vulnificus, y Citrobacter freundii. El hecho de estar presentes en diversos organismos ha llevado a pensar que incluso están involucradas en señales de quorum sensing, que son señales que ocurren entre células en una ecología química y es la forma de comunicación (lenguaje químico) entre las células para saber qué ocurre afuera de ellas. 23,24. 21.
(22) 3. O B J E T I V O S 3.1 Objetivo general. Extracción, purificación y caracterización de metabolitos secundarios a partir de un cultivo bacteriano de Bacillus thuringiensis.. 3.2 Objetivos particulares. •. Obtener un extracto crudo del caldo de cultivo de B. thuringiensis.. •. Realizar pruebas de solubilidad al extracto crudo.. •. Purificar mediante cromatografía en columna los diferentes metabolitos secundarios.. •. Caracterizar mediante técnicas de espectroscopia cada uno de estos metabolitos secundarios.. •. Probar la actividad antibacteriana de los diferentes metabolitos secundarios contra bacterias muy importantes como lo son: Vibrio cholerae, Vibrio parahemolyticus, Shigella, Klebsiella pneumoniae y Listeria monocytogenes.. 22.
(23) 4. D I S C U S I Ó N D E R E S U L T A D O S. 4.1 Obtención del extracto crudo. Siguiendo la metodología descrita en la sección de materiales y métodos se ocupó como medio de cultivo estándar el TSB, el cual contiene un buen porcentaje de nutrientes esenciales para el microorganismo como lo son la peptona de caseína al 17%, peptona de soya al 3%, dextrosa al 2.5%, cloruro de sodio al 5% y fosfato dipotásico al 2.5%, los cuales le aportan una buena cantidad de nutrientes a la bacteria.. La incubación de la cepa ELI52 se llevó a cabo bajo condiciones de esterilidad, en dos matraces de 500 mL se agregaron 250 mL de medio de cultivo TSB (cada uno), para que la bacteria encuentre la aireación necesaria para su crecimiento en presencia de oxígeno, se mantuvieron en agitación a 175 rpm, por 7 días a 29°C. Transcurrido este tiempo, el caldo se centrifugó por 10 min a 6000 rpm, para que las células vegetativas se separaran del caldo de cultivo y éste estuviera libre de células. Cada 500 mL de caldo de cultivo libre de células se extrajeron en volúmenes de 3: 1 (disolvente: cultivo) con acetato de etilo, cloruro de metileno y acetona obteniendo los siguientes rendimientos de extracto:. Tabla 1. Rendimientos de extracción.. Extracción Acetato de etilo Cloruro de metileno Acetona. Rendimiento 100 mg/L 10 mg/L 50 mg/L. 23.
(24) En base a los resultados obtenidos en la tabla anterior, se observa que la extraccion con acetato de etilo da mejores rendimientos, por lo que se continuó con este disolvente para obtener más extracto crudo.. 4.2 Análisis de la solubilidad del extracto crudo El extracto crudo (Figura 9) tiene una consistencia viscosa, de color café obscuro y olor desagradable, al cual se le realizaron pruebas de solubilidad con diferentes disolventes (Tabla 2), demostrando que el extracto es de naturaleza polar. Este experimento se realizó en viales con 10 mg de extracto en cada uno y 2 mL de disolvente, agitando de vez en cuando y reposando por 8h.. Figura 9. Extracto crudo de ELI52. Tabla 2. Comportamiento de la solubilidad del extracto crudo. Disolvente Solubilidad Hexano Insoluble Benceno Insoluble Acetonitrilo Precipita polvo, poca solubilidad (turbidez) Dietil éter Poca solubilidad (turbidez) Cloroformo Poca solubilidad (turbidez) Acetato de etilo Mediana solubilidad (turbidez) Diclorometano Soluble Piridina Mayor solubilidad (turbidez) Acetona Precipita sólido, poca solubilidad (turbidez) Etanol Mayor solubilidad (turbidez) Metanol Soluble DMF Mayor solubilidad (turbidez) DMSO Soluble Agua Aglomerado, poca solubilidad (turbidez) 24.
(25) Posteriormente cada una de estas muestras fueron filtradas y eluidas con diversos sistemas en placas TLC para observar el contenido de bandas, y así observar si había algo de interés. Para esto se utilizaron sistemas desde Hexano: Acetato de etilo, hasta Diclorometano: metanol. Se observó que las muestras mayormente disueltas (en DMF, diclorometano, metanol, DMSO y piridina (carriles del 1 al 5) fueron las que mostraron mayor concentración y corrimiento en placa TLC desde un sistema diclorometano: acetato de etilo 8:2 (Figura 10a). Posteriormente, se utilizaron diversos sistemas más polares, encontrando el sistema óptimo de corrimiento el cual fue diclorometano: metanol 9:1, pues toda la muestra corría, y no se quedaba en el punto de aplicación (Figura 10b). En esta figura se observa que la muestra disuelta en diclorometano (carril 1) solubiliza toda la muestra y en placa tiene un comportamiento más diferenciable en cuanto al bandeo, pues las otras muestras quedaban de forma barrida en la placa en comparación con la muestra disuelta en diclorometano.. Figura 10. De izquierda a derecha: Punto 1. Diclorometano, punto 2. DMF, punto 3. Metanol, punto 4. DMSO, punto 5. Piridina. a) diclorometano: acetato de etilo 8:2. b) diclorometano: metanol 9:1. Como se puede observar en la figura 10, hay una gran complejidad del extracto crudo, por ello se le realizaron espectros de RMN de 1H (Figura 11) y RMN de 13C (Figura 12).. 25.
(26) 1. Figura 11. RMN H de extracto crudo de la cepa ELI52 a 500 MHz. 13. Figura 12. RMN C de extracto crudo de la cepa ELI52 a 125 MHz. 26.
(27) En estos espectros se puede observar la gran complejidad del extracto crudo tal y como se preveía del corrimiento en TLC. Esto representaba un reto para la purificación, debido a esto, se comenzó con una placa preparativa de (20 cm X 13 cm) la cual se corrió en Diclorometano: metanol 9:1, posteriormente al revelarla, se observó que no se había separado de la misma manera que en TLC, por ello se corrió una segunda vez con diclorometano: metanol 9:1 (Figura 13).. Figura 13. Extracto crudo en placa preparativa. Esta placa se reveló en longitud de onda larga (365 nm) y corta (254 nm), en la corta se observó barrida por lo tanto fue difícil separar las bandas, mientras que en la longitud larga se pudo apreciar que ciertas bandas presentaban fluorescencia de color azul, verde y naranja, por lo tanto, cada una de estas bandas se mantuvo por una noche en diclorometano, posteriormente fueron filtradas y evaporadas para su análisis por RMN, dando resultados poco interesantes para RMN. Debido a estos resultados, se pensó que la concentración era muy pequeña, que no había una buena separación y además que había pérdida de extracto crudo, por lo que realizó una columna cromatográfica de gel de sílice en donde se utilizaron diversos sistemas como eluyentes (tabla 3).. 27.
(28) Tabla 3. Análisis del extracto crudo por columna cromatográfica. 1 2 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40. Cantidad 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml 100 ml. Solvente Hexano Hexano: acetato de etilo Hexano: acetato de etilo Hexano: acetato de etilo Hexano: acetato de etilo Hexano: acetato de etilo Acetato de etilo Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Acetato de etilo: diclorometano Diclorometano Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetato de etilo: acetona Acetona Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol Acetona: metanol. Polaridad 95:5 75:25 50:50 30:70 20:80 95:5 90:10 80:20 70:30 60:40 50:50 40:60 30:70 20:80 10:90 95:5 90:10 80:20 70:30 60:40 1:1 40:60 30:70 20:80 10:90 95:5 90:10 80:20 70:30 60:40 1:1 40:60 30:70 20:80 10:90. 28.
(29) Para poder discernir que sistemas podían tener compuestos interesantes y por lo tanto, por donde se debía de comenzar, como una prueba de exclusión se utilizaron las pruebas biológicas contra bacterias (antibiogramas) como Micrococcus luteus, staphylococcus aureus, staphylococcus saprophyticus, Bacillus cereus entre otros, observándose que las fracciones que bajaban con los sistemas de acetato de etilo: acetona mostraban inhibición, aunque menor que el efecto del extracto crudo (Figura 14).. Ac/Ac. Figura 14. Prueba de antibiograma del extracto crudo purificado con acetato de etilo: acetona.. Posteriormente se realizó otra columna cromatográfica en donde los sistemas eluyentes utilizados fueron los siguientes:. Tabla 4. Columna con acetato: acetona como eluyentes. 1 2 3 4 5 6. Cantidad 300 mL 200 mL 100 mL 200 mL 100 mL 100 mL. Solvente Polaridad Hexano Acetato de etilo Acetato de etilo: acetona 95:5 Acetato de etilo: acetona 90:10 Acetato de etilo: acetona 85:15 Acetato de etilo: acetona 80:20. De esta columna se analizó tubo a tubo el bandeo por TLC, obteniendo los siguientes productos:. 29.
(30) 4.3 Elucidación. del. Ciclo. (L-Pro-L-Leu). (3S,8aS)-hexahidro-3-. isobutilpirrolo[1,2-a]pirazin-1,4-diona. O Extracto crudo. Purificación por columna AcOEt:Acetona, 95:5. N HN O. H. 1 Esquema 1. Obtención del producto 1. El compuesto 1 se obtuvo a partir de la elución de la columna cromatográfica con 100 mL de acetato de etilo: acetona 95:5, se observó una banda con un factor de retención (Rf) = 0.40 y una más por encima de ella aunque muy tenue, por lo que, al observar la pureza, se realizó una RMN de 1H y 13C. El análisis del espectro de RMN de 1H para el compuesto 1 fue el siguiente: El primer hidrógeno que se asignó fue el de la amina, que por efecto de electronegatividad se desplaza a campo bajo, por esta razón, se integró para un hidrógeno, además, es una señal ancha y simple (características principales de grupos NH y OH) lo que demuestra que no está acoplándose con ningún hidrógeno. Otras dos señales muy bien definidas son los dos dobles que se encuentran en 1.0 ppm, que muestran multiplicidad doble lo cual indica que se está acoplando con otro hidrógeno próximo, además integran para 3H permitiendo corroborar que son los hidrógenos de dos metilos de un isopropilo. En el espectro de RMN de 13C se pudieron observar la presencia de 11 carbonos, dos de ellos con un desplazamiento de 170 y 166 ppm, lo cual sugiere la presencia de dos carbonilos. Posteriormente se obtuvieron los espectros de 2D COSY y HSQC, así como el DEPT. Se le realizó espectrometría de masas de alta resolución por FAB y con todos estos datos se realizó un análisis para la elucidación estructural del compuesto 1. Del análisis de la espectrometría de masas de alta resolución por FAB se pudo observar una m/z de 211.1444 encontrada para una fórmula molecular de [C11H18N2O2+H]+, en la cual primeramente se determinó el número de insaturaciones con la siguiente fórmula: 30.
(31) (n° C * 2 + 2) - n° H U=. 2. En donde: U= número de insaturaciones n° C = número de Carbonos n° H = número de Hidrógenos. Y teniendo en cuenta que por cada Nitrógeno se aumenta 1C y 1H, la fórmula sustituida queda de la siguiente manera: (13* 2 + 2) - 20 U=. 2. U= 4. El análisis del espectro de RMN de 1H para el compuesto 1 fue el siguiente (Figura 15):. 31.
(32) 32. 12. 13. 11. 9. 8. HN. 10. O. 7. 1. O. 3. H. 6 5. N. 2 4. 1. Figura 15. Espectro de RMN de H de 500 MHz del compuesto 1.
(33) Se observa en 4.13 ppm una señal doble de dobles que integra para un hidrógeno y se asignó como H-6. En 4.01 ppm se observa una señal doble de dobles que integra para un hidrógeno y se asignó como H-9. Ambos están acoplándose con los dos hidrógenos diasterotópicos adyacentes. Esto genera controversia y una dificultad para la correcta asignación, por ello, se utilizó un espectro 2D de RMN COSY (figura 16), el cual permitió hacer una correcta asignación, donde se observó que la señal doble de dobles en 4.13 ppm se acopla con los hidrógenos H- 5a y H- 5b y que la señal doble de dobles en 4.01 ppm se acopla con los hidrógenos H-10a y H-10b.. O 12. 11. 10 9. 13. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 16. Espectro 2D de RMN COSY de 500 MHz del compuesto 1. También se observa la señal simple en 5.80 ppm asignado al H-8 del grupo amino el cual no se está acoplando con otro hidrógeno, posteriormente se asigna como H-11 a la señal múltiple en 1.73 ppm que se está acoplando con ambos metilos H-12 y H-13, los cuales son señales dobles en 1.0 ppm y en 0.95 ppm respectivamente. Se observa que 33.
(34) este H-11 en 1.73 ppm se acopla con un hidrógeno más, el cual es el H-10 en 2.07 ppm, pero de éste se espera un acoplamiento geminal que también puede observarse, asignando así a la señal múltiple H-10a en 1.55 ppm y a la señal múltiple H-10b en 2.07 ppm, se observa que ambos hidrógenos se acoplan con la señal doble de dobles en 4.01 ppm asignando inequívocamente al H-9. Se observa que el H-6 en 4.13 ppm se acopla con dos hidrógenos los cuales muestran acoplamiento entre ellos mismos, lo que permite asignar al H-5a como un múltiple en 2.35 ppm y al H-5b como un múltiple en 2.12 ppm por su acoplamiento geminal, por último, se asignó al H-3 como una señal múltiple en 3.54 ppm acoplado con el H- 4b como una señal múltiple en 2.05 ppm y con el H- 4a como una señal múltiple en 1.91 ppm, los cuales al pertenecer a un ciclo y al no ser una molécula plana, muestran desplazamientos diferentes, además el H-3 en 3.54 ppm al estar unido a un átomo de nitrógeno le jala densidad electrónica y por ello es que está más desplazado. Para una correcta asignación del espectro de RMN de 13C se utilizó un espectro 2D de RMN HSQC para la asignación de carbono (figura 17):. O 12. 11. 10 9. 13. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 17. Espectro 2D de RMN HSQC de 500 MHz del compuesto 1. 34.
(35) Debido a este espectro, se pudo asignar cada hidrógeno con su respectivo carbono, y como se muestra señalado en rojo en el espectro, se observa que el átomo de carbono 4 en 22.7 ppm corresponde a los 2 hidrógenos H-4a y H-5b, el átomo de carbono 5 en 28.1 ppm corresponde a los hidrógenos geminales H-5a y H-5b, y que el átomo de carbono 10 en 38.6 ppm corresponde al H-10a y el H-10b, corroborando así, la asignación correcta de cada uno. Con estos datos se pudo asignar correctamente el espectro de RMN de 13C (figura 18):. O 12. 11. 10 9. 13. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. 13. Figura 18. Espectro de RMN de C a 125 MHz del compuesto 1. En 166.1 ppm y 170.1 ppm se pueden apreciar los carbonos C-1 y C-7 respectivamente, los cuales son los carbonilos de la molécula, en 59.0 ppm se encuentra el C-6 el cual es un CH, en 53.3 ppm el C-9 el cual es un CH, en 45.5 ppm el C-3 el cual es un CH2, en 38.6 ppm el C-10 el cual es un CH2, en 28.1 ppm el C-5 el cual es un CH2, en 35.
(36) 24.7 ppm el C-11 el cual es un CH, en 23.2 el C-12 el cual es un CH3, en 22.7 ppm el C-4 el cual es un CH2 y en 21.2 ppm el C-13 el cual es un CH3. Posteriormente para observar el tipo de carbono se realizó un espectro de RMN DEPT 135 (figura 19):. O 12. 11. 10 9. 13. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 19. Espectro de RMN DEPT- 135. En este espectro se pueden observar las señales negativas para CH2 y positivas para CH y CH3, lo que corrobora que la asignación de carbono e hidrógeno es correcta. El compuesto 1 tenía un aspecto cristalino por lo que, se buscaron sistemas adecuados para cristalizar este compuesto y esto fue posible mediante una mezcla de diclorometano: hexano con lenta evaporación, se obtuvo un pequeño cristal. Su difracción de rayos X (figura 20) corroboró la estructura propuesta para esta molécula e indicó la. 36.
(37) configuración absoluta de los centros estereogénicos, observando que son (6S, 9S). Se determinó que el compuesto 1 es el compuesto L-Prolina-L-Leucina. O. (s). N (s). HN O. ciclo(L-Pro-L-Leu). Figura 20. Difracción de rayos X del compuesto 1. 4.4 Elucidación. del. Ciclo. (L-Pro-L-Val). (3S,8aS)-hexahidro-3-. isopropilpirrolo[1,2-a]pirazin-1,4-diona.. Extracto crudo. O. Purificación por columna AcOEt:Acetona, 90:10. N HN O 2. Esquema 2. Obtención del producto 2. El compuesto 2 se obtuvo a partir de la elución de la columna cromatográfica con 200 mL de acetato de etilo: acetona 90:10, se observó una banda azul intensa con un factor de retención (Rf) = 0.45, por lo que, al observar la pureza, se le realizó de una manera muy similar al anterior compuesto una RMN de 1H y 13C. Basándose en el compuesto 1, el análisis fue similar en este segundo compuesto; el primer hidrógeno que se asignó fue el de la amina, que por efecto de electronegatividad 37.
(38) se desplaza a campo bajo, por esta razón, se integró para 1H. El número de carbonos fue de diez y las señales que se observaban en ambos espectros eran muy similares al compuesto 1. Por lo que la elucidación estructural se procedió de la misma manera. Se obtuvo la espectrometría de masas de alta resolución por FAB observándose una m/z de 197.1284 encontrada para una fórmula molecular de [C10H16N2O2+H]+, en la cual primeramente se determinó el número de insaturaciones con la siguiente fórmula: (n° C * 2 + 2) - n° H U=. 2 (12* 2 + 2) - 18. U=. 2. U= 4 Posteriormente mediante la espectrometría de masas por impacto electrónico, se obtuvo el siguiente espectro (figura 21): Pico base. Ion molecular. Figura 21. Espectro de masas por impacto electrónico del compuesto 2. 38.
(39) Por lo que se propone la siguiente fragmentación (Esquema 3):. O. 196. O. N HN. O. N -43. O. 153. HN. HN. 74 NH2. N -28. O. O. 128. -57. NH2. O. Esquema 3. Fragmentación por impacto electrónico del compuesto 2. De esta manera la comparación de los picos más representativos es la siguiente: Tabla 5. Comparación de los picos calculados y propuestos. Picos calculados Picos propuestos 196 196 Ion molecular 154 153 pico base 125 128 70 74. El análisis del espectro de RMN de 1H para el compuesto 2 fue el siguiente:. 39.
(40) 40. 12. 9. 8. HN. 10. 11. O. 7. 1. O. 3. H. 6 5. N. 2. 4. 1. Figura 21. Espectro de RMN de H de 500MHz del compuesto 2.
(41) En este espectro se observan las dos señales dobles que integran para tres hidrógenos, se encuentran en 1.0 ppm y en 0.90 ppm y se acoplan con la señal doble de séptuples en 2.69 ppm, la cual integra para un hidrógeno, razón por la que muestran esta multiplicidad, esto permite asignar inequívocamente a los hidrógenos 11 (en 1.0 ppm), 12 (en 0.90 ppm) y 10 (en 2.69ppm). También se observa en 3.94 ppm una señal doble de dobles y 4.09 ppm una señal doble, ambas integran para un hidrógeno, estos son hidrógenos de los dos centros estereogénicos además están acoplándose con los 2 hidrógenos adyacentes que son diasterotópicos el H-5 y el H-10, en comparación con el compuesto 1 (figura 22a) se observa una diferencia en el hidrógeno 9 respecto al compuesto 2 (figura 22b):. O 12. 11. 9 13. 11. 10. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. a). b). O. 10 12. 9. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 22. Comparación del H-9 del compuesto 1 (a) y compuesto 2 (b). Esta comparación, permitió diferenciar que se trataba de dos compuestos diferentes a pesar de la similitud de ambos espectros, el hidrógeno 9 del compuesto 2 muestra una señal doble en 3.94 ppm que indica que se está acoplando a un hidrógeno, mientras que el hidrógeno 9 del compuesto 1 es una señal doble de dobles que indica que se acopla a dos hidrógenos diasterotópicos. Posteriormente siguiendo la misma metodología de elucidación; se continuó con un espectro 2D de RMN COSY para observar los acoplamientos entre cada hidrógeno (figura 23):. 41.
(42) 11. O. 10 12. 9. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 23. Espectro 2D de RMN COSY del compuesto 2. En este espectro se asigna como H-10 a la señal múltiple en 2.69 ppm que se está acoplando con ambos hidrógenos con señales dobles H-11 en 1.0 ppm y H-12 en 0.90 ppm, posteriormente se observa que este H-10 se acopla con un hidrógeno más, el cual es el H-9 como una señal doble en 3.94 ppm, posteriormente se observa una señal doble en 4.09 ppm que es el H-6 el cual se acopla con dos hidrógenos los cuales muestran acoplamiento entre ellos mismos, lo que permite asignar al H-5a como una señal múltiple en 2.41 ppm y al H-5b como señal múltiple en 2.01 ppm por su acoplamiento geminal, por último, se asignó al H- 4b en 1.88 ppm como señal múltiple y el H- 4a en 1.94 ppm como señal múltiple y al H- 3b en 3.66 ppm y el H- 3a en 3.53 ppm, los cuales al pertenecer a un ciclo y al no ser una molécula plana, muestran desplazamientos diferentes. Posteriormente se realizó un espectro 2D de RMN HSQC para la asignación correcta de carbono (figura 24):. 42.
(43) 11. O. 10 12. 9. HN. 1. N. 2. 7. 8. O. 3. 6 5. 4. H. Figura 24. Espectro 2D de RMN HSQC del compuesto 2. Con este espectro, se pudo asignar cada hidrógeno con su respectivo carbono, y como se muestra señalado en rojo en el espectro, se observan los hidrógenos geminales H-5a y H-5b, correspondientes al carbono 5 en 28.5 ppm y se observan los hidrógenos H4a y 4b y H-3a y 3b, acoplándose con su carbono correspondiente C-4 en 22.4 ppm y C-3 en 45.1 ppm. Con estos datos se pudo asignar correctamente el espectro de RMN de asignado (figura 25):. 13. C. 43.
(44) 11. O. 10 12. 9. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 25. Espectro de RMN de 13C a 125 MHz del compuesto 2. Este espectro, el cual se resolvió con el HSQC, muestra la diferencia con el compuesto 1, el cual tiene un carbono de más en 24.7 ppm. De esta manera se corroboró que se trataba de 2 compuestos diferentes. Posteriormente para corroborar el tipo de carbono se realizó un espectro de RMN DEPT -135 (figura 26):. 44.
(45) 11. O. 10 12. 9. HN. 1 7. 8. O. N. 2. 3. 6 5. 4. H. Figura 26. Espectro de RMN DEPT- 135 del compuesto 2. En este espectro se pueden observar las señales negativas para CH2 y positivas para CH y CH3, así se corrobora que la asignación de carbono e hidrógeno es la correcta.. 4.5 Elucidación. del. Ciclo. (L-Pro-L-Phe). (3S,8aS)-3-benzil-. hexahidropirrolo[1,2-a]pirazin-1,4-diona. O Extracto crudo. Purificación por columna. N HN. AcOEt:Acetona, 90:10 O 3 Esquema 4. Obtención del producto 3. 45.
(46) El compuesto 3 se obtuvo a partir de la elución de la columna cromatográfica con 200 mL de acetato de etilo: acetona 90:10, se observó una única banda con un factor de retención (Rf) = 0.60, por lo que al observar la pureza, se procedió al mismo análisis que para los compuestos anteriores. Se obtuvo el espectro de RMN 1H en donde destacaba en 7.2 ppm un múltiple característico de un grupo fenilo y la mayor parte de señales similares a los espectros anteriores. En el espectro de RMN 13C se observaban doce señales de las cuales dos eran intensas (en la región de los compuestos aromáticos). De forma similar se procedió a la elucidación estructural del compuesto 3. Se le realizó espectrometría de masas de alta resolución por impacto electrónico observándose una m/z de 244.1177 encontrada para una fórmula molecular de [C14H16N2O2]+, en la cual primeramente se determinó el número de insaturaciones con la siguiente fórmula: (n° C * 2 + 2) - n° H U=. 2. (16* 2 + 2) - 18 U=. 2. U= 8. Posteriormente mediante la espectrometría de masas por impacto electrónico, se obtuvo el siguiente espectro (figura 27):. 46.
(47) Pico padre Ion tropilio. Ion molecular. Figura 27. Espectro de masas por impacto electrónico. Por lo que se propone la siguiente fragmentación (Esquema 5):. M. 244. O. 154. O N -90. O. HN. -44 O. 28 O. NH. N. HN. 110. O. -82. HN O. -154. 91. Esquema 5. Fragmentación por impacto electrónico del compuesto 3. De esta manera la comparación de los picos más representativos es la siguiente:. 47.
(48) Tabla 6. Comparación de los picos calculados y propuestos. Picos calculados Picos propuestos 244.213. Ion molecular. 154.118. 154. 107.083. 110. 91.087. Ion tropilio. 28.033. Pico padre. El análisis del espectro de RMN de 1H para el compuesto 3 fue el siguiente (Figura 28):. Como característica principal se observa en 7.2 ppm un grupo de señales que se caracterizan por pertenecer a grupos fenilo, los cuales al integrar corroboran los cinco hidrógenos, los cuales indican una sustitución ipso en el anillo, la primera integración para un hidrógeno, fue el de la amina, que por antecedentes en los productos obtenidos, es un hidrógeno similar, posteriormente se observan dos grupos de señales doble de dobles, en donde se observa una inversión del desplazamiento entre el H-6 y el H-9 con respecto a las moléculas anteriores (figura 29):. Figura 29. Comparación de los compuestos. (a) Compuesto 3 y (b) Compuesto 1. Esta inversión surge debido a que el compuesto 3 ahora tiene como sustituyente un grupo fenilo y por ello se observa una desprotección electrónica en el H-9 desplazado a 4.28 ppm, con diferencia al H-9 del compuesto 1 desplazado en 4.01 ppm. En el espectro de RMN de 1H también se puede observar una señal bien definida en 2.77 ppm un doble de dobles, en el cual se asignó al H-10, el cual se trata de un hidrógeno diasterotópico, que se acopla con el hidrógeno del carbono estereogénico H-9. Todos los 48.
(49) demás hidrógenos se encuentran como señales múltiples las cuales se resolvieron mediante un espectro 2D de RMN COSY (figura 30):. Figura 30. Espectro 2D de RMN COSY del compuesto 3. En este espectro se observa el acoplamiento del H-6 en 4.08 ppm con ambos hidrógenos diasterotópicos del anillo de la prolina H-5a y 5b (señales múltiples en 2.34 ppm y 2.03 ppm respectivamente), también se observa el acoplamiento geminal de ambos, se observan dos acoplamientos más, que se asignan como H-3 en 3.60 ppm acoplado con el H-4 en 1.90 ppm, que pertenecen a los hidrógenos del ciclo-prolina y debido a esto, se diferencian entre ellos. Por último, se observa el acoplamiento del hidrógeno H-9 en 4.28 ppm con el hidrógeno H-10b (señal doble de dobles) en 2.77 ppm, y con una señal múltiple, que por deducción se asignó como H-10a en 3.64 ppm, de igual manera se observa el acoplamiento geminal de ambos.. Posteriormente se realizó un espectro HSQC en el que se determinó la correlación de los hidrógenos con sus respectivos carbonos (figura 31):. Figura 32. Espectro 2D de RMN HSQC del compuesto 3. Lo más destacable de este espectro, además de la asignación de todos los carbonos, es que se observa encerrado en los cuadros en rojo que los hidrógenos geminales H-5a y 5b y los hidrógenos geminales H-10a y 10b están correctamente asignados en el espectro de hidrógeno, ya que correlacionan para el mismo carbono cada uno de ellos, y se observa que los hidrógenos H-3a y 3b y H-4a y 4b tienen un ligero desplazamiento entre ellos, cada uno correlaciona con su propio carbono, además el H-3 se asigna en 3.6 ppm y al H-4 en 1.9 ppm debido a que el hidrógeno H-3 está directamente unido a un átomo de nitrógeno, el cual está jalando densidad electrónica en este hidrógeno adyacente. 49.
(50) Con estos datos se pudo asignar correctamente el espectro de RMN 13C (figura 33):. 13. Figura 33. Espectro de RMN de C a 125 MHz del compuesto 3. En este espectro se observan los carbonilos C-7 y C-1 desplazados en 169.3 ppm y 165.0 ppm como los compuestos anteriores, y de manera destacable se observan los carbonos del fenilo, C-3´,5´ en 129.3 ppm, los carbonos C- 2´,6´ en 129.0 ppm y el carbono C-1´ en 135.8 ppm, los demás carbonos de la molécula permanecen con el mismo desplazamiento que los compuestos anteriores.. Por último, para corroborar el tipo de carbono se realizó un espectro de RMN DEPT (figura 34):. Figura 34. Espectro de RMN DEPT- 135 del compuesto 3. En este espectro se confirmó la asignación correcta de los carbonos orto, meta y para son CH, igual que los carbonos C-6 y C-9, los carbonos negativos definidos como CH2, corroboran la asignación correcta de los carbonos C-3, C-10, C-5 y C-4.. 4.6 Elucidación del Ciclo (L-Pro-L-Tyr) (3S,8aS)-3-(4-hidroxibenzil)hexahidropirrolo[1,2-a]pirazin-1,4-diona.. O Extracto crudo. Purificación por columna AcOEt:Acetona, 85:15 HO. N HN O 4. Esquema 6. Obtención del producto 4. 50.
(51) El compuesto 4 se obtuvo a partir de la elución de la columna cromatográfica con 100 mL de acetato de etilo: acetona 85:15, se observó una única banda con un factor de retención (Rf) = 0.65, se procedió al mismo análisis que para los compuestos anteriores. Se obtuvo el espectro de RMN 1H en donde destacaba en aproximadamente 7.0 ppm un par de señales dobles, sistema característico de un grupo fenilo sustituido en para y la mayor parte de señales similares a los espectros anteriores. En el espectro de RMN 13C se observaban 12 señales de las cuales dos eran intensas (en la región de aromáticos). De forma similar se procedió a la elucidación estructural del compuesto 4.. Se le realizó espectrometría de masas de alta resolución por impacto electrónico observándose una m/z de 260.1161 encontrada para una fórmula molecular de [C14H16N2O3], en la cual primeramente se determinó el número de insaturaciones con la siguiente fórmula: (n° C * 2 + 2) - n° H U=. 2. (16* 2 + 2) - 18 U=. 2. U= 8. Posteriormente mediante la espectrometría de masas por impacto electrónico, se obtuvo el siguiente espectro (figura 35):. Figura 35. Espectro de masas por impacto electrónico del compuesto 4. Por lo que se propone la siguiente fragmentación (Esquema 7):. 51.
(52) 260. O. O N. HO. 152. 243. O. N. N. HN. HN. -17 O. - 91. HN O. O. 124. O N HN. HN. 69. O. NH - 15. O. 109. O. - 28. NH2 - 40. NH2. O. Esquema 7. Fragmentación por impacto electrónico del compuesto 4. De esta manera la comparación de los picos más representativos es la siguiente: Tabla 7. Comparación de los picos calculados y propuestos. Picos calculados Picos propuestos 260 260 Ion molecular 244 243 154 152 pico padre 125 124 107 109 70 69 El análisis del espectro de RMN de 1H para el compuesto 4 fue el siguiente:. En el espectro se observa un par de señales dobles en 7.0 ppm sistema característico de un grupo fenilo sustituido en para y cada señal doble integra para 2H, posteriormente se asignó al H-8 que corresponde a la amina secundaria en 5.7 ppm debido a la similitud de los compuestos anteriores; principalmente del compuesto 3 (LPro- L-Phe), en el cual se puede apreciar que el espectro es muy similar en cada señal, excepto en aproximadamente 3.6 ppm (figura 37):. 52.
(53) 1. Figura 37. Ampliación en 3.6 ppm de los espectros de RMN H de a) 3 (L-Pro-L-Phe) y de b) 4 (L-Pro-L-Tyr). Como se puede observar el compuesto 3 tiene una integración de 3H, los cuales corresponden a un hidrógeno geminal 10a y a los hidrógenos 3a y 3b, mientras que en el compuesto 4 se observa la integral para 4H, dos de ellos corresponden a los hidrógenos 3a y 3b en 3.60 ppm y uno al hidrógeno geminal 10a en 3.48 ppm (asignados correctamente en espectro COSY), observando que 1 hidrógeno sobra en esta integración, lo que indica que probablemente aquí se encuentra el hidrógeno 7’ del grupo OH. Para resolver los acoplamientos de cada hidrógeno de la molécula, se realizó un espectro COSY (figura 38):. 53.
(54) Figura 38. Espectro 2D de RMN COSY del compuesto 4. En este espectro se observa el acoplamiento del H-6 (señal doble de dobles en 4.10 ppm) con ambos hidrógenos diasterotópicos del anillo de la prolina H-5a (señal múltiple en 2.34 ppm) y 5b (señal múltiple en 1.96 ppm), también se observa el acoplamiento geminal de ambos, se observan dos acoplamientos más, que se asignan como H-3 (señales múltiples en 3.60 ppm) acoplado con el H-4 (señales múltiples en 2.0 ppm), ambos son hidrógenos del ciclo-prolina y se diferencian entre ellos como H-3a, H-3b y H-4a y H-4b. Se observa el acoplamiento del hidrógeno H-9 (señal doble de dobles en 4.23 ppm) con el hidrógeno H-10b (señal doble de dobles en 2.74 ppm), y con H-10a (señal doble de dobles en 3.48 ppm), de igual manera se observa el acoplamiento geminal de ambos. Finalmente como lo más importante en este compuesto, se observa que el hidrógeno 7’ del grupo OH se acopla con los hidrógenos H3´-H5´.. 54.
(55) Posteriormente se realizó un espectro HSQC en el que se determinó la correlación de los hidrógenos con sus respectivos carbonos (figura 39):. Figura 39. Espectro 2D de RMN HSQC del compuesto 4. Como se observa encerrado en los cuadros punteados en azul, los hidrógenos geminales H-5a y 5b y los hidrógenos geminales H-10a y 10b están correctamente asignados en el espectro de hidrógeno, pues correlacionan para el mismo átomo de carbono C-5 en 28.4 ppm y C-10 en 35.9 ppm, y se observa que los hidrógenos H-3a y 3b correlaciona con el C-3 en 45.3 ppm y H-4a y 4b correlacionan con el C-4 en 22.5 ppm. Con estos datos se pudo asignar correctamente el espectro de RMN 13C (figura 40):. 55.
(56) 13. Figura 40. Espectro de RMN de C a 125 MHz del compuesto 4. En este espectro se pueden observar doce carbonos de la molécula, pero para poder elucidar a los carbonos cuaternarios, se muestra una comparación con el compuesto 3 (figura 41):. 56.
(57) Figura 41. Comparación de los compuestos 4 con 3. Esta comparación resultó muy útil para observar el comportamiento de los carbonos del compuesto 4 con un grupo hidroxi sustituido en posición para en el grupo fenilo, como se puede observar, los carbonilos se encuentran desplazados de manera similar en cada compuesto, en cambio, se puede observar que el C1’ se desplaza a campo bajo, debido a que el grupo OH mete densidad al anillo.. Por último, para observar los tipos de carbonos de la molécula se realizó un espectro de RMN DEPT (figura 42):. 57.
(58) Figura 42. Espectro de RMN DEPT- 135 del compuesto 4. El compuesto 4 no tiene ningún CH3 por ello es que se diferencian los CH2 hacia abajo y los CH hacia arriba, lo que indica la correcta asignación de cada átomo de carbono.. Este compuesto 4 identificado como L-Pro- L-Tyr; tiene un estado físico sólido en forma de polvo. Sin embargo, este compuesto se logró identificar en otra columna cromatográfica, eluída con 100 mL de acetato de etilo: acetona 80:20 con un Rf= 0.65, como un cristal blanco, el cual al principio se trató como si fuera otro compuesto diferente del 4, el cual se denominó como compuesto 5. Se le realizaron todas las espectroscopías que para los compuestos anteriores. La espectrometría de masas de alta resolución por impacto electrónico señaló una masa de 260.1165 con una fórmula molecular C14 H16N2O3, con ocho insaturaciones, la cual era idéntica al compuesto 4.. 58.
(59) El espectro de RMN de 1H también resultó igual al compuesto 4, excepto por una señal ancha en 6.15 ppm que correspondía al grupo OH del compuesto, señal que no estaba en el espectro de RMN de 1H del compuesto 4.. La otra diferencia radica en la integración en 3.60 ppm que en el compuesto 4 es de cuatro hidrógenos y para éste compuesto, en la misma región, es de tres hidrógenos, como era lógico de prever (figura 44):. Figura 44. Comparación de los compuestos 5 con 4. Estos datos indican que ambos compuestos son lo mismo, se trata de la misma estructura pero con formas de cristalización diferente, lo cual explica porque uno es polvo y el otro es cristal. Un mismo compuesto puede cristalizar con más de una estructura. Se trata de la misma molécula pero se apila en el espacio de varias formas distintas creando estructuras cristalinas diferentes. Se les llama polimorfos y al fenómeno polimorfismo y es de vital importancia. El término multidisciplinar “polimorfismo”, del griego poli (varios) y morfos (formas), indica la diversidad de un fenómeno, hecho u objeto. En el mundo de la química aparece por primera vez cuando Mitscherling en 1882, durante el estudio de arseniatos y fosfatos, observó que composiciones idénticas cristalizaban con diferentes formas. Ello llevó a sospechar en principio y a demostrar más tarde que algunas especies químicas son capaces de agruparse en el espacio de forma variada, con lo que originan fases cristalinas con propiedades diversas en cada caso. Por lo que si un fármaco presenta dos o más polimorfos, se debe a que a pesar de que son identidades químicamente idénticas pueden dar compuestos físicamente diferentes y consecuentemente las características que derivan de su estructura en estado sólido también difieren. Tales propiedades son de tipo 59.
(60) físico (dureza, densidad, conductividad eléctrica o térmica), fisicoquímico (adsorción, estabilidad, punto de fusión), químico (reactividad, estabilidad, solubilidad, superficie específica), tecnológico (piezoelectricidad, magnetismo, refracción, reflexión y absorción de la luz), farmacológico (biodisponibilidad, inefectividad, toxicidad, contraindicaciones, efectos secundarios), etc. El ejemplo más conocido de polimorfismo es el del carbón, el cual puede existir en forma de grafito o como diamante.. 4.7 Prueba. de. actividad. antibacteriana. de. los. compuestos. obtenidos.. El objetivo inicial de este trabajo fue la extracción de compuestos a partir de un extracto crudo, en el cual, sus componentes eran desconocidos, además, se partió de purificar aquella fracción en la que usando acetona al 100% mostraba una inhibición contra bacterias, aunque no con la misma magnitud de inhibición en la que inhibía el extracto crudo proveniente de la extracción con acetato de etilo. Así que, con estos cuatro compuestos obtenidos, incluidos los polimorfos (4 y 5), los cuales no son los únicos en el extracto crudo, se realizaron pruebas de resistencia o sensibilidad (antibiogramas) con bacterias importantes a nivel hospitalario. Tal es el caso de las bacterias Vibrio parahemolyticus (causante de gastroenteritis), Vibrio cholerae (causante del cólera), Klebsiella pneumoniae (causante de infecciones en tracto urinario, neumonía, e infecciones nosocomiales), Listeria monocytogenes (causante de la listeriosis, abortos, meningoencefalitis y meningitis) y Shigella spp (causante de la disentería). Cabe mencionar que los tratamientos de erradicación se llevan a cabo con fármacos como la ciprofloxacina que son del grupo de las fluoroquinolonas, tetraciclinas y cloranfenicol. Lo que demuestra que estas bacterias son difíciles de inhibir y es la razón por la que hay una constante búsqueda de nuevos fármacos para el tratamiento de estas infecciones.. 60.
(61) Se realizó un ensayo, en donde se observó que el compuesto 2 (ciclo (L-Pro-L-Val)), inhibió a la mayoría de las bacterias sin necesidad de mezclar con otros compuestos como se observa en la figura 46 encerrado en rojo:. Figura 46. Pruebas de inhibición del compuesto 2. a) V. parahemolitycus, b) V. cholerae, c) K. pneumoniae, d) L. monocytogenes, e) Shigella spp.. Posteriormente, algo importante es que los compuestos 4 (polvo) y 5 (cristal), los cuales son polimorfos, muestran diferentes comportamientos en cuanto a la inhibición, tanto solos como en mezcla (tabla 10):. Tabla 8. Antagonismo de los compuestos 4 y 5:. Producto 4 5 4+5. Vibrio parahemolyticus 0.55 0.30 0.30. Vibrio cholerae 0.20 0.40 0.20. Klebsiella Listeria pneumoniae monocytogenes 0.55 0.40 0.40 R 0.40 0.20. Shigella 0.30 0.30 0.20. R= resistente, Halo de inhibición medido en cm.. Se puede observar en la tabla 8, que el compuesto 4 tiene más actividad antagónica en la mayoría de las bacterias (mostrado en rojo), incluso se puede observar que el compuesto 5 no tiene actividad con una bacteria (mostrado en azul) y utilizadas en mezcla el efecto es el indeseado mostrando antagonismo y no sinergismo, efecto que no se observó en la mayoría de las mezclas de los otros compuestos. Este dato concuerda con los datos de la literatura en donde los polimorfos pueden tener diferente actividad biológica.. 61.
Figure
Documento similar
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
Para recibir todos los números de referencia en un solo correo electrónico, es necesario que las solicitudes estén cumplimentadas y sean todos los datos válidos, incluido el
La determinación molecular es esencial para continuar optimizando el abordaje del cáncer de pulmón, por lo que es necesaria su inclusión en la cartera de servicios del Sistema
trañables para él: el campo, la vida del labriego, otra vez el tiempo, insinuando ahora una novedad: la distinción del tiempo pleno, el tiempo-vida, y el tiempo
1) La Dedicatoria a la dama culta, doña Escolástica Polyanthea de Calepino, señora de Trilingüe y Babilonia. 2) El Prólogo al lector de lenguaje culto: apenado por el avan- ce de
La siguiente y última ampliación en la Sala de Millones fue a finales de los años sesenta cuando Carlos III habilitó la sexta plaza para las ciudades con voto en Cortes de
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
El desarrollo de una conciencia cáritas es esencial para identificar cuando un momento de cuidado se convierte en transpersonal, es necesaria para identificar