LINFOCITOS T STEM CELL MEMORY CD8+ Y OTRAS SUBPOBLACIONES DE MEMORIA EN
PACIENTES CON ENFERMEDAD DE CHAGAS
JOSE YESID MATEUS TRIVIÑO, Bact.
Trabajo de grado para optar al título de MAGISTER EN CIENCIAS BIOLÓGICAS
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
LINFOCITOS T STEM CELL MEMORY CD8+ Y OTRAS SUBPOBLACIONES DE MEMORIA EN
PACIENTES CON ENFERMEDAD DE CHAGAS
JOSE YESID MATEUS TRIVIÑO, Bact.
ADRIANA CUÉLLAR, MSc, PhD. CONCEPCIÓN J. PUERTA, PhD.
Directora Directora
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución No. 13 de julio de 1946
La Universidad no se ha e responsable por los conceptos emitidos por sus alumnos en
sus trabajos de tesis. Sólo velará por que no se publique nada contrario al dogma y a la
moral católica y porque las tesis no contengan ataques personales contra persona alguna,
LINFOCITOS T STEM CELL MEMORY CD8+ Y OTRAS SUBPOBLACIONES DE MEMORIA EN
PACIENTES CON ENFERMEDAD DE CHAGAS
JOSE YESID MATEUS TRIVIÑO, Bact.
APROBADO
CONCEPCIÓN J. PUERTA, PhD.
Decana Facultad de Ciencias
MANUEL A. FRANCO, MD, PhD.
TABLA DE CONTENIDO
TABLA DE CONTENIDO... 5
1. RESUMEN ... 8
2. ABSTRACT ... 9
3. INTRODUCCIÓN ... 10
4. MARCO TEÓRICO ... 13
4.1 ENFERMEDAD DE CHAGAS ... 13
4.1.1 AGENTE ETIOLÓGICO ... 14
4.1.2 CICLO DE VIDA ... 14
4.1.3 VARIABILIDAD ... 15
4.1.4 FASES DE LA ENFERMEDAD Y MANIFESTACIONES CLÍNICAS ... 16
4.1.5 PATOLOGÍA ... 17
4.2 GENERALIDADES DE LA RESPUESTA INMUNE ... 19
4.2.1 SUBPOBLACIONES DE LINFOCITOS T CD8+ DE MEMORIA ... 22
4.2.2 RESPUESTA INMUNE FRENTE A T. CRUZI ... 24
5. OBJETIVOS ... 31
5.1 OBJETIVO GENERAL ... 31
5.1.1 OBJETIVOS ESPECÍFICOS ... 31
6. MATERIALES Y MÉTODOS ... 32
6.1 DISEÑO DE LA INVESTIGACIÓN ... 32
6.2 POBLACIÓN DE ESTUDIO ... 32
6.3 LISADO DE TRIPOMASTIGOTES DE T. CRUZI ... 33
6.6 DETECCIÓN DEL PARÁSITO MEDIANTE PCR CONVENCIONAL Y CUANTITATIVA ... 36
6.7 ANÁLISIS ESTADÍSTICO ... 37
7. RESULTADOS ... 38
7.1 FRECUENCIA DE LAS SUBPOBLACIONES DE LT CD8+ TOTALES EN PACIENTES CON ENFERMEDAD DE CHAGAS EN FASE CRÓNICA ... 38
7.2 FRECUENCIA DE LAS SUBPOBLACIONES DE LT CD8+ ESPECÍFICOS DE T. CRUZI EN PACIENTES CON ENFERMEDAD DE CHAGAS EN FASE CRÓNICA ... 41
7.3 PERFIL DE LA ACTIVIDAD FUNCIONAL DE LAS SUBPOBLACIONES DE LTCD8+ ESPECÍFICOS DE T. CRUZI DE PACIENTES CON ENFERMEDAD DE CHAGAS EN FASE CRÓNICA ... 43
8. DISCUSIÓN ... 49
9. CONCLUSIÓN ... 56
10. PERSPECTIVAS ... 57
11. BIBLIOGRAFÍA ... 58
12. ANEXOS ... 75
ÍNDICE DE TABLAS Tabla 1. Moléculas para la determinación de las subpoblaciones de LT CD8+ ... 23
Tabla 2. Paneles multicolor para evaluar las subpoblaciones de LT CD8+ y las subpoblaciones de LT CD8+ productores de IFN-, TNF-α o IL-2. ... 36
Tabla 3. Características de los participantes del estudio. ... 38
Tabla 4. PCC con parasitemia detectable ... 48
ÍNDICE DE FIGURAS Figura 1. Selección de las subpoblaciones de LT CD8+.. ... 39
Figura 2. Distribución de las subpoblaciones de LT CD8+ totales de los PCC y CS.. ... 40
Figura 4. Selección de los LT CD8+ que producen IFN-, TNF-α o IL-2.. ... 42
Figura 5. Distribución de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC.. ... 43
Figura 6. Actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC.. ... 44
Figura 7. Proporción de la actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC.. ... 45
Figura 8. Actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC con diferentes estados de gravedad de la enfermedad.. ... 46
Figura 9. Perfil de los LT CD8+ específicos de T. cruzi en los PCC según el estado de gravedad de la enfermedad. ... 48
Figura 10. Modelo de las subpoblaciones de LT CD8+ en PCC.. ... 55
ÍNDICE DE ANEXOS Anexo 1. Encuesta para la recolección de datos de pacientes con enfermedad de Chagas. ... 75
Anexo 2. Documento de consentimiento informado. ... 80
Anexo 3. Rango de la frecuencia de las subpoblaciones de LT CD8+ de PCC productores de IFN-, TNF-α o IL-2 frente al estímulo con SEB. ... 85
Anexo 4. Rango de la frecuencia de las subpoblaciones de LT CD8+ de PCC productores de IFN-, TNF-α o IL-2 frente al estímulo con el lisado del parásito. ... 86
Anexo 5. Artículo publicado. ... 87
Anexo 6. Artículo en preparación. ... 101
1. RESUMEN
En la infección por Trypanosoma cruzi se ha mostrado que los linfocitos T (LT) CD8+ juegan un papel importante en el control de la infección. Los LT CD8+ son una población heterogénea que incluye subpoblaciones con diferentes grados de diferenciación y capacidad multifuncional: Stem cell memory (TSCM), memoria central
(TCM), memoria transicional (TTM), memoria efectora (TEM) y efectores terminales (TTE).
Los TSCM son una subpoblación temprana que tienen la capacidad de auto-renovarse y
diferenciarse en otras subpoblaciones celulares. Para evaluar si la distribución de los TSCM y de las otras subpoblaciones celulares de LT CD8+ está asociada al control de la
progresión de la enfermedad de Chagas, células mononucleares de sangre periférica de pacientes con enfermedad de Chagas en fase crónica (PCC) se marcaron con anticuerpos conjugados para el análisis de las subpoblaciones de LT CD8+ y de la actividad multifuncional de las subpoblaciones productoras de IFN-, TNF-α o IL-2, encontrándose que los PCC con formas más graves de la enfermedad presentan una menor frecuencia de TSCM y una mayor frecuencia de TTE. De hecho, en estos pacientes
no se detectaron TSCM específicos del parásito. Además, se observó la pérdida de la
multifuncionalidad en pacientes con estados más graves de la enfermedad con células productoras de IFN- y TNF-α. Estos hallazgos sugie e ue los TSCM podrían estar
2. ABSTRACT
CD8+ T cells have been shown to play a crucial role in Trypanosoma cruzi infection. Memory CD8+ T cells can be categorised based on their distinct differentiation stages and functional activities as follows: stem cell memory (TSCM), central memory (TCM),
transitional memory (TTM), effector memory (TEM) and terminal effector (TTE) cells. To
characterise the CD8+ T cell subsets that could be participating in the control of T. cruzi infection, we compared circulating CD8+ T cell subsets among chronic chagasic patients (CCPs) with different degrees of disease severity, and phenotypic and functional activity analyses were performed with peripheral blood mononuclear cells from CCPs. We observed a decreased frequency of total TSCM along with an increased
frequency of TTE in CCPs with severe disease. Antigen-specific TSCM cells were not
detectable in CCPs with severe forms of the disease. Functional profile of CD8+ T cell subsets among CCPs revealed a high frequency of monofunctional CD8+ T cells in the most severe patients with IFN-+- or TNF-α+-producing cells. These findings suggest
that CD8+ TSCM cells could be associated with the immune response to and outcome of
3. INTRODUCCIÓN
La enfermedad de Chagas, causada por el parásito intracelular Trypanosoma cruzi, representa un problema de salud pública en América Latina con alrededor de 8 millones de personas infectadas, incluyendo Colombia donde para el 2005 se habían reportado alrededor de 436.000 personas infectadas (Rassi et al., 2010; WHO, 2012). La enfermedad de Chagas ha cobrado importancia en zonas no endémicas para la enfermedad como resultado de la migración de personas de áreas endémicas (Basile et al., 2011). La enfermedad se presenta con una fase aguda que pasa desapercibida, progresa a una fase crónica asintomática y alrededor de 10 al 30% de los pacientes desarrollan, 10 a 20 años más tarde, alteraciones cardiacas o digestivas que pueden llevar a la muerte (Rassi et al., 2010).
En humanos con infección crónica por T. cruzi, aún no son claros los mecanismos inmunológicos involucrados en el control de la infección que evitan la progresión a la fase sintomática de la enfermedad. En modelos murinos de infección aguda por T. cruzi, se ha encontrado que los linfocitos T (LT) CD8+ y la producción de interferón gama (IFN-) y perforina son necesarios para el control de la parasitemia y la sobrevida de los ratones. Por ejemplo, ratones genéticamente modificados que no tienen LT CD8+, IFN- o peforina, muestran una alta parasitemia y un disminuido porcentaje de sobrevida comparado con los ratones silvestres (Tzelepis et al., 2006). Además, la ausencia de los LT CD8+ conlleva al aumento de la parasitosis y la inflamación en tejido cardiaco de ratones con infección crónica (Tarleton et al., 1994). En pacientes con enfermedad de Chagas con infección crónica, los LT CD8+ parecen declinar tanto en número como en función a lo largo de las décadas de infección. Se ha mostrado que las formas más graves de la enfermedad se asocian con una menor frecuencia de LT CD8+ productores de IFN- en pacientes con enfermedad de Chagas (Albareda et al., 2006; Laucella et al., 2004).
hecho, en algunos modelos, la multifuncionalidad se asocia con protección o control de progresión de la enfermedad (Seder et al., 2008), como es el caso de la infección crónica por el virus de inmunodeficiencia humana (VIH) (Betts et al., 2006) y virus de la hepatitis C (VHC) (Ciuffreda et al., 2008; Choi et al., 2013). En pacientes con formas graves de la enfermedad de Chagas se ha reportado una alta frecuencia de LT CD8+ con un estado de diferenciación tardío, las cuales tienen una disminuida capacidad de producir IFN-, hecho que podría asociarse a una falla en el control de la infección (Albareda et al., 2006).
El desarrollo de tecnologías como la citometría de flujo multiparamétrica y la disponibilidad de un mayor número de conjugados para la detección de nuevas moléculas, permite realizar análisis más detallados de la composición de una población celular. De esta manera, se conoce en la actualidad que los LT CD8+ son una población heterogénea que incluye subpoblaciones con diferentes características en cuanto a su actividad funcional, capacidad de proliferar, sobrevivir y recircular en los órganos periféricos (Farber et al., 2014). Para el momento actual, se ha descrito que el compartimiento de los LT CD8+ de memoria comprende células: Stem cell memory (TSCM), memoria central (TCM), memoria transicional (TTM), memoria efectora (TEM) y
efectores terminales (TTE) (Mahnke et al., 2013). Los TSCM CD8+ se describieron
recientemente como una subpoblación temprana de larga vida con una alta capacidad de autorenovarse y diferenciarse en otras subpoblaciones de memoria clásicas como TCM y TEM (Gattinoni et al., 2011), sin embargo, hasta el momento no se conoce el
papel que juegan estas células en la respuesta inmune de pacientes con enfermedad de Chagas.
pregunta de investigación del presente trabajo fue: ¿Cómo se distribuyen los linfocitos T stem cell memory CD8+ y las otras subpoblaciones de memoria en cuanto a
frecuencia y actividad multifuncional en pacientes con enfermedad de Chagas en fase
4. MARCO TEÓRICO 4.1 Enfermedad de Chagas
La enfermedad de Chagas, causada por el protozoo flagelado T. cruzi, es endémica en América Latina con alrededor de 8 millones de personas infectadas (WHO, 2012). En Colombia se estimó que para el 2005, 436.000 personas estaban infectadas y que el 11% de la población se encontraba en riesgo de adquirir la infección (Rassi et al., 2010). En la actualidad, la enfermedad es considerada un problema de salud pública en el mundo, debido a las migraciones de personas de áreas endémicas para la enfermedad a áreas no endémicas (Basile et al., 2011).
Aunque la infección es adquirida principalmente por vía vectorial, la vía oral ha constituido una importante forma de transmisión en algunos países de Latinoamérica. Además, se han considerado otras vías de transmisión: congénita, transfusiones sanguíneas, trasplantes de órganos y accidentes de laboratorio (WHO, 2012).
En la actualidad existen dos fármacos utilizados para el tratamiento de la infección: Benznidazol y Nifurtimox. De acuerdo con su efectividad, el tratamiento se recomienda para los casos agudos, congénitos, de reactivación de la infección, para todos los niños con infección y para pacientes en fase crónica con menos de 18 años (Bern, 2011; Rassi et al., 2010). Aunque la efectividad del tratamiento en la fase crónica de la infección es controversial, debido a la falta de ensayos clínicos en humanos en fase crónica asintomática y sintomática, el tratamiento en este grupo de pacientes se ha sugerido debido a que en algunos pacientes en fase crónica evita la progresión de la enfermedad y la disminución de anticuerpos séricos específicos de T. cruzi (Cancado, 2002; Saude., 2005; Viotti et al., 2006). Estos fármacos son altamente
tóxicos y presentan efectos secundarios como fiebre, dolor abdominal y muscular, anorexia, nauseas, vómito, pérdida de peso, reacciones subcutáneas, entre otros (Bern, 2011).
4.1.1 Agente etiológico
T. cruzi es un parásito protozoo flagelar que se caracteriza por organizar su ADN
mitocondrial en un orgánulo conocido como Cinetoplasto, pertenece al dominio Eukaryota, filo Euglenozoa, orden Kinetoplastida y familia Trypanosomatidae. Presenta
cuatro formas durante su ciclo de vida: epimastigotes, tripomastigotes metacíclicos, amastigotes y tripomastigotes sanguíneos (Stuart et al., 2008).
4.1.2 Ciclo de vida
T. cruzi es transmitido al hombre a través de las heces de insectos hematófagos
infectados de la familia Reduviidae, subfamilia Triatominae, que se alimentan principalmente de sangre. En Colombia, las especies de vectores que están asociadas a la transmisión de la infección son Rhodnius prolixus, Triatoma dimidiata, T. maculata y T. venosa (Guhl et al., 2007).
se multiplica por fisión binaria. Luego, en la región posterior del intestino se diferencia en la forma infectiva, tripomastigote metaciclíco, el cual es depositado con las heces del vector en el momento de la picadura al mamífero. Estas formas metacíclicas, ingresan por mucosas o una herida e infectan fibroblastos y macrófagos (Teixeira et al., 2006). Dentro de las células, los tripomastigotes se diferencian en amastigotes y tras varias rondas de replicación se diferencian en tripomastigotes que son liberados al torrente sanguíneo por la ruptura de la célula. Los tripomastigotes tienen la capacidad de infectar otras células e iniciar el ciclo nuevamente (Stuart et al., 2008).
4.1.3 Variabilidad
T. cruzi es un parásito que presenta una alta variabilidad genética. Por esto, se han
propuesto diferentes marcadores moleculares que permiten agrupar las poblaciones de T. cruzi que se encuentran relacionadas genéticamente entre sí con el fin de correlacionar la biología, bioquímica y genética del parásito. Estos grupos de T. cruzi se conocen como unidades discretas de tipificación (DTU o Discrete Typing Units) y se han propuesto seis DTU: TcI, TcII, TcIII, TcIV, TcV y TcVI (Zingales et al., 2009). Recientemente, se ha propuesto un nuevo grupo conocido como TcBat, el cual incluye alrededor de 30 especies de tripanosomas que han sido encontrados en diferentes especies de murciélagos (Zingales et al., 2012). Adicionalmente, algunas DTU de T. cruzi se han asociado a las manifestaciones clínicas que desarrollan los pacientes
infectados, en donde TcI, TcII, TcV y TcVI se han asociado al desarrollo de alteraciones cardiacas y TcII, TcV y TcVI al desarrollo de alteraciones digestivas o megasíndromes (Zingales et al., 2012).
co-infección de TcI con TcII, TcIV (Mantilla et al., 2010; Sanchez et al., 2013) y TcBat (Ramírez et al., 2013).
4.1.4 Fases de la enfermedad y manifestaciones clínicas
La enfermedad de Chagas cursa con dos fases secuenciales: una fase aguda, seguida de una fase crónica que se puede clasificar en asintomática y sintomática con alteraciones cardiacas o digestivas. La fase aguda de la enfermedad de Chagas se caracteriza por una alta parasitemia y tiene una duración de 4 a 8 semanas. En esta fase, alrededor del 90 al 95% de los pacientes pueden presentar signos y síntomas que se resuelven de manera espontánea. Por otro lado, entre el 5 y el 10% de los pacientes infectados por el parásito mueren por el desarrollo de miocarditis o meningoencefalitis aguda (Rassi et al., 2010; Telleria et al., 2010). Sin embargo, existen pocos reportes de casos de individuos que de manera espontánea, son capaces de eliminar el parásito y curarse (Bertocchi et al., 2013; Dias et al., 2008; Francolino et al., 2003).
En los pacientes que desarrollan síntomas en la fase aguda, el signo de Romaña y chagoma son las manifestaciones clínicas en el sitio de entrada del parásito y se caracterizan por una inflamación indolora de los párpados o la piel, respectivamente. Puede presentarse fiebre acompañada de astenia, anorexia y dolor de cabeza. Los principales signos sistémicos son adenopatía, hepatomegalia, esplenomegalia y edema subcutáneo. Generalmente no se observan alteraciones en electrocardiograma (ECG) o radiografía de radiografía de tórax, esófago y colon (Rassi et al., 2010; Telleria et al., 2010).
Alrededor de 10 a 30 años después de la infección, cerca del 30 al 40% de los pacientes desarrollan la fase crónica sintomática con manifestaciones cardíacas o digestivas (Rassi et al., 2010). La forma cardíaca es la más común de las manifestaciones clínicas de la enfermedad en Colombia y está asociada a la alta frecuencia de la DTU TcI encontrado en los pacientes con infección por T. cruzi (Sanchez et al., 2013; Zingales et al., 2012). Esta forma de la enfermedad es caracterizada por arritmias, falla cardiaca y tromboembolismo. Las arritmias a menudo están acompañadas de palpitaciones y síncopes. La falla cardiaca es la manifestación más común y está asociada con una alta mortalidad. El cerebro es el sitio más frecuente de embolismos y se asocia con accidentes cerebrovasculares (ACV) y muerte súbita. En pacientes con la forma cardiaca de la enfermedad se encuentran alteraciones en ECG con aumento en el tamaño del corazón que se vuelve más evidente cuando la gravedad de la enfermedad aumenta (Rassi et al., 2010; Telleria et al., 2010). La forma digestiva de la enfermedad es caracterizada por alteraciones en las funciones motoras, secretoras y de absorción del tracto gastrointestinal ocasionadas por lesiones del sistema nervioso entérico, provocando megaesófago o megacolon. Los principales síntomas en el megaesófago son disfagia, regurgitación y dolor esofágico, pero pueden presentarse otros síntomas menos comunes como hipo, pirosis y sialorrea. En pacientes con megacolon los síntomas más comunes son estreñimiento, meteorismo, disquecia y con menos frecuencia, dolor cólico abdominal. Estos pacientes presentan un diámetro de los órganos aumentado, lo cual es evidente en la radiografía de esófago y colon (Telleria et al., 2010).
4.1.5 Patología
principales hipótesis de la patogenia de la enfermedad de Chagas (Gutierrez et al., 2009; Machado et al., 2012).
La hipótesis autoinmune postula que el daño cardiaco es el resultado de una respuesta inmune contra antígenos propios del hospedero (Machado et al., 2012). Los mecanismos que se han propuesto en la hipótesis autoinmune son el mimestimo molecular encontrado entre antígenos del parásito y proteínas del hospedero, la existencia de antígenos crípticos liberados luego de la lisis de células del miocardio que han sido infectadas por el parásito y la activación policlonal de linfocitos por un
efecto de espectado (Machado et al., 2012). En pacientes con infección crónica por T. cruzi se han encontrado auto-anticuerpos y LT autorreactivos que se generan por el
mimetismo molecular entre antígenos del parásito y proteínas del hospedero (Cunha-Neto et al., 2006), por ejemplo se ha encontrado LT autorreactivos específicos de la miosina cardíaca en los pacientes con formas graves de la enfermedad de Chagas, que son capaces de reconocer la proteína B13 de T. cruzi (Cunha-Neto et al., 1996).
(Bustamante et al., 2002); (D) en individuos con infección crónica co-infectados con el virus de inmunodeficiencia humana (VIH) (Sartori et al., 1998) o pacientes que han sido tratados con inmunosupresores en el trasplante de órganos (Altclas et al., 1999) se ha encontrado que pueden generar o reactivar el daño cardiaco, lo cual sugiere que la presencia de la respuesta inmune es necesaria para el control de la replicación del parásito en el tejido cardiaco.
4.2 Generalidades de la respuesta inmune
El sistema inmune contribuye a mantener la homeostasis del organismo permitiendo la eliminación de microorganismos patógenos y tolerando aquellos componentes propios o que no tienen un potencial patogénico tal como la flora comensal, antígenos ambientales o de los alimentos. La respuesta inmune se compone de dos mecanismos de defensa cuya interrelación permite el adecuado funcionamiento de la inmunidad definidos como inmunidad innata e inmunidad adaptativa (Chaplin, 2010).
Mediante los receptores de reconocimiento de patrones (PRR o Pattern recognition receptor) como los receptores tipo Toll (TLR o Toll-like receptor) o NOD (NLR o
Nucleotide-binding oligomerization domain receptors) se generan señales
intracelulares que conllevan a la producción de citoquinas pro-inflamatorias y quimioquinas que activan y atraen otras células. En un proceso inflamatorio con manifestaciones sistémicas, estas citoquinas inducen fiebre, promueven cambios vasculares, alteraciones en la presión sanguínea y favorecen la activación del endotelio. Estas señales inducen la producción de la pro-IL-1β y es el complejo multiprotéico inflamosoma quien se encarga de activar la IL-1β mediante un procesamiento proteolítico utilizando componentes de los NLR, la proteína adaptadora ASC (Apoptosis-associated speck-like protein containing a caspase recruitment domain) y caspasas (Turvey et al., 2010).
La inmunidad adaptativa se caracteriza por una alta especificidad frente a diversas moléculas y la propiedad de generar memoria inmunológica luego del encuentro con el antígeno. En contraste de los receptores de la inmunidad innata, la inmunidad adaptativa depende de receptores que sufren procesos de recombinación somática de segmentos génicos que generan un repertorio de receptores altamente específicos. Estos receptores son los receptores de antígenos de los LT (TCR o T cell receptor) y LB (BCR o B cell receptor) (Bonilla et al., 2010). En la inmunidad adaptativa, el componente humoral está compuesto por citoquinas y las inmunoglobulinas (Ig) o anticuerpos, los cuales pueden unirse de manera específica a moléculas de los patógenos, neutralizar patógenos y reclutar moléculas del complemento o células para destruirlos. El componente celular está compuesto por los linfocitos B (LB) y linfocitos T (LT): CD4+ y CD8+. Los LB maduran en médula ósea y los LT maduran en timo y mediante un proceso de selección, adquieren un fenotipo CD4+ o CD8+ (Bonilla et al., 2010).
presentar en contexto del complejo mayor de histocompatibilidad (CMH) II o I los antígenos exógenos y endógenos a los LT CD4+ y CD8+, respectivamente. Durante este proceso, las DC maduran aumentando los niveles de expresión de las moléculas del CMH, moléculas coestimuladoras y la producción de citoquinas y quimioquinas. Las CPA migran a los órganos linfoides secundarios para llevar a cabo la activación linfoide mediante la sinapsis inmunológica, que resulta en la generación de señales intracelulares que contribuyen a la activación linfoide. Posteriormente, los LT activados entran en un proceso de expansión y diferenciación en células efectoras. Estas células adquieren patrones de migración a los tejidos u órganos donde se llevó a cabo el encuentro con el antígeno. Luego de la expansión clonal, en el órgano linfoide secundario ocurre un proceso de contracción en donde alrededor del 90 al 95% de las células mueren por apoptosis y de la población que sobrevive se generan las células de memoria (Bonilla et al., 2010).
4.2.1 Subpoblaciones de linfocitos T CD8+ de memoria
Los LT CD8+ de memoria son una población celular heterogénea, incluye subpoblaciones con variada actividad funcional, así como diferente capacidad para proliferar, sobrevivir y recircular a diferentes tejidos u órganos (Farber et al., 2014). A la fecha, se han descrito distintas subpoblaciones de LT CD8+ de memoria de acuerdo con su grado de diferenciación: stem cell memory (TSCM, temprano), memoria central
(TCM), memoria transicional (TTM), memoria efectora (TEM) y efectores terminales (TTE,
tardío) (Mahnke et al., 2013).
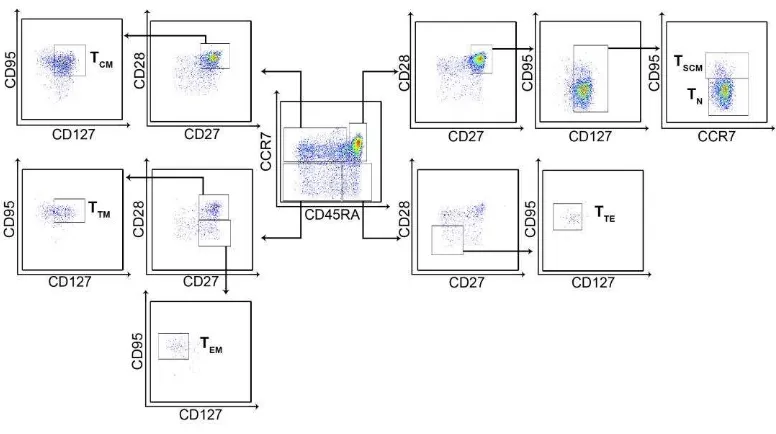
Las subpoblaciones de LT CD8+ pueden ser analizadas con base en su fenotipo, que consiste en el análisis de la expresión diferencial de moléculas de superficie. Recientemente, se propuso el uso de CD45, CCR7, CD28 y CD95 para la determinación de las subpoblaciones de LT CD8+ (Mahnke et al., 2013).
La glicoproteína CD45 tiene distintas isoformas (CD45RA, RB, RC, RO) que son expresadas diferencialmente en los LT, el dominio citoplasmático de la proteína CD45 tiene actividad tirosina fosfatasa y su expresión está asociada a la capacidad de proliferación y activación de los LT (Leitenberg et al., 2007). La expresión de la isoforma CD45RA permite identificar a los LT vírgenes (TN) y LT con activación
temprana como los stem cell memory (TSCM) (Gattinoni et al., 2011) y la expresión de la
isoforma CD45RO a los LT de memoria, sin embargo, se ha reportado que los LT CD8+ efectores terminales (TTE) son capaces re-expresar la isoforma CD45RA (Henson et al.,
2012).
(Gattinoni et al., 2011) y memoria central (TCM) son capaces de expresar CCR7 (Appay
et al., 2008).
La glicoproteína CD28 es una molécula co-estimuladora que se une a los receptores del complejo B7 (CD80 y CD86), y se encuentra implicada en la activación de los LT (Sharpe et al., 2002). En conjunto con la molécula co-estimuladora CD27 (ligando de CD70) (Nolte et al., 2006), permite la identificación de LT con diferentes grados de diferenciación: temprano (CD28+CD27+), intermedio (CD28-CD27+) y tardío (CD28 -CD27-) (Appay et al., 2002).
El receptor de muerte FAS o CD95 está implicado en la regulación de procesos de muerte programada o apoptosis (Lavrik et al., 2012) y su expresión permite diferenciar a los TN (CD95-) de los LT activados (CD95+) (Cossarizza et al., 2000).
[image:24.612.130.482.593.695.2]Adicionalmente, existen otras moléculas cuya expresión diferencial contribuye a la identificación de las subpoblaciones de los LT, como la cadena α del receptor de la IL-7 o CD127. Esta molécula, en conjunto con la cadena común del receptor de la IL-2 o CD132, conforman el receptor de la IL-7, la cual es importante en la maduración y la proliferación homeostática de los LT (Tan et al., 2001). La disminución de la expresión de CD127 se ha asociado con un mayor grado de diferenciación en LT CD8+ (Appay et al., 2008; Burgers et al., 2009). Analizando la expresión de estos marcadores es posible identificar las diferentes subpoblaciones de LT CD8+ de memoria como se muestra en la Tabla 1.
Tabla 1. Moléculas para la determinación de las subpoblaciones de LT CD8+
TN TSCM TCM TTM TEM TTE
CD45RA + + - - - +
CD95 - + + + + +
CCR7 + + + - - -
CD28 + + + + - -
CD27 + + + + + -
En cuanto a la actividad funcional de los LT CD8+, se ha propuesto que varía según el grado de diferenciación celular. Así, las células con un estado de diferenciación temprano, como las TCM tienen una alta actividad multifuncional para producir
citoquinas como IFN-, TNF-α e IL-2 y a medida que las células aumentan su grado de diferenciación pierden actividad multifuncional, como las TTE que pierden la capacidad
de producir TNF-α e IL-2 (Seder et al., 2008). 4.2.2 Respuesta inmune frente a T. cruzi
Los mecanismos de defensa frente a la infección por T. cruzi implican tanto la respuesta inmune innata como la adaptativa. En infección aguda, mediante diferentes mecanismos, el parásito es capaz de evadir la respuesta inmune, invadir las células y diseminarse por vía hematógena a otros tejidos donde establece infección crónica. Los mecanismos que contribuyen a controlar la infección y evitar el progreso a la fase sintomática son poco conocidos.
4.2.2.1 Inmunidad innata
La activación de la inmunidad innata en la infección por T. cruzi inicia en el reconocimiento de moléculas presentes en el parásito, la inducción de la producción de citoquinas pro-inflamatorias y activación de células que se encargan de controlar la replicación del parásito.
susceptibilidad a la infección comparado con los ratones silvestres (Silva et al., 2010). Recientemente, se mostró que componentes del inflamosoma como ASC, NLRP3 (perteneciente a la familia de los NLR) y la caspasa 1 tienen un papel importante en la activación de la IL-1β, la cual está involucrada en el control de la replicación del parásito puesto que la ausencia de estos componentes del inflamosoma conlleva al aumento de la carga parasitaria en modelos murinos de infección (Silva et al., 2013). Además, en la infección por T. cruzi se ha encontrado que se activan la vía alterna y la vía de las lectinas del complemento mediante el reconocimiento de moléculas presentes en la superficie del parásito como manosa, N-acetilglucosamina y galactosa (Cestari et al., 2009; Cestari et al., 2010). Finalmente, el reconocimiento de estas moléculas mediante los PRR inducen la producción de citoquinas pro-inflamatorias (IFN-, IL-12, IL-1β, TNF-α, IL-1β) y quimioquinas (IL-8, CCL-2, MIP-1β) (Bartholomeu et al., 2008; Caetano et al., 2011; Campos et al., 2001; Oliveira et al., 2004; Ouaissi et al., 2002).
4.2.2.2 Inmunidad adaptativa
En la infección aguda por T. cruzi, aunque se ha encontrado que la infección conlleva a una activación policlonal de los LB (el Bouhdidi et al., 1994), la inmunidad humoral es importante para el control de la parasitemia, de hecho, la eliminación de los LB conlleva a un aumento de la parasitemia y la muerte rápida de ratones infectados (Kumar et al., 1998). Además, la transferencia de anticuerpos a ratones infectados, permite la eliminación de los parásitos que se encuentra en circulación (Brodskyn et al., 1989). En la fase crónica de la infección, a la inmunidad humoral se le ha atribuido un doble papel, por un lado al control de la parasitemia y por otro lado al desarrollo de la patología de la enfermedad de Chagas. Por ejemplo, los anticuerpos líticos específicos median la lisis de las formas infectivas del parásito y estos se encuentran disminuidos en las formas más severas de la enfermedad al comparar con las formas menos severas, lo cual sugiere un papel protector de estos anticuerpos en el control de la progresión de la enfermedad (Cordeiro et al., 2001; Gazzinelli et al., 1991). Sin embargo, en PCC se ha encontrado anticuerpos que reconocen antígenos del parásito, pero que mediante reacción cruzada pueden reconocer proteínas del hospedero, los cuales podrían estar implicados en el daño tisular y la patología de la enfermedad (Cunha-Neto et al., 1995).
mayor frecuencia de LT CD4+ reguladores (CD25+) productores de IL-10 y LT CD4+ productores de IL-17 comparado con pacientes en fase crónica sintomática, sugiriendo que la regulación de la respuesta inmune es importante para evitar el desarrollo de la patología (de Araujo et al., 2011; Guedes et al., 2012). Por lo tanto, en la infección crónica por T. cruzi el papel de los LT CD4+ es controversial.
En modelos murinos de infección aguda por T. cruzi, se ha encontrado que los LT CD8+ y la producción de IFN- y perforina son necesarios para el control de la parasitemia y la sobrevida de los ratones (Rottenberg et al., 1993; Tzelepis et al., 2006). Además, la ausencia de estas células conlleva al aumento de la parasitosis y la inflamación en tejido cardiaco de ratones con infección crónica (Tarleton et al., 1994). En tejido cardiaco de PCC sometidos a trasplante de corazón, se encuentra infiltrado predominante de LT CD8+ (Giraldo et al., 2011; Reis et al., 1993). Además, en PCC en fase crónica sintomática, se ha sugerido que los LT CD8+ están implicados en el control de la progresión de la enfermedad de Chagas, teniendo en cuenta que se ha reportado una menor frecuencia de LT CD8+ que producen IFN-, una mayor frecuencia de LT CD8+ con un estado de diferenciación tardío comparado con pacientes con enfermedad de Chagas en fase crónica asintomática.
4.2.2.3 Mecanismos de evasión de la respuesta inmune
T. cruzi tiene la capacidad de invadir distintos tipos de células nucleadas de mamíferos
membrana compuestos por caveolina o flotilina y mediada por clatrina, así como macropinocitosis y fagocitosis. Mediante estos mecanismos de endocitosis, los parásitos internalizados son transportados al interior de la célula en una vacuola formada por la membrana plasmática conocida como endosoma temprano, el cual puede fusionarse o no a los lisosomas formando la vacuola parasitófora. Otro mecanismo propuesto en la invasión por T. cruzi a las células del hospedero se relaciona con la inducción de un proceso de reparación de la membrana plasmática en respuesta al daño ocasionado por el parásito, lo cual conlleva al aumento intracelular de calcio y la exocitosis de lisosomas que se fusionan con la membrana y facilitan la entrada del parásito mediante la formación de la vacuola parasitófora (Barrias et al., 2013). El parásito se libera de la vacuola parasitófora mediante la secreción de proteínas como TcTox y LYT1 que forman poros en la membrana de la vacuola para su posterior liberación y diferenciación en amastigotes (Epting et al., 2010).
T. cruzi es un parásito altamente variable con cepas que difieren en patogenia y
Otro mecanismo de evasión de la respuesta inmune por T. cruzi es la inhibición de la lisis mediada por el complemento. Los tripomastigotes de T. cruzi expresan proteínas homólogas a la proteína reguladora del complemento factor acelerador del decaimiento (DAF o Decay-accelerating factor) (Beucher et al., 2008; Norris et al., 1991), las cuales les permite inhibir la formación de la C3 convertasa mediante la unión a las proteínas C3b y C4b del complemento (Norris et al., 1997). Otra proteína de T. cruzi que tiene la capacidad de inhibir la activación del complemento es la calreticulina, una proteína de membrana que se une a C1q e inhibe la activación de la vía clásica (Ferreira et al., 2004). Por último, se ha encontrado que los tripomastigotes que expresan la proteína CRIT (Complement C2 Receptor Inhibitor Trispanning protein) son capaces de inhibir la activación de la vía de las lectinas del complemento (Cestari et al., 2008).
En el modelo murino de infección por T. cruzi, se ha encontrado que la inducción de una respuesta linfoide de tipo 2 (Th2) está asociada con la persistencia del parásito, ya que en ratones genéticamente modificados, deficientes de los genes STAT4 o STAT6 (Signal Transducer and Activator of Transcription) los cuales están encargados de inducir una respuesta tipo 1 o tipo 2, respectivamente, se observó que la deficiencia de STAT6 se asocia con el control de la infección, sin embargo, los ratones deficientes de STAT4 tenían una alta susceptibilidad a la infección por T. cruzi (Tarleton et al., 2000). Además, en modelos murinos se ha demostrado que las mucinas ancladas a GPI (Kahn et al., 1997) y los GIPL (N. Gomes et al., 1996) de T. cruzi son capaces de inhibir la secreción de IL-2 e inducir la producción de IL-4 en los LT.
T. cruzi modula la maduración de las DC mediante la disminución de las moléculas del
5. OBJETIVOS 5.1 Objetivo general
Comparar los linfocitos T stem cell memory CD8+ (TSCM) y otras subpoblaciones de
memoria circulantes: memoria central (TCM), memoria transicional (TTM), memoria
efectora (TEM) y efectores terminales (TTE) y su actividad multifuncional entre pacientes
con enfermedad de Chagas en fase crónica con distintos estados de gravedad de la enfermedad.
5.1.1 Objetivos específicos
1. Comparar la frecuencia de las subpoblaciones de LT CD8+ de memoria circulantes: TSCM, TCM, TTM, TEM y TTE en pacientes con enfermedad de Chagas en
fase crónica con distintos estados de gravedad de la enfermedad.
2. Comparar la frecuencia de las subpoblaciones de LT CD8+ de memoria específicos de Trypanosoma cruzi circulantes: TSCM, TCM, TEM y TTE que producen
6. MATERIALES Y MÉTODOS 6.1 Diseño de la investigación
Este trabajo corresponde a un estudio descriptivo de corte transversal con datos recolectados en un único punto de tiempo.
6.2 Población de estudio
Para el presente trabajo se incluyeron 9 individuos sanos como controles (CS) y 32 pacientes con enfermedad de Chagas en fase crónica (PCC). Los datos de los pacientes fueron recolectados por encuesta e historia clínica en consulta médica en el Instituto Nacional de Salud, la Fundación Abood Clínica Shaio y el Hospital Universitario San Ignacio en Bogotá, Colombia (Anexo 1). Se obtuvo la firma del consentimiento informado de todos los individuos incluidos en el estudio que estuvieron de acuerdo con su participación, en donde se les explicó las generalidades de la enfermedad de Chagas, los objetivos de la investigación, riesgos, derechos y beneficios de su participación en el estudio (Anexo 2). El presente trabajo fue avalado y aprobado por el Comité de Ética del Instituto Nacional de Salud, la Fundación Clínica Abood Shaio y la Facultad de ciencias de la Pontificia Universidad Javeriana.
Association) clase I; el grupo B, individuos con hallazgos anormales en el ECG, tamaño
de corazón normal, FEVI normal y valoración funcional de la escala de la NYHA de clase I; el grupo C, individuos con hallazgos anormales en el ECG, incremento en el tamaño del corazón, reducción en la FEVI y valoración funcional de la escala de la NYHA de clase II o III; y el grupo D, individuos con hallazgos anormales en el ECG, incremento en el tamaño del corazón, reducción de la FEVI y valoración funcional de la escala de NYHA de clase IV.
6.3 Lisado de tripomastigotes de T. cruzi
El lisado de tripomastigotes de T. cruzi se realizó a partir de tripomastigotes de cultivo en células VERO (ATCC CCL-81, Manassas, VA, USA), según lo reportado previamente con algunas modificaciones (N. Yoshida et al., 1989). Brevemente, formas tripomastigotas de la cepa de T. cruzi I MHOM/CO/01/DA fueron incubadas 24 horas con células VERO a 37°C y 5% de CO2 en medio Dulbecco's Modified Eagle Medium (DMEM) (Eurobio; Les Ulis, Francia), suplementado con suero fetal bovino al 10% en una relación parásito:célula de 10:1. La obtención del lisado de tripomastigotes de T. cruzi se realizó de acuerdo con lo descrito en el 2007 con algunas modificaciones
6.4 Anticuerpos conjugados fluorescentes
Los conjugados seleccionados para el análisis por citometría de flujo fueron: CD3-Pacific Blue (BD Pharmingen; Clona UCHT1; Catálogo No. 558117; San Diego, CA, USA), CD8-APC H7 (BD Pharmingen; Clona SK1; Catálogo No. 641400), CD45RA-PE (BD Pharmingen; Clona HI100; Catálogo No. 555489), CCR7-PE-Cy7 (BD Pharmingen; Clona 3D12; Catálogo No. 557648), CD28-PerCP-Cy5.5 (BD Biosciences; Clona L293; Catálogo No. 337181; San Jose, CA, USA), CD27-Alexa Fluor 700 (BD Pharmingen; Clona M-T271; Catálogo No. 560611), CD95-APC (BD Pharmingen; Clona DX2; Catálogo No. 558814) y CD127-FITC (BD Pharmingen; Clona HIL-7R-M21; Catálogo No. 560549). Los anticuerpos conjugados para el marcaje de citoquinas intracelulares: IFN-γ-FITC (BD Pharmingen; Clona 4S.B3; Catálogo No. 554551), IL-2-PerCP-Cy5.5 (BD Pharmingen; Clona MQ1-17H12; Catálogo No. 560708) y TNF-α-Alexa Fluor 700 (BD Biosciences; Clona MAb11; Catálogo No. 557996). Adicionalmente, se incluyó el marcador de viabilidad Fixable Aqua Dead Cell Stain (Invitrogen; Catálogo No. L34957; Eugene, OR, USA).
6.5 Marcaje de moléculas de superficie y citoquinas para citometría de flujo
de CMSP por 6 horas en presencia de los anticuerpos anti-CD28 y anti-CD49d, brefeldina A y lisado de tripomastigotes de T. cruzi. Como control negativo se cultivaron las células con medio y como control positivo se cultivaron con la enterotoxina B de Staphylococcus aureus (SEB) (Sigma-Aldrich). Las 6 horas que corresponden al tiempo para evaluar la producción de IFN-, TNF-α e IL-2 en los LT CD8+ se determinó de acuerdo a lo descrito previamente (Mateus et al., 2013). Posteriormente, las células fueron marcadas con el marcador de viabilidad como se describió anteriormente. Luego, las células fueron marcadas con los anticuerpos de superficie: anti-CD3, anti-CD8, anti-CD45RA, anti-CCR7 y anti-CD95 e incubadas en oscuridad durante 30 minutos a 4°C y lavadas con el tampón fosfato salino para tinción. Después, las células fueron fijadas y permeabilizadas de acuerdo con las instrucciones del fabricante del estuche comercial Cytofix/Cytoperm (BD Biosciences). Finalmente, las células fueron incubadas con los anticuerpos anti-citoquinas en oscuridad durante 30 minutos a 4°C y lavadas con Perm/Wash 1X (BD Biosciences) (Tabla 2, Panel 2). Las lecturas se realizaron en el citómetro de flujo BD FACSAria II (BD Immunocytometry Systems, San Jose, CA, USA) y se adquirieron al menos 50,000 LT CD8+. Los datos obtenidos fueron analizados usando el programa FlowJo versión 9.3.2 (Tree Star; Ashland, OR, USA), Pestle 1.7 (National Institutes of Health (NIH), Bethesda, MD, USA) y SPICE 5.3 (NIH). El criterio de positividad de la producción de IFN-, TNF-α
Tabla 2. Paneles multicolor para evaluar las subpoblaciones de LT CD8+ y las subpoblaciones de LT CD8+ productores de IFN-, TNF-α o IL-2.
Panel
1# 2##
CD3-Pacific Blue CD3-Pacific Blue
CD8- APC-H7 CD8- APC-H7
CD45RA-PE CD45RA-PE
CCR7-PE CCR7-PE
CD28-PerCP-Cy5.5 CD95-APC
CD27-Alexa Fluor 700 IFN--FITC CD127-FITC TNF-α-Alexa Fluor 700
CD95-APC IL-2-PerCP-Cy5.5
#Marcaje de las células
ex vivo. ##Marcaje de las células cultivadas
6.6 Detección del parásito mediante PCR convencional y cuantitativa
La detección de la parasitemia se realizó mediante la prueba de la reacción en cadena de la polimerasa (PCR o Polymerase chain reaction) convencional y cuantitativa. A partir de muestras de sangre anticoagulada con EDTA y preservadas con solución amortiguadora de clorhidrato de guanidina a 4°C, se obtuvo el ADN de las muestras de sangre de los PCC de acuerdo con las instrucciones del fabricante del estuche comercial High Pure PCR Template Preparation (Roche, Mannheim, Alemania). Posteriormente, con el fin de comprobar la integridad del ADN y descartar la presencia de inhibidores en las muestras, se realizó una PCR convencional utilizando los
[image:37.612.160.451.126.271.2]satelital del parásito (Piron et al., 2007). Cada muestra se montó por duplicado y la carga parasitaria se estimó con base en una curva estándar realizada con diferentes concentraciones de ADN genómico del parásito mezcladas con sangre de un CS entre un rango de 105 a 100 parásitos/mL (Duffy et al., 2009) y utilizando el software 4.0 del LightCycler 1.5 Instrument (Roche).
Para ambas PCR se incluyeron los siguientes controles: reacción (agua en el cuarto de preparación de la mezcla de reacción), gris (agua en el cuarto de adición de las muestras a la reacción), negativo (ADN de un CS) y positivo (para la PCR convencional, ADN genómico de T. cruzi I; para la PCR cuantitativa, ADN genómico de T. cruzi I correspondiente a 103 y 100 parásito/mL).
6.7 Análisis estadístico
7. RESULTADOS
7.1 Frecuencia de las subpoblaciones de LT CD8+ totales en pacientes con enfermedad de Chagas en fase crónica
[image:39.612.89.524.271.438.2]Las características de los pacientes con enfermedad de Chagas en fase crónica (PCC) y controles sanos (CS) incluidos en presente trabajo se describen en la Tabla 3. Al comparar la edad de los PCC y CS no se encontraron diferencias significativas.
Tabla 3. Características de los participantes del estudio.
Variable PCC# CS Valor de p
Sujetos, n
32 9 -
Edad (años), mediana (rango)
55 (26 – 80)
45
(32 – 60) 0,1029 §
Mujeres (%) 59,37 22,22 -
A B C D
Pacientes, n (%) 10 (31,25) 8 (25,00) 9 (28,12) 5
(15,63) - -
FEVI, mediana (rango)
60 (50–65)
60 (48–65)
30 (15–50)*
20
(10–35)** - 0,0001
§§
PCC, Pacientes con enfermedad de Chagas en fase crónica; CS, Controles sanos; FEVI, Fracción de eyección del ventrículo izquierdo.
#Las características clínicas de los PCC estándescritas en materiales y métodos. §Prueba de Mann-Whitney, PCC vs. CS.
§§Prueba estadística para múltiples comparaciones, ANOVA no paramétrico Kruskal–Wallis con post-test de Dunn
*p<0,05 (A vs. C, B vs. C), **p<0,001 (A vs. D, B vs. D).
Para comparar la frecuencia de las subpoblaciones de LT CD8+ de memoria totales: stem cell memory (TSCM), memoria central (TCM), memoria transicional (TTM), memoria
efectora (TEM) y efectores terminales (TTE) entre los PCC con diferentes estados de
Figura 1. Selección de las subpoblaciones de LT CD8+. Dispersograma representativo de la selección de las subpoblaciones de LT CD8+ totales de acuerdo con la expresión diferencial de las moléculas CD45RA, CCR7, CD28, CD27, CD95 y CD127. La selección de las subpoblaciones se realizó de acuerdo con lo reportado previamente (Chattopadhyay et al., 2005; Romero et al., 2007).
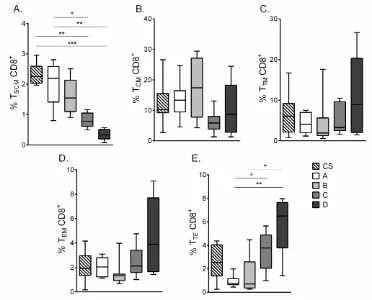
El análisis de las subpoblaciones de LT CD8+ de memoria de los PCC mostró frecuencias significativamente menores de TSCM en los grupos de pacientes C y D al
comparar con los pacientes del grupo A (Figura 2A). En contraste, los pacientes del grupo C y D mostraron frecuencias significativamente mayores de TTE (Figura 2E). No
Figura 2. Distribución de las subpoblaciones de LT CD8+ totales de los PCC y CS. Frecuencia de las subpoblaciones de LT CD8+: TSCM, TCM, TTM, TEM y TTE de los PCC con
diferentes estados de gravedad y CS (A – E, respectivamente). Las cajas y bigotes indican la mediana y el rango de la frecuencia de las subpoblaciones de LT CD8+. El valor de p se calculó mediante la prueba para múltiples comparaciones Kruskal-Wallis con el post-test de Dunn (*p<0,05, **p<0,01, ***p<0,001). Se incluyeron 9 CS y 32 PCC, estos últimos agrupados de acuerdo con la gravedad de la enfermedad como se describe en materiales y métodos (A = 10, B = 8, C = 9 y D = 5).
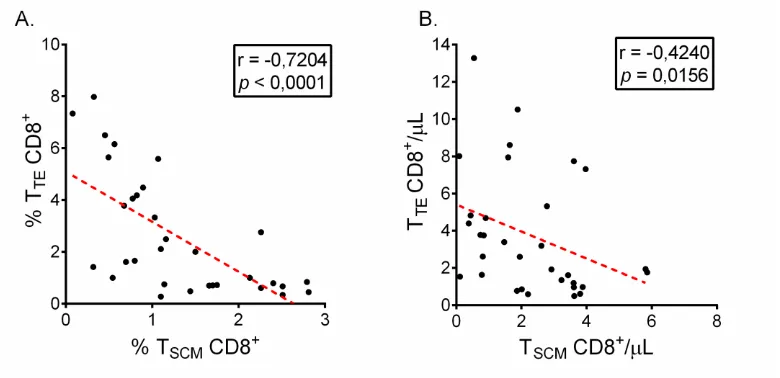
Teniendo en cuenta las diferencias observadas, se realizó un análisis de la correlación entre la frecuencia de los TSCM y TTE de los PCC, encontrándose una correlación
negativa entre la frecuencia de estas subpoblaciones (Spearman r = -0,7204, p<0,0001) (Figura 3A). Además, con el fin de establecer si la correlación negativa
[image:41.612.131.503.73.373.2]comportamiento, consistente con lo observado para la frecuencia de estas subpoblaciones celulares (Spearman r = -0,4240, p=0,0156) (Figura 3B).
Figura 3. Correlación entre los TSCM CD8+ y TTE CD8+ de los PCC. (A) Análisis de la
correlación entre la frecuencia de TSCM y TTE de los PCC. (B) Análisis de la correlación
entre el número absoluto (células/µL) de TSCM y TTE de los PCC. La correlación se
calculó por el coeficiente de correlación de Spearman. Se incluyeron 32 PCC.
7.2 Frecuencia de las subpoblaciones de LT CD8+ específicos de T. cruzi en pacientes con enfermedad de Chagas en fase crónica
Con el fin de evaluar la frecuencia de las subpoblaciones de LT CD8+ específicos de T. cruzi, las CMSP de PCC fueron estimuladas con lisado del parásito y marcadas con el
[image:42.612.123.513.129.318.2]Figura 4. Selección de los LT CD8+ que producen IFN-, TNF-α o IL-2. Representativo de los gráficos de contornos de la selección de los LT CD8+ específicos de T. cruzi que producen IFN-, TNF-α o IL-2 cultivadas con medio, la enterotoxina B de Staphylococcus aureus (SEB) o lisado de tripomastigotes de T. cruzi.
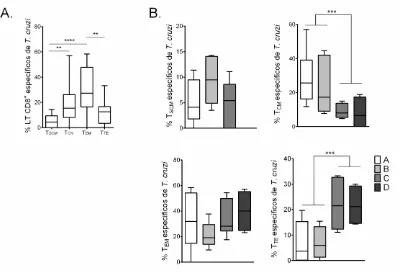
Al analizar las subpoblaciones celulares en la totalidad de los pacientes se encontró una mayor frecuencia de TEM específicos de T. cruzi (Figura 5A). Cuando se realizó el
análisis de la frecuencia de las subpoblaciones de LT CD8+ según el estado de gravedad de la enfermedad en los PCC, no se detectaron TSCM específicos de T. cruzi
productores de IFN-, TNF-α o IL-2 en pacientes del grupo D. En los PCC con formas graves de la enfermedad (C y D) se encontró una menor frecuencia de TCM específicos
de T. cruzi y una mayor frecuencia de TTE específicos de T. cruzi comparado con los
Figura 5. Distribución de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC. (A) Frecuencia de las subpoblaciones de LT CD8+: TSCM, TCM, TTM, TEM y TTE
específicas de T. cruzi de PCC. El valor de p se calculó mediante la prueba para múltiples comparaciones Kruskal-Wallis con el post-test de Dunn (**p<0,01, ****p<0,0001). (B) Frecuencias de las subpoblaciones de LT CD8+: TSCM, TCM, TTM, TEM
y TTE específicas de T. cruzi de PCC con diferentes estados de gravedad de la
enfermedad. Las cajas y bigotes indican la mediana y el rango de la frecuencia de las subpoblaciones de LT CD8+. El valor de p se calculó mediante la prueba de Mann-Whitney (***p<0,001). Los PCC fueron agrupados de acuerdo con la gravedad de la enfermedad como se describe en materiales y métodos (A = 8, B = 6, C = 6 y D = 4). 7.3 Perfil de la actividad funcional de las subpoblaciones de LT CD8+ específicos de T.
cruzi de pacientes con enfermedad de Chagas en fase crónica
células con 2 funciones (Figura 6A), en cambio, en las células específicas de T. cruzi estimuladas con el lisado del parásito se encontró una mayor frecuencia de células con una sola función (Figura 6B).
Figura 6. Actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC. (A) Frecuencia de TSCM, TCM, TEM y TTE con 1, 2 y 3 funciones estimulados
con la enterotoxina B de Staphylococcus aureus (SEB). (B) Frecuencia de TSCM, TCM, TEM
y TTE con 1, 2 y 3 funciones estimulados con lisado de tripomastigotes de T. cruzi. El
valor de p se calculó mediante la prueba de los rangos con signo de Wilcoxon (*p<0,05, **p<0,01, ***p<0,001, ****p<0,0001). Se incluyeron 24 PCC.
de los grupos A y B. Además, en los pacientes del grupo D solo se observaron células productoras de 1 citoquina en los TCM, TEM y TTE específicos de T. cruzi (Figura 7B).
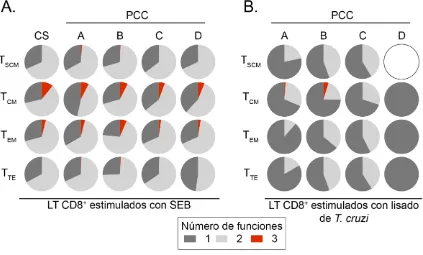
Figura 7. Proporción de la actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC. Tortas de los perfiles funcionales de TSCM, TCM, TEM y TTE de PCC con diferentes estados de gravedad de la enfermedad estimulados con la
enterotoxina B de Staphylococcus aureus (SEB) y lisado de tripomastigotes de T. cruzi. La torta blanca corresponde a la ausencia de la respuesta de la producción de IFN-, TNF-α o IL-2. Los PCC fueron agrupados de acuerdo con la gravedad de la enfermedad como se describe en materiales y métodos (A = 8, B = 6, C = 6 y D = 4).
Al evaluar la frecuencia de las subpoblaciones celulares productoras de IFN-, TNF-α o
[image:46.612.91.514.138.393.2]en las células específicas de T. cruzi estimuladas con el lisado del parásito fueron bajas en todas las subpoblaciones comparado con las células estimuladas con SEB. En contraste con lo observado en las células estimuladas con SEB, en los pacientes del grupo D no se detectó la frecuencia de células con 2 y 3 funciones en todas las subpoblaciones celulares evaluadas (Figura 8B) (Anexo 4).
Figura 8. Actividad funcional de las subpoblaciones de LT CD8+ específicos de T. cruzi de los PCC con diferentes estados de gravedad de la enfermedad. (A) Frecuencia de TSCM, TCM, TEM y TTE con 1, 2 y 3 funciones estimulados con la enterotoxina B de
funciones estimulados con lisado de tripomastigotes de T. cruzi. Los PCC fueron agrupados de acuerdo con la gravedad de la enfermedad como se describe en materiales y métodos (A = 8, B = 6, C = 6 y D = 4).
Figura 9. Perfil de los LT CD8+ específicos de T. cruzi en los PCC según el grado de gravedad de la enfermedad. Frecuencia de LT CD8+ específicos de T. cruzi que producen 1 o 2 citoquinas. Los PCC fueron agrupados de acuerdo con la gravedad de la enfermedad como se describe en materiales y métodos (A = 8, B = 6, C = 6 y D = 4). Finalmente, para investigar si existe una correlación entre las subpoblaciones de LT CD8+ y la presencia del parásito en los PCC con diferentes estados de gravedad, se evaluó la parasitemia mediante PCR convencional y cuantitativa como se describe en materiales y métodos. Ambas PCR permitieron identificar 12 de 30 PCC (40%) con parasitemia detectable (7 PCC por PCR convencional y 9 PCC por PCR cuantitativa) (Tabla 4). Teniendo en cuenta la baja frecuencia de pacientes con parasitemia detectable no se realizó el análisis de correlación con las subpoblaciones de LT CD8+. Tabla 4. PCC con parasitemia detectable
PCR§ PCC
¶
A B C£ D
Convencional 2/10 0/7 4/9 1/4
Cuantitativa 3/10 1/7 5/9 0/4
Total 5 (50%) 1 (14,3%) 5 (55,6%) 1 (25%)
PCC, Pacientes con enfermedad de Chagas en fase crónica
§El blanco de amplificación de la PCR convencional y cuantitativa se describe en materiales y métodos. ¶Las características clínicas de los PCC están descritas en materiales y métodos.
8. DISCUSIÓN
La respuesta inmune celular del hospedero es crucial para el control de infecciones causadas por patógenos intracelulares. En la infección por T. cruzi, se ha descrito que los LT CD8+ juegan un papel importante en la infección aguda y crónica mediante la secreción de citoquinas y la actividad citotóxica (Tzelepis et al., 2006). Los LT CD8+ son un compartimento celular heterogéneo compuesto por subpoblaciones con diferentes grados de diferenciación y actividad funcional (Mahnke et al., 2013). Las subpoblaciones de LT CD8+ han sido ampliamente estudiadas en modelos de infección crónica causadas por virus, sin embargo, poco se conoce en infecciones causadas por protozoos intracelulares como T. cruzi. En el presente trabajo se realizó la comparación de las subpoblaciones de LT CD8+ totales y específicos de T. cruzi: TSCM,
TCM, TTM, TEM y TTE en cuanto a frecuencia y actividad funcional entre PCC con
diferentes estados de gravedad de la enfermedad. Análisis que contribuye a entender la inmunidad celular durante el desarrollo de la fase crónica y la patogénesis de la enfermedad de Chagas.
Nuestros hallazgos muestran que los pacientes con formas más graves de la enfermedad de Chagas presentan una menor frecuencia de LT CD8+ con estados tempranos de diferenciación. En estos pacientes no se detectó TSCM productores de
IFN-, TNF-α o IL-2. Con respecto a la actividad multifuncional, se observó que frente al estímulo policlonal, las células de los PCC tienen un comportamiento similar a las células de los CS en cuanto a la producción de 1, 2 o 3 citoquinas. En contraste, frente al estímulo con antígenos de T. cruzi, se observó pérdida de la multifuncionalidad en los estados más graves de la enfermedad. De hecho, los TCM, TEM y TTE de los pacientes
con estados más graves de la enfermedad llevan a cabo solo una función proporcionalmente distribuida entre las células productoras de IFN- y TNF-.
plantea la generación de LT de memoria con características similares a las células madre, el cual permite la generación de células efectoras encargadas de eliminar el antígeno (Ganusov, 2007; Restifo et al., 2013). Recientemente, los TSCM CD8+ fueron
identificados como una población temprana con una alta capacidad de autorenovación y proliferación, capaz de diferenciarse en las otras subpoblaciones de memoria como los TCM y TEM (Gattinoni et al., 2011).
Algunos modelos indican la importancia de los TSCM o con características similares en
el control de la infección y desarrollo tumoral. En un modelo murino de infección por Listeria monocytogenes se ha mostrado que la transferencia adoptiva de LT que
expresan altos niveles de CD127 contribuye al control de la infección ya que estas células promueven la generación de células efectoras que son responsables de eliminar la bacteria presente en el bazo e hígado (Kaech et al., 2003). Dado que los TSCM expresan altos niveles de CD127, así como otras moléculas asociadas a la
diferenciación temprana como CD45RA, CCR7, CD28 y CD27 (Gattinoni et al., 2011), se sugiere que estas células pueden estar implicadas en el control de patógenos intracelulares. De manera interesante, se ha propuesto la utilización de TSCM en
inmunoterapia para el tratamiento del cáncer debido a que en modelos murinos tumorales la transferencia adoptiva de estas células induce una mayor regresión del tumor comparado con la transferencia de TCM o TEM (Gattinoni et al., 2011).
La inmunidad protectora se ha asociado con la habilidad que tienen los LT CD8+ de memoria para sobrevivir por largos periodos de tiempo, evento relacionado con la expresión de altos niveles de moléculas anti-apoptóticas (Grayson et al., 2000), la capacidad de proliferar independiente del estímulo antigénico mediante citoquinas homeostáticas como IL-7 e IL-15 (Surh et al., 2008) y la rápida diferenciación a células efectoras. Los TSCM, se han descrito como una población de larga vida capaz de
de tiempo en presencia o ausencia del antígeno comparado con los TCM y TEM (Lugli et
al., 2013). Estos hallazgos sugieren un importante papel de los TSCM en el control de
infecciones crónicas, sin embargo, el papel de esta subpoblación celular en infecciones crónicas se desconoce.
En la infección crónica por T. cruzi se ha encontrado que pacientes con formas graves de la enfermedad de Chagas presentan una menor frecuencia de LT CD8+ con un estado de diferenciación temprano al comparar con pacientes con formas menos graves de la enfermedad (Albareda et al., 2006), sugiriendo que estas células podrían estar involucradas en el control de la progresión de la enfermedad. Sin embargo, la aproximación metodológica para determinar las subpoblaciones de LT CD8+ hasta el momento, solo ha permitido evaluar los TCM y TEM en modelos murinos (Bixby et al.,
2008; Bustamante et al., 2008) y humanos (Albareda et al., 2006; Lasso et al., 2010), pero no otras subpoblaciones como los TSCM. Este trabajo es el primer estudio de los
TSCM específicos de T. cruzi en PCC y si bien subpoblaciones como TCM y TEM se han
evaluado previamente, este estudio muestra el panorama completo de las subpoblaciones en los PCC con distintos estados de gravedad de la enfermedad. Los TSCM pueden representar la subpoblación celular que mantiene el pool de
progenitores que se requiere para mantener una respuesta frente al parásito, probablemente más eficientes que las otras subpoblaciones de memoria, ya que los TSCM comparados con los TCM, son capaces de generar TCM, TEM y TTE y estas
subpoblaciones no tienen la capacidad de diferenciarse en los TSCM (Gattinoni et al.,
2011; Lugli et al., 2013).
subpoblaciones de LT CD8+ permite evaluar la multifuncionalidad de acuerdo con lo descrito previamente (Seder et al., 2008).
En infecciones crónicas causadas por virus, la calidad de la respuesta de los LT CD8+ se ha asociado con el control de la progresión de la enfermedad (Seder et al., 2008). Así, se ha reportado que pacientes con infección crónica por el virus de inmunodeficiencia humana (VIH) que no progresan al síndrome de inmunodeficiencia adquirido (SIDA), tienen una alta frecuencia de LT CD8+ multifuncionales comparado con los pacientes con infección por el VIH que si progresan al SIDA, los cuales muestran una alta frecuencia de células monofuncionales (Betts et al., 2006). En la infección por el protozoo Leishmania major, la multifuncionalidad de los LT se ha propuesto como un correlato de protección, ya que en un modelo murino de infección se encontró que la actividad multifuncional de los LT especializados en la producción de IFN- y TNF-α se
asocia con menor tamaño de la lesión y menor parasitemia (Darrah et al., 2007). De acuerdo con estos resultados, en el presente trabajo se encontraron células productoras de 2 citoquinas como IFN- y TNF-α e pacie tes co fo as e os
graves de la enfermedad, sugiriendo que la producción conjugada de estas citoquinas podría evitar la progresión a las formas más graves de la enfermedad.
parásito es en su mayoría monofuncional con producción de IFN- y ausencia de células productoras de TNF-α (Albareda et al., 2013). En el presente trabajo se encontró que los PCC tienen LT CD8+ monofuncionales productores de IFN- o TNF-α. El papel de estas citoquinas en la patogenia de la enfermedad de Chagas es controversial, ya que en algunos estudios se reporta que los PCC con formas severas de la enfermedad muestran una alta frecuencia de células productoras de IFN- (J. A. Gomes et al., 2003) y de niveles de TNF-α en sangre (Talvani et al., 2004), sin embargo, otros estudios muestran lo contrario respecto de células productoras de IFN- (Laucella et al., 2004) y niveles sanguíneos de TNF-α (Pérez-Fuentes et al., 2003).
Uno de los aspectos importantes en la evaluación de la inmunidad en infecciones crónicas, es determinar si las alteraciones de la respuesta inmune se presentan solo en células específicas de antígeno o en general afectando diferentes clones linfoides. En pacientes con infección por el VIH se ha encontrado que el estado de diferenciación y la multifuncionalidad de LT CD8+ están alterados solo en células específicas para VIH pero no en células específicas para citomegalovirus (CMV) (Riou et al., 2012). En el presente trabajo, tanto en PCC como en CS, se encontró que las células estimuladas con SEB producen 1, 2 o 3 citoquinas, independiente del estado de diferenciación celular y del estado de gravedad de la enfermedad de los PCC. Previamente, se ha demostrado que los LT CD8+ de PCC son capaces de responder frente a un antígeno del virus de la influenza similar a lo observado en los CS (Lasso et al., 2012). Por lo tanto, estos hallazgos sugieren que los PCC no presentan una alteración de la actividad funcional generalizada frente a otros patógenos.
en la distribución de las subpoblaciones celulares en la enfermedad de Chagas. Debido a esto, en el presente trabajo se evaluó la parasitemia utilizando PCR convencional y PCR cuantitativa. Teniendo en cuenta que durante la infección crónica por T. cruzi la parasitemia es baja (Britto, 2009), en este trabajo se amplió la posibilidad de detectar el ADN circulante del parásito mediante el uso de las dos PCR, ya que utilizan blancos de amplificación diferentes, la región variable del minicírculo del ADNk (Sturm et al., 1989) y una región de ADN satélite de T. cruzi (Piron et al., 2007), respectivamente. Si bien, en nuestro caso se detectó ADN del parásito en sangre periférica en el 40% de los PCC, es de especial importancia resaltar que hubo detección incluso en pacientes con mayor estado de gravedad de la enfermedad. Además, teniendo en cuenta que el tropismo del parásito es a tejido cardiaco, existe una alta probabilidad de que inclusive en los pacientes en quienes no fue posible detectar el antígeno en sangre, lo presenten en el corazón (Marcon et al., 2011). De acuerdo con lo anterior, resultados de un estudio paralelo de nuestro grupo de investigación muestran que la pérdida de la multifuncionalidad en pacientes con formas graves de la enfermedad se asocia con el incremento de receptores inhibitorios en LT CD8+ de PCC (Manuscrito en preparación). Considerando estos hallazgos y la persistencia del parásito observada en los PCC, se propone que los LT CD8+ de PCC se encuentran en un proceso de agotamiento, lo cual puede contribuir a la progresión de la enfermedad y al desarrollo de la patología.
Teniendo en cuenta los resultados obtenidos en el presente trabajo se propone que un escenario posible para la infección por T. cruzi es que durante la infección aguda ocurre una intensa activación de la respuesta inmune que contribuye al control de la replicación del parásito. La persistencia del antígeno genera una activación constante de la inmunidad adaptativa que en algún momento conlleva a un desbalance de la respuesta inmune específica y progresión de la enfermedad a estados graves, donde hay pérdida de la población celular de progenitores tempranos (TSCM), aumento en la