Química General – Licenciatura en Biología Trabajo Práctico de Laboratorio N°: 4
GASES: DETERMINACIÓN DE LA MASA MOLAR DEL Mg
Objetivos: Determinar experimentalmente la masa molar de un metal aplicando las leyes de los gases ideales y la estequiometría de una reacción. Introducir los conceptos de error de medición, propagación de errores y su aplicación en la elección de instrumentos.
El magnesio reacciona con ácido clorhídrico produciendo cloruro de magnesio e hidrógeno gaseoso. La reacción ajustada es la siguiente:
( )s
HCl
( )acMg
Cl
( )sH
( ) ( )gMg
+
2
→
2+
2El práctico consiste en pesar una masa de Mg, hacerla reaccionar totalmente con HCl a temperatura constante y medir el volumen y la presión del gas hidrógeno desprendido, que se recoge sobre agua. El dispositivo usado para ello es el siguiente:
Considerando que el gas se comporta como ideal, podemos calcular la cantidad de H2 desprendido
conociendo la temperatura, presión y volumen.
T
R
n
V
P
H H2
2
=
El número de moles de hidrógeno es:
T
R
V
P
n
H H22
=
(1)La estequiometría de la reacción indica que se forma un mol de hidrógeno gaseoso por cada mol de Mg que reacciona.
n
H2=
n
Mg (2)Entonces podemos calcular el peso atómico del Mg y compararlo con tablas.
Mg Mg Mg
n
m
molar
Masa
=
(3)La masa de Mg se conoce pesando la cinta de Mg.
La temperatura es la del ambiente, se mide con un termómetro de laboratorio.
La presión parcial de hidrógeno se mide de manera indirecta. Sobre la superficie del agua del vaso de precipitado actúa la presión atmosférica que es igual a la presión que ejercen los gases y la columna de agua que se encuentran dentro de la bureta.
O H columna O vaporH H
atm
P
P
P
P
2 2
2
+
+
=
(4)Podemos medir la presión atmosférica con un barómetro; la presión de vapor de agua a la temperatura del experimento se saca de tablas (Handbook of Chemistry and Physics). Para conocer la presión de la columna de agua expresada en mm de Hg se mide su altura con una regla milimetrada, se la multiplica por la densidad del agua a esa T y se divide por la densidad del mercurio (13.6 g/cm3).
Hg O H O H columna O H columna
densidad
densidad
x
h
P
2 22
=
(5)De la ecuación (4) despejamos la PH2:
O H columna O vaporH atm
H
P
P
P
P
2 2
2
=
−
−
(6)Materiales:
Cinta de magnesio Alambre de cobre
Ácido clorhídrico concentrado
Vaso de precipitado de 500mL o 1000 mL Bureta de 50 mL
Pipeta volumétrica de 10 mL Soporte
Termómetro Regla milimetrada
Datos de laboratorio:
• Temperatura ambiente
• Presión atmosférica
• Presión de vapor de agua a la temperatura ambiente
Procedimiento:
• Pesar la cinta de Mg que provee el docente (mMg). • Colocar agua destilada en el vaso de precipitado
• Medir la temperatura del agua (T) con un termómetro.
• Averiguar la presión atmosférica (Patm). En toda medición anotar la mínima división de la escala.
• Buscar en tablas la PVapor H2O a la temperatura T.
• Determinar el volumen del extremo no graduado de la bureta. Con el robinete cerrado, agregar con una pipeta volumétrica 10,0 ml de agua destilada. Restar a estos 10,0 mL el volumen graduado llenado con agua en la bureta.
• Atar la cinta de Mg con un alambre de cobre al extremo superior de la bureta.
• Armar el dispositivo de la figura 1. Primero colocar en la bureta 10 mL de ClH concentrado y completar con agua hasta llenar totalmente la bureta (Figura 1 inicial). Introducir la cinta de Mg en el interior del tubo. Obstruyendo la entrada de aire con el dedo pulgar, dar vuelta la bureta e introducirla en un vaso de precipitados con agua, de manera que quede apoyada en el fondo del vaso de precipitado. Sujetar la bureta al soporte de hierro (Figura 1 final). Precaución:
previamente practique varias veces dar vuelta la bureta.
• Medir la altura de la columna de agua con una regla milimetrada
(
hcolumnaH2O)
• Calcular la masa molar de Mg en la hoja para entregar al docente.
Tratamiento de resultados: calculo de error. Discutir en grupo el concepto de error.
Considerando que la masa molar del Mg de tablas es el valor verdadero, se puede calcular el error relativo porcentual cometido con el valor obtenido del práctico.
100 .
. .
% x
tablas Mg at Peso
calculado Mg
at Peso tablas
Mg at Peso
Er PesoatómicoMg = −
Este error se debe a muchos factores (discutir cuáles) pero uno importante es la elección de los instrumentos de medición usados. En este práctico se midieron varias magnitudes, y todas ellas tienen un error de apreciación, que es la mínima división de la escala del instrumento de medición. El Er% de apreciación se calcula como:
100
% x
medido valor
n apreciació de
error n
apreciació de
Er =
Los errores de apreciación de magnitudes calculadas se propagan siguiendo ciertas reglas que dependen de la operación aritmética que se realiza. (TABLA 1)
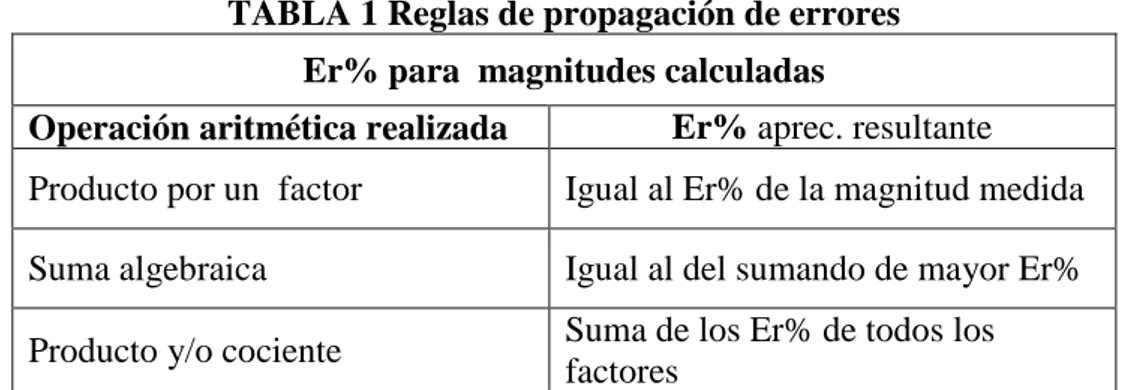
TABLA 1 Reglas de propagación de errores Er% para magnitudes calculadas
Operación aritmética realizada Er% aprec. resultante Producto por un factor Igual al Er% de la magnitud medida
Suma algebraica Igual al del sumando de mayor Er%
Hoja para entregar al Docente Apellido y nombre
Turno: Comisión Nro: Fecha:
A. Calculo de la masa molar de Mg
Calcular la presión de la columna de agua en mmHg (Pcolumna H2O ) con la ecuación (5).
Calcular la presión parcial del hidrógeno (P H2 ) con la ecuación (6).
Con las ecuaciones (1), (2) y (3) calcular la masa molar del Mg.
Calcular el error relativo porcentual cometido.
B. Propagación de errores
Completar la Tabla 2 con los valores medidos y calcule los errores de apreciación y los Er% de apreciación
TABLA 2: Magnitudes medidas Magnitud medida Valor medido Error de
apreciación
Er% de apreciación mMg
T VH2
Patm
Altura columna agua
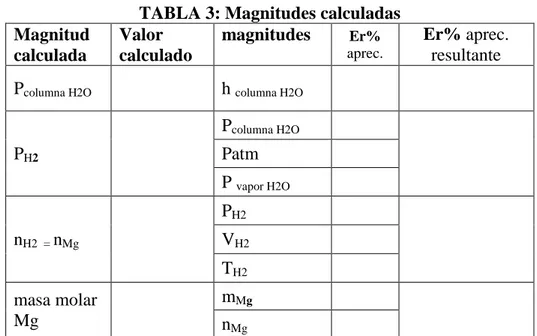
Considerando las reglas de propagación de errores completar la TABLA3
TABLA 3: Magnitudes calculadas Magnitud
calculada
Valor calculado
magnitudes Er%
aprec.
Er% aprec. resultante
Pcolumna H2O h columna H2O
PH2
Pcolumna H2O
Patm P vapor H2O
nH2 = nMg
PH2
VH2
TH2
masa molar Mg
mMg
nMg
Comparar el Er% de apreciación con el Er% calculado antes para la masa molar del Mg. ¿Porqué son diferentes?
Expresar el resultado final del experimento realizado incorporando el Er% calculado.
¿Cuál medición se podría mejorar para disminuir el Er% de apreciación?
¿Qué cuidados habría que tener para disminuir el error en general?
Universidad Nacional del Comahue Centro Regional Universitario Bariloche
Química General – Licenciatura en Biología Trabajo Práctico de Laboratorio N°: 5
TERMODINÁMICA: CALORIMETRÍA
Objetivo: Hallar el calor de reacción de una reacción de neutralización (entalpía de neutralización) utilizando un calorímetro a presión constante.
Materiales Calorímetro
Termómetro digital Baño termostático
Vaso de precipitado de vidrio de 100 mL Probeta de 50 o 100 mL
Cronómetro
Procedimiento
1- Hallar la constante del calorímetro.
Introducir en el calorímetro 40g de agua a temperatura ambiente, registrar la temperatura. Agregar otros 40 g de agua a una temperatura superior a los 60°C. Registrar los cambios de temperatura agitando ocasionalmente. Registrar la temperatura a los 10 minutos de mezclado.
Calorímetro construido empleando envase de espuma plástica solución
termómetro
varilla de vidrio para agitar
tapa
bulbo del termómetro sumergido en la solución)
Resultado experimental (ejemplo):
Qagua fría + Qcalorímetro + Qagua caliente = 0
Qagua = magua . cagua . (Tfinal –Tinicial)
Qcalorímetro = Ccal . (Tfinal –Tinicial)
Ccal = cte del calorímetro = mcalorímetro . ccalorímetro
2- Hallar el calor o entalpía de neutralización ∆Hºr.
Llenar el vaso del calorímetro con agua de la botella para homogeneizar la temperatura. Luego de unos minutos, introducir en el calorímetro 40 mL de solución 1,0 M de ácido clorhídrico. Registrar la temperatura. Verificar que se parta de la misma temperatura en las dos disoluciones. Agregar, con mucha precaución, 40 mL 1,0 M de hidróxido de sodio. Registrar la temperatura durante 10 minutos. Anotar la temperatura a los 10 minutos de realizada la mezcla. Para calcular el calor de neutralización estándar se utilizará la siguiente ecuación:
Qmezcla + Qcalorímetro + Qneutralización = 0
o
T ( C)
Apellido y nombre
Turno: Comisión Nro: Fecha:
1. Calcular la constante del calorímetro.
2- Hallar el calor o entalpía de neutralización.
3- Calor de dilución
Experimentalmente se comprueba que el calor de dilución que se produce al diluir 40 mL de HCl 1,0 M con 40 mL de NaOH 1,0 M (ambas soluciones se diluyen al doble del volumen inicial) es despreciable. Sin embargo, no siempre el calor de dilución es despreciable.