3
A L R E D E D O R
D E L
N Ú C L E O
A T Ó M I C O
N u b e e l e c t r ó n i c a
3- Alrededor del núcleo atómico
¿CUÁL ES LA ESTRUCTURA DEL ÁTOMO?
Desde el punto de vista químico, Dalton retoma las ideas de los atomis-tas griegos y pone de manifiesto la existencia del átomo a través de sus trabajos en 1803.
El estudio de la estructura del átomo es de fundamental importancia, ya que de ella dependen las propiedades de la materia que integra el Universo.
Hasta ahora sabemos que el átomo está constituido por protones carga-dos positivamente, neutrones sin carga y electrones con carga negativa. El paso siguiente
[image:2.595.253.406.343.477.2]es establecer como están distribuidas estas partículas en el interior del átomo. Explorar el interior del átomo es un camino lleno de obstáculos pero al mismo tiempo un desafío fascinante. Es como un viaje imaginario rumbo a lo des-conocido. Sobre la base de hechos experimentales, fáciles de observar, hay que averiguar su estructura interna. ¿Cómo examinar el interior del átomo si no lo po-demos ver ni tocar?. He aquí el gran desafío. Todo ocurre como si el átomo fuese una caja cerrada inviolable (“caja negra”) y nosotros queremos saber qué contie-ne. Sólo podemos aplicar ciertos estímulos a la caja y observar sus efectos como se muestra en la Figura 1.
Figura 1: Esquema de una caja negra a la que se le aplican ciertos estí-mulos y se observan las respuestas obtenidas.
De acuerdo con las respuestas obtenidas, queremos descubrir el contenido de la caja. Sobre esta base trabajaron eminentes científicos en los albores del siglo XX, realizando numerosas experiencias que condu-jeron a describir como se distribuyen las partículas subatómicas.
LA CIENCIA EN NUESTRA VIDA
♦
¿Qué es una caja negra?.
Una caja negra no es más que una representación esquemática de una pequeña parte del mundo, que sometemos a análisis. Por ejemplo, cuando efectua-mos una cuenta con una calculadora, sólo veefectua-mos el resultado en el visor sin saber que mecanismo utiliza la máquina para efectuar la operación. De este modo, la calcula-dora puede considerarse como una caja negra en la medida en que uno busque comprender el mecanismo que le permitió realizar dicha operación.
Cada especialista de un área determinada, profundiza en las cuestiones que le compete y así propone diversas cajas negras, de algunas de las cuales consigue información.
Un experimento puede considerarse de alguna manera como las obser-vaciones realizadas en una caja negra. Así por ejemplo, si tenemos una caja cerrada con un objeto suelto en el interior, es posible realizar algunas experiencias que nos permitan determinar el contenido de la caja. Podemos mover la caja suavemente, sacudirla o girarla y observar qué sucede con el movimiento o
¿HACIA DONDE VAMOS ?
En este capítulo nos ocuparemos de los distintos mode-los que permitieron establecer la rela-ción de las partícu-las subatómicas en el átomo.
?
estímulo respuesta
CAJA NEGRA
3- Alrededor del núcleo atómico el ruido que hace el objeto. En función de las observaciones efectuadas, se pueden hacer suposiciones acerca del contenido de la caja y tratar de comprobarlas median-te nuevas experiencias.
Los científicos realizan frecuentemente ciertos experimentos como si se tratara de una caja negra. En lugar de la caja utilizan desde tubos de ensayos hasta equipos sofisticados, donde colocan diversas sustancias para analizar. Luego observan que sucede, y tra-tan de explicar por qué.
♦
“El recolector de basura”
Todas las teorías y modelos científicos, incluido el modelo atómico, deben ser reflexivamente criticados, y los hechos en que se basan deben ser comprendidos. Una cosa es pre-guntarse ¿creemos en los átomos? como si fuera una cuestión de fe y otra muy distin-ta es ¿por qué creemos en los átomos? ¿Qué pruebas tenemos de su existencia?.
Veamos ahora un ejemplo que nos muestra como podemos sacar con-clusiones en la vida diaria. Nuestra historia ocurre en un pequeño pueblo como otros tantos.
Cierto día un vecino le dice al nuevo inquilino de la casa contigua, que el encargado de recoger la basura pasa todos los jueves por la mañana muy tempra-no. El inquilino, que es un científico, acepta la información del vecino, pero a su vez decide corroborarla por sí mismo.
Al cabo de unas semanas, el científico ha reunido un buen número de observaciones que con-firman la existencia de un recolector de basura que pasa los jueves. Quizá lo más importante es que la basura desaparece los jueves por la mañana. Además, recibe una factura para pagar este servicio.
Por otra parte, ha efectuado observaciones suplementarias. Por ejem-plo, frecuentemente a las cinco de la mañana de los días jueves, lo despierta un fuerte ruido y el trepidar de un camión. En ocasiones, el ruido va acompañado por un alegre silbido y por ladridos de perro.
El inquilino tiene ahora muchas razones para creer en la existencia del basurero, a pesar de que nunca lo ha visto. Pero como todo hombre de ciencia, es curioso y un miércoles por la noche prepara su despertador para que suene a las cinco de la mañana. Cuando suena el desperta-dor, se levanta, mira por la ventana y su primera impresión es que, debido a la oscuridad, le va a ser difí-cil ver algo. No obstante, consigue vislumbrar una sombra con la forma de un hombre cargando un objeto grande. ¡Ver es creer!. Pero, en realidad, ¿cuál de estos hechos permite “ver” al recolector de basura?. ¿cuál constituye una base para creer que existe?. La respuesta es que todos los hechos en conjunto supo-nen “ver” al basurero y forman la base para aceptar la teoría de su existencia.
La visión directa de una sombra a las cinco de la madrugada no supondr-ía ver a un basurero si al mismo tiempo no desapareciese la basura. La sombra podrsupondr-ía haber sido la del diariero, la del cartero, o la de cualquier otra persona. Tampoco el sólo hecho de la desaparición de la basura, indicaría ver al basurero; podría ser que algún perro que todos los jueves se coma la basura (re-cordemos que se oyen ladridos). Pero nuestro hombre queda convencido de que existe un recolector de basura, porque esta hipótesis concuerda con todas sus observaciones y ninguna de ellas la contradice.
Otras explicaciones posibles pueden concordar también con las observa-ciones, pero no tan perfectamente: por caso, el inquilino nunca pudo oír a un perro silbar.
La teoría de la existencia del basurero pasa por las pruebas de una bue-na teoría y resulta útil para explicar un gran número de observaciones experimentales, lo cual ya era cier-to independientemente de que viese la sombra. Sin embargo, hay que admitir que la visión directa tiene sus ventajas puesto que de este modo se puede obtener una información más detallada. De haber visto al basurero, el científico podría saber por ejemplo, si es alto, si tiene bigotes, o si es una mujer. Informacio-nes de este tipo son difíciles de obtener por métodos de observación indirecta.
Ahora les proponemos que traten de desempeñar, en algunos momentos del desarrollo de la asignatura, el papel del “nuevo inquilino”, para poder interpretar, los hechos que se apoyan en la información que el “vecino” les da.
El presente artículo está basado en CHEM, QUÍMICA Una ciencia experi-mental, Editorial Reverté 1987.
♦
La caja negra
Para identificar un objeto que no podemos ver ni tocar, sólo podemos realizar pruebas
3- Alrededor del núcleo atómico CONCLUSIONES
DE LA ACTIVIDAD 1
rectas como aplicar estímulos y observar los resultados. La experiencia que proponemos es investigar el contenido de una caja cerrada, para describir la naturaleza y las propiedades de los componentes que están en su interior. No podemos hacer observaciones directas acerca del contenido de la caja. Sólo po-demos realizar diversas manipulaciones sobre la caja que nos permitirán efectuar una serie de suposicio-nes para poder describir el material que contiene.
Ahora les proponemos formar pequeños grupos de trabajo para investi-gar el contenido de una caja cerrada, provista por el Profesor, para tratar de describir su contenido. Para ello, les sugerimos completar el cuadro, donde se muestran dos filas a manera de ejemplo, mediante los siguientes pasos:
Plantear una pregunta acerca del contenido de la caja.
Imaginar una experiencia que permita responder la pregunta. Por ejemplo, inclinar la caja suavemente, sacudirla, girarla, etc.
Realizar la experiencia y observar que sucede
Proponer una suposición que permita interpretar satisfactoriamente los resultados obtenidos.
Efectuar nuevas preguntas y repetir los pasos ante-riores.
Pregunta Experiencia Observación Suposición
Hay más de un objeto en la caja?.
Sacudir enérgicamente la caja
No se escucha el choque de objetos entre sí.
Hay un único objeto en la caja.
El objeto tiene forma cilíndrica?
Mover la caja suavemen-te.
El objeto se desliza, no rueda.
No tiene forma cilíndri-ca.
Sobre la base de las observaciones efectuadas, intenten crear un mode-lo que permita describir el objeto contenido en la caja.
El modelo debe estar de acuerdo con todos los hechos observados sin contradecir ninguna de las suposiciones efectuadas.
A los alumnos que tengan un gran espíritu de investigación, les sugeri-mos que coloquen en otra caja similar el objeto que creen que contiene la caja original y repitan la expe-riencia.
A diferencia de los investigadores, nosotros tenemos la ventaja que podemos abrir la caja y ob-servar su contenido, cosa que en general no pueden hacer los hombres de ciencia.
Luego, una vez creado el modelo, les proponemos que abran la caja y verifiquen si éste describe correctamente al objeto. ¡Qué sorpresa!.
Comparando nuestro modelo con la realidad, podemos decir:
Si la confrontación del modelo no coincide
con el objeto, significa que el modelo no es adecuado y habrá que seguir practicando.
Si el modelo describe parcialmente al objeto, el modelo es
limita-do y se podrían realizar nuevas experiencias para mejorarlo.
Si el modelo describe exactamente al objeto. ¡Felicitaciones!
3- Alrededor del núcleo atómico
BREVE RESEÑA HISTÓRICA
Hacia fines del siglo XIX la física clásica basada en la mecánica de
New-ton y en la teoría electromagnética de Maxwell, estaba sólidamente afianzada ya que se explicaba satis-factoriamente los fenómenos físicos. Sin embargo, en esa época y especialmente durante las tres primeras décadas del siglo XX, se produjeron hechos tan trascendentes e imprevisibles en el mundo científico, que conmovieron los cimientos de la física clásica. En efecto, experiencias tales como la electrólisis, la con-ducción eléctrica en gases a baja presión, la radiactividad y los fenómenos espectroquímicos, constitu-ron descubrimientos asombrosos. Los fenómenos se sucedían a un ritmo realmente vertiginoso.
Con el correr del tiempo, los científicos de la época se fueron dando cuenta de que el átomo no era una partícula tan simple como la imaginada por Dalton.
En noviembre de 1895, al estudiar las propiedades de los rayos catódi-cos, Wilhem K.Roentgen observó que al incidir un haz de electrones sobre las paredes de vidrio del tubo que utilizaba, se producía una radiación desconocida: los rayos X.
Al año siguiente, Henri Becquerel descubrió que las sales de uranio emitían espontáneamente ciertas radiaciones. Poco tiempo después, Marie Sklodowska Curie logró aislar el polonio y el radio que al igual que el uranio emitían radiaciones. Este fenómeno fue bautizado como
radiactividad.
En diciembre del año 1900, Max Planck, afirmó que para explicar los fenómenos relacionados con la emisión y la absorción de energía radiante por la materia, era necesario admitir que la energía debía ser emitida o absorbida en forma de minúsculos paquetes, que denominó
cuantos.
En 1904, J.J.Thomson propone el primer modelo atómico, imaginando al átomo como una esfera maciza cargada positivamente, en la cual se hallan incrustados los electrones. Experiencias posteriores hicieron que este modelo fuera desechado.
Un año después Albert Einstein, aplicando las ideas de Planck, logró explicar el fenómeno de la emisión de electrones producida por ciertas superficies metálicas irradiadas con luz visible o ultravioleta (efecto fotoeléctrico).
En 1911 Ernest Rutherford revolucionó la física atómica, al hacer inci-dir un haz de partículas alfa sobre una delgada lámina de oro, descubriendo que los átomos no eran com-pactos sino que en su mayor parte estaban vacíos. Entonces, propuso un modelo considerando al átomo como un sistema planetario en miniatura, con una diminuta región central cargada positivamente (núcleo) a cuyo alrededor giraban los electrones. Si bien este modelo descansaba en sólidas bases experimentales, entraba en flagrante contradicción con conceptos fundamentales de la física clásica.
En 1913, el danés Niels Bohr, aplicando las ideas de Planck y Einstein, consiguió interpretar satisfactoriamente el modelo atómico planetario. Para ello, supuso que los electro-nes seguían determinadas trayectorias circulares alrededor del núcleo, en las que no emitían ni absorbían energía. Lamentablemente, con el correr de los años se iba haciendo más claro que el modelo de Bohr, no lograba explicar algunas cuestiones atómicas conocidas.
Posteriormente, L de Broglie y W.Heisenberg demostraron que debía abandonarse la idea de que el electrón giraba en órbitas bien definidas, para concluir que se mueve al azar en una región del espacio alrededor del núcleo.
En 1926, el físico austríaco Erwin Schrodinger consigue describir ma-temáticamente el movimiento aleatorio del electrón. Nace así una nueva teoría para interpretar los fenó-menos atómicos: la mecánica cuántica. Esta teoría constituye el modelo más actualizado acerca de la estructura del átomo.
3- Alrededor del núcleo atómico En la Figura 2 indicamos algunas de las experiencias realizadas y los resultados obtenidos, que sirvieron de base para comprender la estructura atómica.
Figura 2: Esquema que representa al átomo como si fuera una caja negra. A la izquierda aparecen algunos de los estímulos suministrados, y a la derecha los resultados obtenidos.
En la Figura 2 puede apreciarse la complejidad del problema. Pero la tarea suprema de cualquier investigador no consiste en acumular hechos, sino en establecer vínculos entre los fenómenos y encontrar su causa. Es necesario crear un modelo que explique estos hechos.
QUÉ ES UN MODELO?
Un modelo no es más que un esquema, o una imagen que sintetiza la complejidad de las situaciones abordadas.
“Modelizar” es proporcionar una representación simple de situaciones complejas, mediante un modelo. Para cada situación existe una infinidad de modelos, siendo algunos más adecuados que otros. Partiendo de esta base, destacamos los modelos científicos, que han tenido éxito por que han sido eficaces para interpretar determinados fenómenos. No obstante, es de suma importancia comprender los límites que presentan los modelos para interpretar satisfactoriamente los hechos
experi-mentales.
♦
El modelo de Thomson
A principios del siglo XX, existían las ideas más variadas y a menudo fantásticas acerca de la estructura del átomo, que desembocaron en sucesivos mo-delos atómicos.
El primero de ellos y el más simple de todos fue propuesto por Joseph John Thomson en 1904, luego del descubrimiento del electrón.
Teniendo en cuenta que la masa de los electrones es mucho menor que la de los átomos, es lógico suponer que la mayor parte del átomo debe estar forma-da por partículas de mayor masa que la de los electrones. Además, debían estar cargadas positivamente, para neutralizar las cargas negativas de los electrones. Sobre esta base J.J, como lo llamaban sus discípulos, propuso su modelo mediante el siguiente enunciado:
El átomo es una esfera constituida por una gran masa de carga positiva distri-buida uniformemente, en cuyo interior se hallan inmersos al azar los electro-nes en número suficiente para neutralizar la carga positiva.
Por analogía, los colegas de Thomson lo llamaron el modelo del “budín de pasas”, donde los electrones incrustados en la masa positiva representan las pa-sas. En principio, el modelo resultó satisfactorio para explicar los hechos experi-mentales de la época. En efecto, las esferas atómicas de Thomson, podían ceder electrones, quedando así casi toda la masa atómica asociada a la carga positiva de la esfera. Esto explicaba que las partículas posi-tivas fueran mucho más pesadas que los electrones.
No obstante, otros hechos no pudieron ser explicados por el modelo de Thomson y hubo que desecharlo.
♦
Rutherford explora el interior del átomo
El descubrimiento de la radiactividad natural proporcionó a los
científi-?
electrones rayos X
ATOMO
radiación
electrones
Partículas alfa calor
Rayos ultravioletas
Partículas alfa
“EL BUDÍN DE PASAS”
3- Alrededor del núcleo atómico cos una nueva y eficaz herramienta para explorar la materia. Por ejemplo, las partículas alfa (α), que tienen gran masa, están cargadas positivamente y dotadas de gran energía. Están formadas por dos proto-nes y dos neutroproto-nes.
En 1911, Rutherford supuso que utilizando partículas α como proyecti-les para “bombardear” una delgada lámina metálica, podía conseguir información acerca de la estructura de los átomos que la componen.
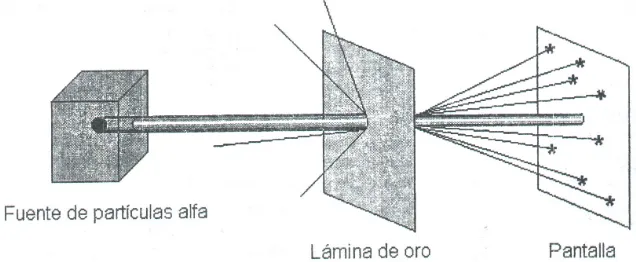
Así fue que el genial neocelandés y sus colaboradores Hans Geiger y Ernest Marsden, utilizaron una fuente emisora de partículas α, como el radio o el polonio, a la manera de un pequeño cañón atómico.
[image:7.595.186.411.224.323.2]En primer lugar, dispararon un haz de partículas α sobre una pantalla fluorescente de sulfuro de cinc y observaron, por los destellos producidos, que todas ellas quedaban loca-lizadas en una pequeña región de la pantalla. En la Figura 3 se muestra este hecho.
Figura 3: Las partículas alfa emitidas por la fuente radiactiva, viajan en línea recta, sin desviarse, como se comprueba por los impactos de ellas sobre la pantalla.
Luego, repitieron la experiencia interponiendo una delgada lámina de oro entre la fuente y la pantalla y observaron sobre ésta los impactos de las partículas α, como se muestra en la Figura 4.
Figura 4: Dispersión de las partículas alfa al incidir sobre una delgada lámina de oro.
Analizando los resultados obtenidos en la experiencia, Geiger y Marsden descubrieron lo siguiente:
La mayoría de las partículas αααα atraviesaban la lámina sin desviarse de su trayectoria.
Esto indicaba que el átomo tendría que ser en su mayor parte un espa-cio vacío, por el cual pasaban las partículas α sin obstáculo alguno.
Algunas partículas sufrían desviaciones en diferentes ángulos.
Puesto que los átomos de la lámina de oro tienen cargas positivas y las partículas α están cargadas positivamente, se debía ejercer una fuerte repulsión sobre éstas obligándolas a desviarse.
¡Una de cada 10.000 era rechazada!
[image:7.595.138.456.423.554.2]3- Alrededor del núcleo atómico masa muy grande y carga positiva, podría hacer rebotar a una partícula
α. Luego, concluyó que la mayor masa del átomo debía concentrarse en una pequeña región cargada positivamente. El resto del átomo debía estar vacío y por allí pasaban la mayoría de las partículas alfa sin desviar-se.
El experimento de Rutherford puso en claro que el modelo de un átomo macizo y uniforme como el presupuesto por Thomson debía ser abandonado. Si cada átomo de oro de la lámina, fuera una esfera con la carga positiva distribuida uniformemente, las partículas alfa de gran masa y energía no deberían experimentar grandes desviaciones a medida que atravesaran la lámina. Además, todas estas desviaciones deberían ser iguales. Estos hechos estaban en contradicción con lo observado en la experiencia de Rutherford.
Basándose en sus experiencias, y to-mando como analogía al sistema planetario, Rutherford propuso su mode-lo atómico que veremos en el párrafo siguiente.
♦
El modelo planetario.
Para explicar la experiencia efectuada con las partículas alfa, en 1911 Rutherford propuso un nuevo modelo atómico, sobre la base de las si-guientes suposiciones:
Casi toda la masa del átomo se concentra en una pequeña y densa región central cargada positivamente, llamada núcleo atómico.
Rodeando al núcleo y a distancias relativamente grandes, se encuentran los electrones moviéndose regularmente en órbitas circu-lares definidas, como lo hacen los planetas alrededor del sol.
El número de electrones presentes en el átomo es justo el ne-cesario para neutralizar la carga positiva del núcleo.
El átomo de Rutherford se parecía a un sistema planetario en miniatu-ra y por lo tanto la mayor parte estaba vacía.
De acuerdo con este modelo ahora explicar el experimento de Rutherford de la siguiente ma-nera.
Como el espacio entre el núcleo y los electrones es vacío, la mayoría de
las partículas α podían atravesar la lámina sin sufrir desviación alguna. Por otra parte, la probabilidad de que una partícula α pase muy cerca del núcleo o choque contra él es muy pequeña, pero cuando ello ocurre la partícula es desviada de su trayectoria o rechazada, debido a la repulsión de cargas de igual signo. Por último, la colisión de las partículas α con los electrones de los átomos de oro no tiene un efecto apreciable debido a la gran diferencia que hay entre sus masas. Estos hechos podemos apreciarlos en la Figura 5, donde representamos un átomo de oro, según la concepción de Rutherford “bombardeado” por partículas alfa.
Ernest Rutherford
Este genial científico neoce-landés, nació en 1871. En 1895 llegó a Inglaterra becado para trabajar en el famoso Laboratorio Cavendish de la Universidad de Cambridge,
bajo la dirección de
J.J.Thomson. En 1908 recibió el premio Nobel de Química por su trabajo con las partícu-las alfa. Sin embargo, su éxito más notable fue la teoría del átomo nuclear enunciada en 1911. Además, la comproba-ción de que las partículas alfa son núcleos de helio y la transmutación del nitrógeno en oxígeno, hicieron de Rut-herford uno de los más grandes físicos del siglo XX. Falleció en Cambridge en 1937, y fue enterrado en la abadía de Westminster, junto con los restos de Newton y Kelvin. Una distinción concedida sólo a los grandes de la ciencia.
“EL ÁTOMO VACÍO”
Una imagen del átomo planetario. La figura no está en escala.
part ículas alfa át omos de oro
3- Alrededor del núcleo atómico Si bien al modelo de Rutherford explicaba el experimento de dispersión de las partículas alfa, los científicos lo acogieron con mucha reserva debido a una objeción prácticamente insalvable. En efecto, de acuerdo con este modelo, los electrones debían girar alrededor del núcelo en órbitas definidas, tal cual lo hacen los planetas alrededor del sol. Pero, a diferencia de los planetas que son eléctricamente neutros, el electrón es una partícula con carga negativa y según la teoría electromagnética clásica, al girar alrededor del núcleo cargado positivamente, debe emitir energía en forma de radiación. Esta pérdida de energía haría que el electrón al ser atraído por el núcleo, cayese sobre él siguiendo una trayectoria en espiral. El modelo del átomo planetario se derrumbaba ya que entraba en flagrante contradicción con la realidad: la materia y por lo tanto los átomos que la componen son razonablemente estables.
Los científicos de la época se encontraron en una encrucijada: según la teoría electromagnética el modelo planetario debía descartarse, pero por otra parte, éste interpretaba correctamente los experimentos de dispersión de las partículas alfa.
Para salir de este atolladero hizo falta Niels Bohr. Sus trabajos se refieren esencialmente al comportamiento del electrón en el átomo, que veremos cuando estudiemos la nube electrónica.
EL TAMAÑO DE LOS ÁTOMOS
Si bien no hay un límite para las dimensiones del átomo, podemos supo-ner en forma convencional que es esférico. Partiendo de esa base, y mediante numerosas experiencias, pudo determinarse que el radio de los átomos es del orden de 10-10 m, es decir, el tamaño del átomo es muy pequeño, casi insignificante. Si por ejemplo, pudiéramos colocar diez millones de átomos de cobre uno tras otro, formarían una cadena cuya longitud no alcanzaría los 3mm.
Si tenemos en cuenta que el núcleo tiene un radio aproximado de 10-15 m, podemos comparar su radio con el del átomo efectuando la siguiente relación:
000
.
100
10
m
10
m
10
núcleo
r
átomo
r
5 15 10=
=
=
− −Esto indica que el radio del átomo a pesar de ser tan pequeño, es 100.000 veces mayor que el del núcleo. Para tener una idea más acabada de esta relación, si imaginamos que el núcleo de un átomo fuera del tamaño de una bolita de 1cm de radio, el átomo tendría un radio de 1 km.
Pero hay más aún: dado que casi toda la masa del átomo se concentra en un volumen tan reducido como el del núcleo, la densidad nuclear es enorme. En efecto, teniendo en cuenta que la masa de un protón es: 1.67 x 10-24 g y que ocupa un volumen de 7.24 x 10-39 cm3, podemos calcular la densidad del núcleo (δn ) del átomo de 1H:
3 14 3 39 24 n n
n
2
.
31
x
10
g
/
cm
cm
10
x
24
.
7
g
10
x
67
.
1
v
m
=
=
=
δ
− −este resultado nos indica que los núcleos atómicos son sumamente den-sos. Si pudiésemos llenar un cubo de 1cm de arista sólo con núcleos, éste pesaría ¡doscientos treinta y un millones de toneladas!.
1.
¿En qué basó Rutherford para afirmar que la mayor masa del átomo deb-ía concentrarse en una pequeña región del espacio y cargada positivamente?.2.
¿Por qué supuso que la mayor parte del átomo debía estar vacía?.3.
¿Cuántos electrones serían necesarios para obtener una masa de ungramo?.
4.
Sabiendo que el radio del átomo es del orden de 10-10 m y el del núcleo de 10-15 m y suponiendo que ambos son esféricos (Vesf =3 3 4
π
r
):a) comparar diámetros b) comparar volúmenes
Caída en espiral del electrón sobre el núcleo
“MANOS A LA “MANOS A LA “MANOS A LA “MANOS A LA
3- Alrededor del núcleo atómico c) discutir los resultados obtenidos
5.
El radio nuclear del átomo de hidrógeno es aproximadamente 1.20x10-15
m y el del núcleo de oro 6.98x10-15 m. Calcular:
a) la densidad del núcleo del átomo de hidrógeno
b) la densidad de un núcleo del oro, cuyo número de masa es 197 c) discutir los resultados.
6.
Un recipiente contiene 100cm3 de mercurio líquido, cuya densidad es 13.6 g/cm3. Calcular:a) la masa de mercurio contenida en el recipiente b) la masa de todos los electrones del mercurio del vaso c) la masa de todos sus núcleos
Datos: NA = 6.02x1023 mol-1 me = 9.10x10-31 kg.
HÁGASE LA LUZ
En el capítulo anterior hemos estudiado la composición del núcleo atómico. Ahora nos ocuparemos del comportamiento de los electrones alrededor del núcleo. Para ello, es conveniente analizar los hechos relacionados con la naturaleza de la luz ya que, el origen de toda radiación luminosa está íntimamente ligado al movimiento de los electrones en el interior del átomo.
En general, los sistemas materiales intercambian energía con el medio que los rodea. Esto podemos comprobarlo cuando calentamos un cuerpo por encima de los 500ºC. En estas condiciones, se pone de manifiesto la propiedad de los cuerpos de emitir energía en forma de radiación (energía radiante).
Así por ejemplo, si calentamos un trozo de metal, éste comienza a emi-tir una radiación que al principio percibimos en forma de calor. A medida que su temperatura aumenta, la radiación se torna visible de color rojo, pasando luego por el anaranjado, alcanzando un color blanco
brillante por encima de los 1500ºC.
Las lamparitas eléctricas consisten en una ampolla de vidrio que con-tiene un filamento de tungsteno y una mezcla de los gases nitrógeno y argón. Los gases con-tienen como fun-ción disminuir la vaporizafun-ción del filamento que se produce a esas temperaturas elevadas, prolongando la duración de la lamparita. Al circular corriente eléctrica a través del filamento conductor, se eleva su temperatura hasta que se pone incandescente (de 2500ºC a 3000ºC), emitiendo una radiación luminosa visible blanca.
Diariamente estamos en contacto con las radiaciones. Por ejemplo, cuando tomamos sol, miramos televisión, sintonizamos un aparato de radio o nos sacan una radiografía. Existe una amplia gama de radiaciones, de la cual sólo una pequeña parte impresiona nuestros ojos y po-demos ver, como si fuéramos ciegos a todo el resto. Las radiaciones visibles son la que conocemos como
luz.
QUÉ ES LA LUZ
Responder esta pregunta significa conocer la naturaleza de la luz y la forma en que se propaga. Para ello, es necesario disponer de una teoría que explique satisfactoriamente las propiedades de la luz.
Al propagarse por distintos medios materiales o al interaccionar con la materia en los procesos de emisión o absorción, la luz produce diversos fenómenos de características pe-culiares. Por ejemplo, la luz se refleja en superficies pulidas, y se propaga atravesando medios transpa-rentes como el aire, el vidrio o el agua. Estos hechos dieron origen a varias teorías que intentaron explicar las propiedades de la luz. A principio del siglo XVII aparece la teoría corpuscular (Newton), que luego fue reemplazada por la teoría ondulatoria.
ENERGÍA
3- Alrededor del núcleo atómico
LA TEORÍA ONDULATORIA
En 1678, Christian Huyggens, físico holandés, propone su teoría ondula-toria de la luz, considerando que es un fenómeno que se propaga en forma de ondas. Esta teoría interpretaba correctamente todos los fenómenos luminosos conocidos en la época.
Para comprender esta teoría, estudiaremos en qué consiste el movi-miento ondulatorio. Existen fenómenos en los cuales una partícula en movimovi-miento en un medio material, transmite su energía a las partículas que la rodean, confiriéndoles el movimiento. El fenómeno por el cual se propagan las vibraciones en un medio, constituye un movimiento ondulatorio y es representado median-te una onda.
Para aclarar este concepto, imaginemos que lanzamos una piedra sobre la superficie de un lago. A partir del punto en que cae la piedra, se forma una serie de ondulaciones concéntricas que se propagan por toda la superficie constituyendo un movimiento ondulatorio. La pertur-bación producida en ese punto, es transmitida a toda la zona mediante la transferencia de energía, pero sin transporte de materia. Esto podemos verificarlo colocando un objeto que flote sobre el agua; veríamos que este oscila verticalmente pero sin desplazarse. En otras palabras, las partículas de agua oscilan pero no se desplazan con la onda.
Resumiendo, los procesos ondulatorios tienen dos propiedades funda-mentales:
Se producen con transporte de energía No transportan materia
En general, se pueden distinguir dos tipos de onda: las mecánicas y las electromagnéticas. Las ondas mecánicas como las ondas de agua o las que se producen al pulsar una cuer-da, necesitan la presencia de un medio material para propagarse. En cambio, las ondas electromagnéticas como la luz, los rayos X, o las ondas de radio, no requieren de un medio para propagarse, ya que pueden hacerlo también en el vacío.
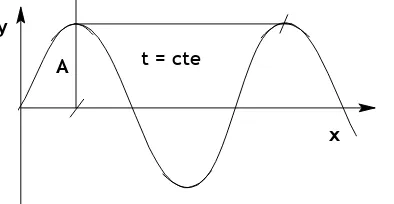
Las ondas se representan mediante funciones sinusoidales que depen-den del espacio y del tiempo. En la Figura 6 representamos una función sinusoidal en un tiempo determi-nado, como si fuera una fotografía.
t = cte
A
[image:11.595.197.394.437.539.2]x y
Figura 6: Representación de una onda en un instante, en función de la distancia a un punto determinado.
Las ondas se caracterizan por los siguientes elementos:
Amplitud (A) : es la máxima extensión vertical de la onda
Longitud de onda (λλλλ): es la distancia entre dos máximos sucesivos
de la onda, en un instante dado.
La unidad utilizada actualmente para medir la longitud de onda es el
nanómetro : 1nm = 10-9 m (ver Tabla 2 del apéndice del capítulo 1, página 36).
Frecuencia (νννν): es el número de oscilaciones completas (ciclos) de
la onda, por unidad de tiempo.
Se expresa en número de ciclos /segundo, o sea, en inversa de segundo (1/s). En el sistema SI, la unidad utilizada es el Hertz (Hz) que corresponde a la inversa de segundo (ver Tabla 3, apéndice del capítulo 1, página 36). Es decir:
1 Hz = 1/s = s-1.
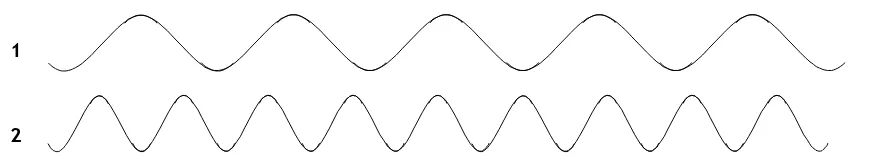
En la Figura 7 se representan en función del tiempo, dos ondas de la misma amplitud, pero diferente frecuencia:
3- Alrededor del núcleo atómico vp = λ x ν
c = 3.00 x 108 m/s
v = c/λ
1
[image:12.595.70.510.59.137.2]2
Figura 7: Representación en función del tiempo de dos ondas de igual amplitud. La onda 2 tiene mayor frecuencia que la onda 1.
Velocidad de propagación (vp): es el camino recorrido por un
pun-to determinado de la onda en la unidad del tiempo.
La velocidad de propagación de la onda está dada por el producto de su longitud de onda y su frecuencia.
(1)
La velocidad de la onda depende del medio material por el cual viaja; es decir, toma distintos valores según se propague en el vacío, en el agua, en el vidrio, etc.
♦
Las ondas luminosas
De acuerdo con la teoría ondulatoria, podemos considerar que la luz es
una perturbación que se propaga en forma de onda, por medio de la cual se trans-mite energía.
La luz puede propagarse a través de cualquier medio material transpa-rente (aire, agua, vidrio, etc.) e incluso en el vacío. La luz tiene tres características fundamentales, que pueden explicarse mediante una teoría ondulatoria:
Velocidad de propagación
La velocidad de propagación de la luz está dada por la velocidad de la onda y varía según el medio en que se propaga. La velocidad de la luz en el vacío (c), es una constante universal y su valor es:
Tomaremos este valor también para la velocidad de la luz en el aire ya que la diferencia es muy pequeña.
Para las ondas luminosas es vp = c. Luego, según la ecuación (1) es c = λ
x ν, de donde la frecuencia de la radiación luminosa es:
(2)
Intensidad
La intensidad luminosa queda determinada por la amplitud (A) de la onda. A
Color
Según la teoría ondulatoria cada color de la luz está caracterizado por una determinada frecuencia, que es la misma cualquiera sea el medio por el cual la luz se propague. Aho-ra bien, despejando de la ecuación (2) es λ = c/ν, y como c es la velocidad de la luz en el vacío, que es constante, podemos caracterizar cada color mediante su longitud de onda en el vacío.
♦
Las ondas electromagnéticas
Hasta aquí hemos descripto la luz como un fenómeno ondulatorio, pero, ¿cuál es la naturaleza?. La respuesta llegaría recién en el siglo XIX, de la mano de James C.Maxwell, quien en 1864 observó que la vibración de las cargas eléctricas de ciertos cuerpos como las antenas, generaban campos magnéticos y eléctricos que se propagaban en forma de ondas. Estas ondas electromagnéticas presenta-ban las mismas propiedades que las ondas luminosas y viajapresenta-ban en el vacío con la misma velocidad.
LA LUZ Y LAS ONDAS
EL ESPECTRO
3- Alrededor del núcleo atómico E = h x νννν
Luego, por analogía, Maxwell puso de manifiesto la naturaleza de la luz, afirmando que ésta se propaga en forma de ondas electromagnéticas.
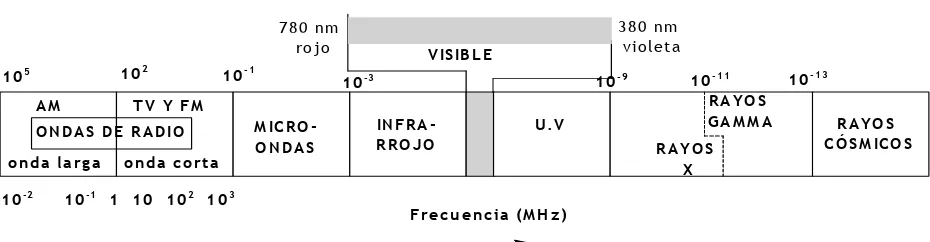
Esto puede generalizarse a todos los tipos de radiaciones conocidas, que componen un amplio espectro que va desde las ondas de radio hasta los rayos gamma e incluso los rayos cósmicos.
Todas estas radiaciones se propagan en el vacío a la velocidad de la luz, son de carácter electromagnético y se diferencian únicamente por sus longitudes de onda y por la forma en que se producen.
El conjunto de estas radiaciones constituye el denominado espectro electromagnético, que se muestra en la Figura 8. dentro de este espectro hay varios intervalos de radia-ciones que tienen nombres característicos. En particular, la luz comprende un estrecho rango de longitu-des de onda, denominado espectro visible, que corresponde a las radiaciones que pueden ser detectadas por el ojo humano.
O N D A S D E R A D IO A M T V Y F M
o n d a la rg a o n d a c o rta
M IC R O -O N D A S
IN F R A -R -R O J O
U .V
R A Y O S X
R A Y O S
G A M M A R A Y O S C Ó S M IC O S
1 0-2 1 0-1
1 1 0 1 02 1 03
V IS IB L E
78 0 n m ro jo
3 80 n m v io le ta
1 05 1 02 1 0- 1 1 0- 3 1 0-9
1 0- 1 1 1 0- 1 3
[image:13.595.72.537.248.369.2]F re c u e n c ia (M H z) L o n g itu d d e o n d a (n m )
Figura 8: El espectro electromagnético, ordenado según los valores crecientes de las frecuencias. Los límites marcados entre las distintas radiaciones no son precisos, en particular, entre los rayos X y los
rayos gamma.
LA TEORÍA FOTÓNICA
A pesar de sus logros, la teoría electromagnética clásica no fue suficien-te para explicar el fenómeno de la radiación emitida por ciertos cuerpos incandescen-tes. Todos los intentos de los científicos de fines de siglo XIX, habían fracasado. Así permaneció la situación, hasta que en 1900, Max Planck encontró la manera de resol-ver el problema.
Desde el punto de vista de la física clásica, se pensaba que la energía radiante era emitida por la materia en forma de flujo continuo. Sin embargo, para expli-car la emisión de la radiación térmica, Planck se vio obligado a postular:
La energía radiante es emitida o absorbida por la materia de manera discontinua en pequeñas porciones o paquetes de energía.
A estos paquetes de energía, Planck los denominó cuantos.
Para comprender mejor esta idea, imaginemos que la energía no es emitida en forma continua como sale el chorro de agua de una canilla, sino en forma intermitente como ocurre cuando la canilla gotea. Cada gota representa un cuanto. Así como la materia es de naturaleza discontinua ya que está constituida por átomos, la ra-diación también lo es, al ser emitida en forma de cuantos. Siguiendo esta línea de pen-samiento, decimos que la energía está cuantizada.
Teniendo en cuenta que la energía de la radiación aumenta con su fre-cuencia, Planck supuso que la energía de un cuanto es directamente proporcional a su frecuencia:
(3)
donde:
h es la constante de Planck, cuyo valor es: h= 6.63 x 10-34 J x s (joule multiplicado por segundo).
LLEGAN LOS
3- Alrededor del núcleo atómico
ν ν ν
νes la frecuencia de la radiación.
De acuerdo con esto, la energía solo puede emitirse en un número ente-ro de cuantos, es decir, en múltiplos de hνννν, como hνννν, 2hνννν, 3hνννν, etc. y no por ejemplo 1.5hv.
Cinco años después, Albert Einstein aplicó esta idea para explicar la emisión de electrones producidas por ciertas superficies metálicas irradiadas con luz visible o ultravioleta (efecto fotoeléctrico).
Entonces propone su teoría fotónica de la luz sobre la base de dos pos-tulados:
La luz está constituida por pequeñísimas partículas elementales
denominadas fotones, que se propagan a la velocidad de la luz.
La energía de cada fotón es la misma que la de un cuanto
Ef = h x νννν
Siendo νννν la frecuencia de la onda asociada al fotón. Además, como de la ecuación (2) νννν = c / λλλλ, resulta:
(4)
De esta forma, Einstein puso de manifiesto la naturaleza dual de la luz, asociando al fotón (características de partícula), una frecuencia (característica ondulatoria).
♦
Naturaleza dual de la luz
La explicación de ciertos fenómenos como los correspondientes a la óptica física, respecto a la propagación de la luz por distintos medios, pone en eviden-cia su comportamiento ondulatorio.
Sin embargo, en otros casos, como en la interacción de la luz con la materia, se hace imprescindible la presencia de los fotones luminosos.
Entonces, cabe preguntarse: ¿La luz es onda o partícula?. Lo que su-cede en realidad, es que lamentablemente no contamos con un modelo único satisfac-torio para explicar todos los fenómenos de la radiación. Las cosas son lo que son y la luz es lo que es.
Luego para entender la naturaleza de la luz es necesario conciliar el carácter dual de las radiaciones, como ondas y partículas en forma simultánea.
Debemos pensar que los comportamientos ondulatorios y corpuscu-lares, constituyen dos aspectos de una misma realidad, que se pone de manifiesto de distinta forma según el fenómeno que se produce.
Para comprender mejor este comportamiento imaginemos, por ejemplo, que tenemos un vaso de forma cilíndrica y lo miramos de frente. ¿Qué vemos?. La respuesta es un rectángulo. ¿Y si ahora lo miramos desde arriba?. En este caso vemos un círculo. Sin embargo, no deja de ser un vaso de forma cilíndrica.
Seguidamente analizaremos un fenómeno estrechamente vinculado con las radiaciones.
EL EFECTO INVERNADERO
Frecuentemente hemos oído hablar del efecto invernadero, como un fenómeno que tiene que ver con un aumento de la temperatura terrestre. Pero, en primer lugar, ¿sabemos realmente que es un invernadero?.
Un invernadero es un lugar cerrado con paneles de material te como vidrio o polietileno, donde se colocan las plantas para protegerlas del frío invernal. El material transparente deja pasar a la luz visible proveniente del sol, ca-lentando los objetos del interior que son esencialmente plantas.
Las plantas absorben el calor del sol y luego lo ceden en forma de ra-diación infrarroja. Aquí podríamos preguntarnos, ¿por qué infrarroja?. La respuesta es que al no estar a temperaturas elevadas, las plantas no tienen la energía suficiente
Ef = hc / λλλλ
?
vaso cilíndrico
EL EFECTO
3- Alrededor del núcleo atómico para emitir luz visible, pero sí infrarroja.
Al cabo de cierto tiempo se alcanza el equilibrio térmico, aunque a ma-yor temperatura que los objetos situados al aire libre. Esto se debe a que sólo una pequeña parte de la radiación infrarroja que emiten los objetos del interior del invernadero, logra atravesar el cristal de vidrio. El resto de la radiación se va acumulando en el interior elevando la temperatura del ambiente.
Este fenómeno por el cual la acumulación de radiación infrarroja au-menta la temperatura del interior del recinto, se conoce como efecto invernadero.
¿Tendrá que ver esto con la temperatura de la tierra?. Nuestro planeta recibe la radiación proveniente del sol, de la cual una buena parte es absorbida por la tierra y los océanos. La mayor parte de esa energía absorbida es emitida por la tierra como radiación infrarroja. Algunos de los gases presentes en la atmósfera como el vapor de agua, el metano y especialmente el dióxido de carbono, denominados gases de invernade-ro, absorben este tipo de radiación. En otras palabras, estos gases act-úan como el cristal del invernadero, impidiendo en consecuencia, que gran parte de la radiación infrarroja emitida abandone la superficie de la tierra. Esto causa el calentamiento global de nuestro planeta, afec-tando a las especies vegetales animales, pudiendo convertir tierras fértiles en desiertos, además de provocar el deshielo de los polos. De no tomarse medidas urgentes, es posible que al transformarse el hielo en agua líquida, ésta inunde las zonas costeras con las consecuencias perniciosas previsibles. Una de las zonas afectadas sería la Patagonia Ar-gentina.
LOS ESPECTROS
[image:15.595.74.497.500.635.2]Cuando un estrecho haz de luz blanca se hace incidir sobre un medio transparente como un prisma de vidrio, emerge descompuesto en sus colores cons-titutivos. Si a la salida del haz se coloca una pantalla, puede observarse en ella una gama continua de colores que va desde el rojo en un extremo hasta el violeta en el otro, como puede verse en la Figura 9.
Figura 9: Espectro de emisión continuo.
El proceso de emisión de descomposición de un haz luminoso en sus colores constitutivos se denomina dispersión y el conjunto de esos colores observados en la pantalla reci-be el nombre de espectro.
Este fenómeno se presenta en la naturaleza cuando se produce el arco iris, que es la dispersión que sufre la luz solar al atravesar zonas pobladas de pequeñas gotas de agua, suspendidas en la atmósfera.
Los espectros que se obtienen por la dispersión de la luz emitida por las sustancias, se denominan espectros de emisión. Pueden usarse para identificar a la sustancia emisora, de la misma manera que una persona puede ser identificada por sus huellas digitales.
Gases de invernadero
Vapor de agua
Es un componente natural del aire y se produce por los proce-sos de evaporación del agua líquida.
Metano
Se produce por la descomposi-ción anaeróbica de ciertas plan-tas y algas en aguas estancadas y en pantanos.
Dióxido de carbono
Es un componente natural del aire. Es producido por la respi-ración y por los procesos de combustión de materiales orgá-nicas.
AL COMPAS DE
LOS
3- Alrededor del núcleo atómico Los espectros producidos por átomos al estado gaseoso, que están cons-tituidos por líneas separadas entre sí, se denominan espectros de líneas. Son de particular interés, dado que suministran la mayor información acerca de la estructura del átomo. Por ejemplo, el espectro del átomo de hidrógeno presenta varias líneas en distintas regiones del espectro electromagnético, cuatro de las cuales están situadas en la zona visible.
EL MODELO PARA EL ÁTOMO DE HIDRÓGENO
Para establecer la estructura del átomo, en particular el movimiento de los electrones alrededor del núcleo, es necesario crear un modelo coherente con los hechos experimentales.
El modelo planetario de Rutherford, tan atractivo por su simpleza, se derrumbaba por su contradicción con la teoría electromagnética. Además, esta teoría resultó insuficiente para explicar los espectros de emisión atómica.
Corría el año 1913, cuando el danés Niels Bohr de 27 años, que trabaja-ba en el laboratorio de Rutherford, imaginó la manera de conciliar el modelo planetario con el hecho indiscutible que el átomo existe y es razonablemente estable. Así fue que encontró la clave:
“Es necesario admitir que el electrón en su movimiento no emite energía”, decía una y otra vez.
- ¡Pero contradice la teoría electromagnética!, le replicaban sus cole-gas.
- Sí, respondía Bohr.
- Entonces el electrón en su movimiento debe someterse a ella.
- ¡No!. “El átomo pese a todo, existe y es estable”, repetía continua-mente Bohr como única respuesta.
Entonces el joven danés lanzó su idea más audaz: “En el mundo atómi-co no rigen las leyes de la física clásica”.
Combinando las ideas cuánticas de Planck y Einstein con leyes de la físi-ca clásifísi-ca, propuso su nuevo y revolucionario modelo que explicó las líneas observadas en el espectro de emisión del átomo de hidrógeno.
Si bien este modelo ha sido superado por la teoría cuántica, lo estudia-remos como una transición para comprender esta teoría más compleja.
El modelo de Bohr para el átomo de hidrógeno, se basa en los dos postu-lados siguientes:
♦
Sobre las órbitas permitidas
El electrón sólo puede moverse en algunas órbitas circulares en las cuales no emite ni absorbe energía (órbitas permitidas).
Del análisis de este postulado surge que el electrón no puede circular por cualquier lugar del espacio que rodea al núcleo, sino describiendo algunas órbitas especiales en la cuales su energía es constante.
Del mismo modo que en una escalera sólo podemos estar parados en algún peldaño, el electrón sólo puede estar en las órbitas permitidas y no en los espa-cios intermedios entre ellas.
Cada órbita permitida, está caracterizada por un número natural n = 1; 2; 3; ...denominado número cuántico principal.
Bohr determinó el radio (rn) de cada una de esas órbitas, observando
que aumenta con n. La primera órbita (n = 1) es la de menor radio y por lo tanto la que está más cerca del núcleo.
Además, demostró que la energía del electrón (En) en cada una de las
órbitas es constante y puede calcularse por la fórmula :
(5)
NACE UN NUEVO PARADIGMA
Niels Bohr
Hijo de un profesor de fisiología de la Univer-sidad de Copenhague, el danés Niels Bohr nació el 7 de octubre de 1885. se doctoró en 1911 y estudió con el gran J.J.Thomson. En 1913 llegó al laboratorio de Rutherford, donde pu-blicó su teoría acerca de la estructura del átomo, mediante la cual predijo el color y el tipo de luz que producirían diversos materiales. En 1922, se le otorgó el premio No-bel de Física. Falleció en Copenhague en 1962.
POSTULADO 1
3- Alrededor del núcleo atómico Siendo K = 2.18 aJ/e (atojoule/electrón), y n el número cuántico prin-cipal correspondiente a la órbita.
Esta fórmula nos indica que la energía sólo puede tomar una serie de valores negativos. Así, reemplazando en (5) n por el número 1, obtenemos E1 = -
K que es el valor de la energía del electrón en la primera órbita. Haciendo lo propio para n = 2, obtenemos E2 = -k/4 que es la energía en la segunda órbita; para n=3, es E3 = k/9 que corresponde a la energía en la tercera órbita y así su-cesivamente.
Estos valores de la energía están representados en la Figura 10 y cons-tituyen los llamados niveles de energía del electrón en el átomo de hidrógeno.
A medida que crece el valor de n, aumenta el radio de la órbita y la energía (En) toma valores cada vez menos negativos, aproximándose a 0. Es de-cir, la energía del electrón aumenta a medida que éste se aleja del núcleo.
El electrón se encuentra normalmente en la primera órbita (n =1), que corresponde al nivel de menor energía (E1) y se denomina nivel fundamental. En este caso decimos que el átomo se halla en su estado fundamental. Los otros niveles de mayor energía, E2, E3, ..., que corresponden a órbitas superiores (n =
2; 3; ...), reciben el nombre de niveles excitados. Estas órbitas pueden ser ocupadas eventualmente por el electrón cuando recibe algún estímulo externo (calor, corriente eléctrica, etc.) que logra aumentarle su energía. Cuando el átomo se halla en esta situación, decimos que está en estado excitado.
La tortuga y la escalera
Imaginemos por un momento que nuestro electrón es una tortuga. Si la tortuga está situada en una rampa, puede tener cualquier altura respecto del piso y por lo tanto su energía potencial puede tomar cualquier valor. Su energía puede variar en forma continua a lo largo de la rampa.
Si en cambio, está en una escalera, su energía potencial sólo puede tomar determinados valores, correspondientes a las alturas de los escalones. Por con-siguiente, su energía puede variar en forma discontinua (de a saltos).
Se requiere energía para mover a la tortuga desde un escalón hacia otro superior. Es decir, la tortuga absorbe energía (proceso de absorción).
En cambio, si se mueve hacia un escalón inferior, libera energía (proce-so de emisión). En ambos ca(proce-sos, la tortuga ab(proce-sorbe o libera cantidades determinadas de energía. Decimos que la energía está cuantizada.
Análogamente, la energía del electrón del átomo de hidrógeno también está cuantizada es decir, sólo puede absorber o emitir energía en algunas cantidades determinadas.
♦
Sobre los saltos electrónicos
Para explicar la ubicación de las líneas espectrales observadas en el es-pectro de emisión del átomo de hidrógeno, Bohr debió recurrir a un segundo postu-lado referido a la emisión o absorción de energía:
El electrón sólo gana o pierde energía, cuando “salta” de una órbi-ta permitida a otra, absorbiendo o emitiendo un fotón. La energía del fotón (hνννν) es igual a la dife-rencia entre las energías del electrón en los estados inicial (Eνννν) y final (Ef):
(6)
Siendo h la constante de Planck y νννν la frecuencia de la onda asociada al fotón, que es propia del salto electrónico.
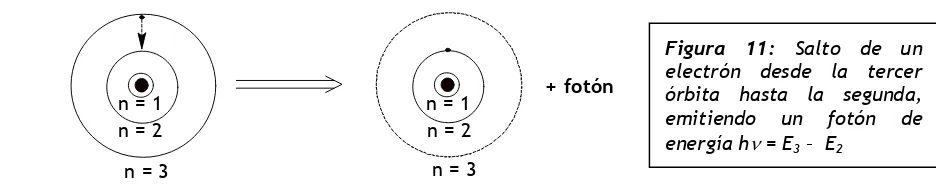
Cuando el átomo recibe un estímulo externo (luz, calor, energía eléctrica, etc.) el electrón absorbe energía, pasando de la primera órbita a una superior. Luego, cuando desaparece el estímulo pierde energ-ía y cae espontáneamente a una órbita más cercana al núcleo, emitiendo un fotón luminoso de energenerg-ía hνννν. Dado que el electrón pasa de una órbita de mayor energía a una de menor energía, Ei es mayor que Ef (Ei>Ef). Este proceso es de emisión y puede visualizarse en la Figura 11.
1 2 3 4
[image:17.595.58.540.316.604.2]∝
Figura 10: Diagra-ma de energía del electrón en el
áto-mo de hidrógeno.
UNA ANALOGÍA
POSTULADO 2
3- Alrededor del núcleo atómico Luego, según Bohr, en cada transición electrónica se emite un fotón de longitud de onda determinada, que impresiona la placa fotográfica originando una línea de espectro de emisión del átomo de hidrógeno.
La longitud de onda asociada al fotón emitido, puede determinarse teniendo en cuenta que νννν = c/λλλλ y reemplazando en la ecuación (6) resulta: h c/λλλλ = Ei – Ef.
Luego, despejando λ obtenemos:
(7)
mediante esta fórmula Bohr, calculó las longitudes de onda de los foto-nes emitidos en las transiciofoto-nes electrónicas, comprobando que coincidían con las obtenidas talmente en el espectro del átomo de hidrógeno. De esta manera, mediante su modelo, el danés pudo explicar satisfactoriamente las líneas que aparecen en dicho espectro.
7.
a) Utilizando la ecuación (5) calcular los valores de la energía del electrón en el átomo de hidrógeno correspondiente a los cinco primeros niveles: n = 1, 2, 3, 4, 5.b) con los resultados obtenidos, completar el siguiente gráfico, dibujando las líneas horizontales correspondientes a los cuatro primeros niveles excitados de energía.
n = 1
0,0 -0,1 -0,2 -0,3 -0,4 -0,5 -0,6 -0,7 -0,8 -0,9 -1,0 -1,1 -1,2 -1,3 -1,4 -1,5 -1,6 -1,7 -1,8 -1,9 -2,0 -2,1 -2,2 -2,3
E
n
e
rg
ía
(
a
J
/
e
)
c) Indicar en el gráfico, mediante flechas verticales, todas las transi-ciones electrónicas espontáneas posibles, suponiendo que están ocupadas las órbitas correspondientes a los primeros cuatro niveles excitados.
d) Deducir a partir del gráfico, para cuál de las transiciones el fotón emitido tiene mayor longitud de onda.
n = 3 n = 2 n = 1
n = 3 n = 2
n = 1 + fotón
Figura 11: Salto de un electrón desde la tercer órbita hasta la segunda, emitiendo un fotón de energía hν = E3 – E2
λ λ λ
λ = h c/ (Ei – Ef)
[image:18.595.82.550.63.157.2]3- Alrededor del núcleo atómico Del análisis de la actividad precedente, surgen las siguientes conclusio-nes:
Conforme va creciendo el valor de n, la energía toma valores cada
vez menos negativos, lo que indica que la energía del electrón aumenta a medida que éste se aleja del núcleo.
La separación entre los niveles de energía es cada vez menor. Hay diez transiciones espontáneas posibles, que corresponden a
caídas de electrones desde los niveles excitados hacia otros de menos energía.
El fotón de mayor longitud de onda, es el de menor frecuencia y
por lo tanto el de menor energía (E = hν), corresponde al salto más pequeño que es desde n=5 a n=4.
Ahora les proponemos resolver los siguientes problemas:
8.
Explicar cómo resolvió Bohr el dilema que presentaba el modelo plane-tario de Rutherford.9.
Dadas las siguientes afirmaciones indicar si son verdaderas o falsas, jus-tificando las respuestas.a) Cuando el electrón de un átomo de hidrógeno cae desde el tercer nivel energético al primero:
i) emite una radiación cuya longitud de onda es mayor que si cae desde el segundo al primero.
ii) emite un fotón cuya energía es 2hν
b) Cuando el electrón gira en la tercera órbita cede más energía que cuando gira en la primera.
10.
Efectuar un gráfico indicando todas las transiciones posibles correspon-dientes a las líneas espectrales del hidrógeno, si los electrones ocupan los cinco primeros niveles excita-dos.A continuación veremos como aplicando la teoría de los saltos electró-nicos, podemos explicar como funcionan muchos artefactos de iluminación.
LA CIENCIA EN NUESTRA VIDA
♦
El tubo fluorescente
En las casas, las oficinas, o los comercios, se utilizan frecuentemente artefactos de iluminación conocidos como tubos fluores-centes. Veamos en que consisten y como funcionan. Un tubo fluorescente consiste en una pieza de vidrio de forma cilíndrica, cuyas paredes internas están recubiertas por una sustancia fluorescente como por ejemplo silicato de calcio. En su interior contiene unas gotas de mercurio y una mezcla de los gases de neón y argón a baja presión, que facilitan el encendido. A la fuente de tungsteno cubiertos por metales alcalinotérreos (emisores de electrones).
Cuando se produce el encendido, los electrones son arrancados del fi-lamento y circulan por el interior del tubo. Allí chocan con los átomos de mercurio vaporizado, excitando sus electrones que pasan a niveles de mayor energía. Cuando vuelven a su estado inicial, liberan el exceso de energía emitiendo radiación ultravioleta. Esta radiación es absorbida por las sustancias fluorescentes de las paredes del tubo, que emiten a cambio, luz visible que observamos como luz blanca.
♦
La lámpara de vapor de sodio
Estas lámparas son cada vez más usadas para el alumbrado público. Consisten en una ampolla de vidrio revestido por cristal de boro. Contienen neón como gas de relleno y
CONCLUSIONES DE LA ACTIVIDAD 2
MANOS A LA OBRA
SE HIZO LA LUZ
3- Alrededor del núcleo atómico pequeñas cantidades de sodio. Los electrodos son de filamento de tungsteno grueso, que se conectan a la fuente de tensión.
Se requiere una tensión de encendido elevada (400 a 600V), para alcanzar una temperatura suficiente para vaporizar el sodio. Los electrones provenientes de los electrodos producen la promoción de los electrones del sodio que está en estado gaseoso, a niveles superiores. Cuando éstos vuelven a su estado inicial, liberan energía emitiendo luz amarilla de λ = 589 nm. Esta longitud de onda está muy próxima a la máxima sensibilidad del ojo, lo que convierte a esta lámpara en una de las más eficaces de las fuentes de luz.
♦
Las luces de Neón
El fenómeno de emisión de fotones que produce al gas neón es aprove-chado para la fabricación de los letreros luminosos que se observan en los frentes de muchos negocios. Se trata de tubos de descarga eléctrica que contienen gas neón a baja presión. Al producirse el “bombarde-ro” electrónico (la descarga eléctrica) sobre los átomos de neón, sus electrones pasan a niveles donde tienen mayor energía. Cuando estos electrones regresan a su estado inicial, emiten fotones luminosos una luz de color rojo brillante (luz de neón).
♦
El rayo láser
¿Quién no oyó hablar del rayo láser?. Suponemos que esta pregunta tiene una segura respuesta: nadie. Todo el mundo habla con total naturalidad de una impresora láser, de un puntero láser, o de un tratamiento láser. Pero, ¿de qué se ta?. ¿cómo funciona?. ¿En qué se aplica?. Estas últimas preguntas ya no tienen respues-ta clara. Aquí intenrespues-taremos dilucidarlas.
LASER es una sigla que proviene del inglés y significa Luz Ampliada por la emisión de radiación estimulada. En principio podemos decir que un aparato de rayo láser es un dispositivo que amplifica la luz originando un haz luminoso monocromático y coherente, de gran intensidad.
Una fuente de luz blanca produce ondas de muchas longitudes de onda diferentes que se propagan en distintas direcciones.
Si todas las ondas tienen la misma longitud de onda, la luz es cromática. Si, además, viajan en la misma dirección y en forma sincronizada, decimos que es coherente. En este caso los picos y los valles de las ondas coinciden (están en fase) y se refuerzan unas con otras, es decir, se amplifican.
Conjunto de ondas que tienen igual longitud de onda y se propagan en fase.
¿Cómo funciona?
El láser de rubí fue el primero en construirse (en 1960). El rubí está compuesto por un cristal de óxido de aluminio (Al2O3), con una pequeña proporción de óxido de cromo
(Cr2O3).
3- Alrededor del núcleo atómico Este láser consiste en una varilla de rubí, de longitud determinada, en cuyos extremos hay dos espejos planos paralelos, de modo que reflejan hacia el interior del cristal, uno de los cuales refleja parcialmente. Se sumi-nistra energía mediante un tubo de descarga de gas xenón (lámpara de des-tellos) que excita los electrones del cromo hasta un nivel de mayor energía. La caída espontánea de algunos de estos electrones al nivel fundamental, produce la emisión estimulada de una gran cantidad de fotones de la misma longitud de onda, que viajan en fase y se reflejan continuamente en los espejos. Así se genera un haz luminoso con la suficiente energía como para atravesar el espejo parcialmente reflectante, emergiendo del tubo como un destello rojo muy intenso cuya longitud de onda es 694nm. Es el rayo láser.
El rayo láser es la luz monocromática más intensa conocida.
Se conocen distintos tipo de láseres: sólidos como el de rubí, líquidos de colorantes orgánicos y gaseosos como el de Helio - Neón. También hay láseres de distinta potencia, que emiten radiaciones que van desde el infrarrojo hasta el ultravioleta.
¿En qué se aplica?
Las propiedades singulares del rayo láser como su gran energía y direc-ción , lo han hecho de múltiples aplicaciones en la industria, las comunicaciones, la informática y la medi-cina.
En la industria
Con un láser de potencia adecuada se puede soldar o perforar distintos materiales, e incluso realizar cortes perfectos en planchas de acero.
A diferencia de la luz ordinaria, el rayo de luz láser puede recorrer grandes distancias casi sin dispersarse. Por ejemplo el ancho de un haz luminoso a una distancia de 10km, es de unos 600m mientras que el de un rayo láser es sólo de 5cm. Esta propiedad ha sido aprovechada para medir distancias, alinear rutas y edificios o abrir túneles, con gran precisión.
También se ha utilizado el láser para fines bélicos, con el objeto de lograr mayor precisión en el blanco buscado.
En las comunicaciones
En las comunicaciones telefónicas, los cables de cobre están siendo reemplazados por las fibras ópticas. Están constituidas por un conjunto de hilos de vidrio transparente más fino que un cabello, a través de las cuales se transmite toda la información mediante un rayo láser.
Es muy conocida la utilización del láser en la reproducción de discos compactos, impresoras y fotocopiadoras, que se destacan por su gran definición.
En la medicina
El rayo láser es muy fino por lo que puede enfocarse fácilmente en su-perficies reducidas, propiedad que lo convierte en un instrumento fundamental de las técnicas quirúrgicas.
Las aplicaciones en la medicina son cada vez más numerosas. Se utiliza el láser como un verdadero bisturí que corta cauterizando y es totalmente asépti-co. Con el láser es posible soldar retinas desprendidas sin afectar los tejidos circundantes, efectuar opera-ciones de menisco, vesícula, etc.
Se emplea en quinesiología para el tratamiento de lesiones de diversa índole. Últimamente se lo ha aplicado con notable éxito en el tratamiento estético de cicatrices y várices.
En la actualidad contar con un método prácticamente indoloro, rápido, sin peligro de contaminación ni contagio alguno, hacen del láser una de las primeras opciones de aplica-ción terapéutica.
A pesar del éxito inicial de la teoría de Bohr, el inquieto átomo seguía mostrándose esquivo. El modelo fue insuficiente para explicar nuevos hechos experimentales. Una de las principales objeciones fue que sólo explicaba el espectro de emisión del átomo de hidrógeno y no los de los otros átomos.
No obstante, podemos considerar que el modelo de Bohr constituyó la base que permitió desarrollar la teoría atómica moderna.
Reflexión de los fotones en los espejos de un láser.