UNIVERSIDAD NACIONAL DE LA AMAZONÍA PERUANA
FACULTAD DE FARMACIA Y BIOQUÍMICA
PROYECTO DE TESIS
ACTIVIDAD ANTIBACTERIANA In Vitro DEL EXTRACTO ETANÓLICO DE LAS HOJAS DE Ruta graveolens (Ruda), MEDIANTE EL MÉTODO DE MACRODILUCIÓN FRENTE A Staphylococcus aureus y Escherichia coli.
PARA OPTAR EL TÍTULO PROFESIONAL DE QUÍMICO FARMACÉUTICO
PRESENTADO POR LOS BACHILLERES: Maita Vásquez, Jessica Jeaneth
Guerra Davila, Percy Jonathan
ASESOR:
Q.F. Luis D. Nonato Ramirez Dr.
CONTENIDO
1.2.1.8. Composición Fitoquímica y Propiedades Medicinales……… 13
1.2.1.9. Propiedades que presenta la Ruda………. 15
1.2.1.10. Reacciones Adversas y Advertencias……… 18
1.2.2. Características de las Cepas en Estudio………. 19
1.2.2.1. Staphylococcusaureus………. 19
1.2.2.1.1. Taxonomía……… 19
1.2.3. Ensayos Antimicrobianos………... 23
1.3. VARIABLES……… 27
2.1.1. Tipo de Investigación……….…... 31
2.1.2. Población y Muestra………...………..…. 32
2.1.2.1. Población Vegetal……….……..……. 32
2.1.2.3. Criterios de Inclusión………...………...….… 32
2.1.2.4. Criterios de Exclusión………..……… 32
2.1.2.5. Población Microbiológica………..…….. 32
2.1.2.6. Muestra Microbiológica………..……. 32
2.1.2.7. Criterios de Inclusión………... 32
2.4. PROCEDIMIENTO EXPERIMENTAL………...………... 36
2.4.1. Material Vegetal……..………... 36
2.4.2. Recolección dela Muestra Vegetal………..……. 36
2.4.3. Identificación de la Muestra Vegetal………..………..….. 36
2.4.4. Secado y Molienda de la Muestra Vegetal…………...……….. 36
2.4.5. Obtención del Extracto Etanolico………... 37
2.4.6. Tamisaje Fitoquimico………. 37
2.4.7. Prueba de Susceptibilidad y Acción Antibacteriana de los extractos por el método de Macrodilución……….……… 39
2.4.7.1. Concentración Mínima Inhibitoria (Método de Macrodilución)………. 40
2.4.7.2. Colocación del Inoculo en los Tubos………..…. 40
2.4.7.3. Incubación………...…... 40
2.4.7.4. Procedimiento y Lectura e Interpretación de la CIM………. 40
2.4.8. Procedimiento de los Ensayos de la Actividad Antibacteriana………... 42
2.4.8.1. Cepas Empleadas……….…… 42
2.4.8.2. Preparación de la Solución Madre………. 42
2.4.8.3. Preparación del Inoculo……….…….. 42 2.4.8.4. Preparación de la suspensión bacteriana y su aplicación en la prueba de macrodilución………..….... 42
2.4.8.5. Macrodilucion en Caldos (tubos)………...……….. 43
2.4.8.6. Ensayo de la Actividad Antibacteriana……….. 43
2.4.8.7. Preparación y Control de Extractos………... 43
2.4.8.8. Preparación del estándar (0.5 Mc Farland) para el inóculo…... 47
2.5. ANÁLISIS E INTERPRETACIÓN DE DATOS……….……... 48
CAPITULO III……….……...…… 49
3.1.RESULTADOS………. 50
3.1.1.Tamizaje Fitoquímico del Extracto Etanólico..………...…….…………... 50
3.1.2. Ensayo de concentración inhibitoria mínima (CIM)……….….... 51
3.2. DISCUSIÓN………..…...………….…………..……. 55
Figura 05: Procedimiento del Control del Método de Macrodilución en Caldo… 47 INDICE DE TABLA
Tabla 01: Resultados obtenidos del Tamizaje Fitoquímico del extracto
Etanolico de las hojas de Ruta graveolens
“Ruda”……….…….………...….. 50 Tabla 02: Clasificación de la actividad antibacteriana según la concentración inhibitoria mínima (CIM)………...………...… 51 Tabla 03: Resultados obtenidos en el ensayo de concentración inhibitoria mínima del extracto Etanólico de Ruta graveolens “Ruda”……...……...……. 51 INDICE DE IMAGENES
Imagen N° 01: Concentración inhibitoria mínima para Escherichia coli.... 52 Imagen N° 02: Concentración inhibitoria mínima para Staphylococcus aureus... 52 INDICE DE GRAFICOS
Gráfico 01: Gráfico de barras del CIM encontrado del extracto Etanólico de Ruta graveolens “Ruda” frente a las cepas en estudio....………..……... 53 Gráfico 02: Gráfico de barras del Control Positivo con Gentamicina frente a las bacterias en estudio de la concentración inhibitoria mínima del extracto Etanólico de Ruta graveolens “Ruda”………...……...……….... 54 INDICE DE ANEXO
ANEXO N° 01
Preparación del Agar Müeller Hinton……..………..………..……..…. 63 ANEXO N° 02
Recuperación de Cultivos Conservados……….……...….…. 64 ANEXO N° 03
Preparación del Estándar (0,5 mc. Farland) para el Inóculo……..….………. 65
ANEXO N° 04
Cuadro: Distribución del grupo control positivo por el método de macrodilución……….. 69 ANEXO N° 08
Datos de Pasaporte de Colección de Especies de las Plantas Medicinales en
Estudio………..………70
ANEXO N° 09
Constancia de la Muestra Botánica………..……..……….…….... 71 ANEXO N° 10
Imagen Satelital de la Ubicación de la Comunidad de Nina Rumi……...…. 72 ANEXO N° 11
1
DEDICATORIA
“A Dios del cielo, por guiarme y protegerme en mi camino”.
Tu señor Dios que desde tu reino nos cuidas y proteges, ilumíname
por un buen camino; Porque en los días de oscuridad me diste luz
y fuerza para continuar, brindándome salud para lograr y
seguir adelante mis objetivos.
A mi madre, luz marina Vásquez, por apoyarme en todo lo está en su alcance, por saber escucharme y aconsejarme en todo el trayecto
de mi formación.
A mi familia por estar presente en todo instante en mi vida, por compartir alegrías y percances.
Jessica Jeaneth Maita Vásquez.
2
AGRADECIMIENTOS
En el presente trabajo queremos agradecer a Dios por
bendecirnos para llegar a cumplir una de nuestras metas, ser profesionales. Gracias Señor Dios por brindarnos salud y conocimiento
Agradecer y hacer mención a las personas que nos apoyaron en el proceso de nuestra tesis y a los estuvieron con nosotros
apoyándonos, brindándonos consejos, enseñanzas, conocimientos, etc.
A nuestro asesor de tesis el Dr. Luis Nonato Ramírez por su esfuerzo y dedicación quien con sus conocimientos, su
experiencia, su paciencia y motivación nos apoyado en el desarrollo del presente proyecto de investigación.
También agradecemos a nuestros padres por darme la vida y apoyarme en todo momento y de toda la forma posible,
comprendiéndonos y teniéndonos paciencia; porque con sus esfuerzos hemos podido culminar este Proyecto de Investigación. De igual manera agradezco a nuestros hermanos por sus consejos y palabras de aliento que me dieron para superar los muchos obstáculos que hay en la vida.
Por último agradecemos a todos nuestros amigos que nos apoyaron de manera incondicional en cada etapa de nuestra vida.
“la educación es el mayor motor del desarrollo personal”
3
--- “ACTIVIDAD ANTIBACTERIANAIn Vitro DEL EXTRACTO ETANÓLICO DE
LAS HOJAS DE Ruta graveolens (Ruda), MEDIANTE EL MÉTODO DE MACRODILUCIÓN FRENTE A Staphylococcus aureus y Escherichia coli.”
Bachiller: Jessica Jeaneth, Maita Vasquez. Percy Jonathan, Guerra Davila.
RESUMEN
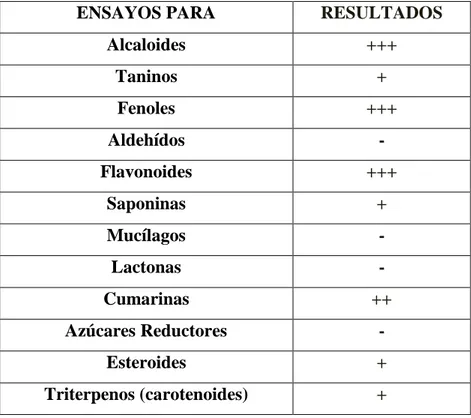
El objetivo de este estudio fue determinar la actividad antibacteriana in vitro del extracto etanólico de las hojas de Ruta graveolens “Ruda”, mediante el método de macrodilución frente a Staphylococcus aureus y Escherichia coli. Las hojas de Ruta graveolens “Ruda” fueron recolectadas en el centro poblado de la Comunidad de Nina Rumi (Carretera Zungarococha) estáubicado en la margen derecha del Rio Nanay a 25 kilómetros de la ciudad de Iquitos. Las bacterias utilizadas, Staphylococcusaureus ATCC 25923; Escherichia coli ATCC 25922, fueron proporcionados por el departamento de Microbiología de la Facultad de Industrias Alimentarias de la Universidad Nacional de la Amazonía Peruana. Las dosis del extracto fueron 32, 16, 8, 4, 2, 1, 0.5, 0.25 mg/ml, se utilizó como control positivo Gentamicina 160 mg/2ml. El estudio se realizó en el Laboratorio de Microbiología de la Facultad de Industrias Alimentarias de la Universidad Nacional de la Amazonía Peruana (UNAP). Del tamizaje fitoquímico realizado al extracto etanólico de las hojas de Ruta graveolens “Ruda”, se determinó la presencia de alcaloides, taninos, fenoles, flavonoides, saponinas, cumarinas, esteroides, triterpenos.
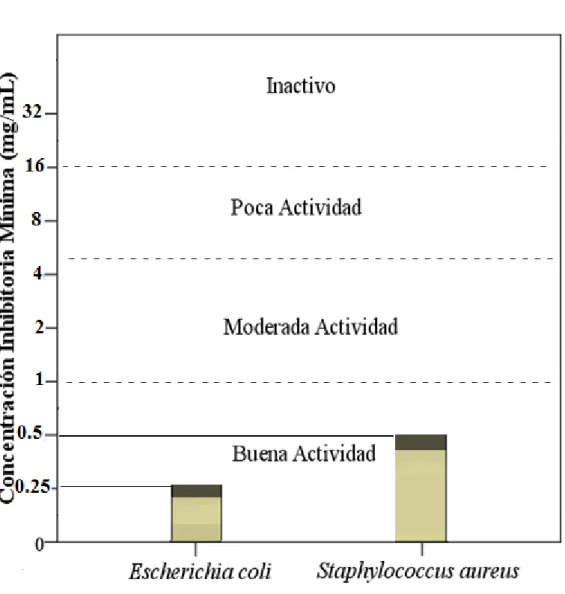
Con los resultados obtenidos se demostró que tiene buena actividad antibacteriana del extracto etanólico frente a las dos cepas estudiadas, obteniendo la concentración de 0.5 mg/ml para Staphylococcus aureus y 0.25 mg/ml para Escherichia coli.
5
4
---"In Vitro ANTIBACTERIAL ACTIVITY OF ETHANOL EXTRACT FROM LEAVES OF Ruta graveolens(Ruda), THROUGH THE FRONT
MACRODILUTION METHOD Staphylococcus aureus AND Escherichia coli."
Bachelor: Jessica Jeaneth, Maita Vasquez, Percy Jonathan, Guerra Davila.
ABSTRACT
The aim of this study was to determine the in vitro antibacterial activity of ethanol extract of the leaves of Ruta graveolens (Ruda), by macrodilution method against Staphylococcus aureus and Escherichia coli. The leaves of Ruta graveolens "Ruda" were collected from the population center of the Commonwealth of Nina Rumi (Highway Zungarococha) is located on the right bank of the Rio Nanay 25 kilometers from the city of Iquitos. The bacteria used, Staphylococcus aureus ATCC 25923; Escherichia coli ATCC 25922, were provided by the Department of Microbiology, Faculty of Food Industry National University of the Peruvian Amazon. Extract doses were 32, 16, 8, 4, 2, 1, 0.5, 0.25 mg/ml, was used as positive control gentamicin 160 mg/2ml. The study was conducted at the Laboratory of Microbiology, Faculty of Food Industry of the National University of the Peruvian Amazon (UNAP). Phytochemical screening of the ethanol extract made from the leaves of Ruta graveolens (Ruda), the presence of alkaloids, tannins, phenols, flavonoids, saponins, coumarins, steroids, triterpenes, are determined.
With the results obtained it was demonstrated that has good antibacterial activity of ethanol extract against the two strains tested, obtaining the concentration of 0.5 mg/ml for Staphylococcus aureus and 0.25 mg/ml for Escherichia coli.
5
INTRODUCCION.
La especie Ruta graveolens “Ruda”, posee innumerables estudios fármaco-toxicológicos a nivel internacional, pero aún las bases de datos y sistemas informativos están poco documentados al respecto. Con las nuevas investigaciones que existen sobre esta planta, se crean grandes posibilidades de obtener fitofármacos con acción antioxidante, antiinflamatoria, anticancerígena y antimicrobiana, entre otras, con menor potencial de efectos adversos1.
El aumento de la disponibilidad de agentes antibacterianos para el tratamiento de las enfermedades infecciosas en hospitales y en la comunidad, ha producido la aparición de resistencia de los microorganismos a los antibacterianos, siendo un problema mundial de salud pública generado en los últimos 50 años, debido principalmente al uso inapropiado de los antibióticos; porque con esto se favorece la multiplicación de microorganismos resistentes y, al mismo tiempo, la supresión de los susceptibles, haciendo más difícil el tratamiento de las infecciones que causan. Las consecuencias negativas se ven tanto en términos de salud como en el costo económico.1, 2
La incidencia anual de agentes antibacterianos es de 28,4 casos por cada 100.000 ingresos hospitalarios, la tasa de mortalidad de la infección invasiva Staphylococcus aureus es alta, variando entre el 19 y el 34%.3Escherichia coli es el agente causal más frecuente de las infecciones del tracto urinario extra hospitalarias con 63.5%, y el más frecuente en el medio hospitalario con 16.6%.3
Los microorganismos entéricos como Escherichia coli son causantes de una gran parte de morbilidad y mortalidad en los países en vías de desarrollo, como es el caso de nuestro país y más de nuestra región siendo afectada por estas clases de bacterias entéricas. Otro microorganismo como Staphylococcus aureus es el responsable del 50% de las infecciones intrahospitalarias registradas por el Instituto Nacional de Salud (INS). 4
6
difícilmente están disponibles los antibióticos de segunda línea, utilizados contra bacterias resistentes y por otro lado en los países desarrollados la emergencia de infecciones por bacterias multirresistentes tanto adquiridas intrahospitalariamente como en la comunidad ha sobrepasado a la aparición de nuevos antibióticos.5
A nivel mundial el 70% de las bacterias responsables de las infecciones nosocomiales son resistentes al menos a uno de los antibióticos más comúnmente utilizados para tratarlas. En el 2005 se reportó en los Estados Unidos a nivel de los centros hospitalarios, una incidencia de resistencia bacteriana del 3% por parte de enterobacterias productoras de beta-lactamasa de espectro extendido (BLEEs), como Escherichia coli y en comparación con Latinoamérica de un 9% - 62%. En Europa las bacterias Meticilino-resistentes como Staphylococcus aureus mostraron un 42% de resistencia en pacientes de la Unidad de Cuidados Intensivos (UCI), y 27% en pacientes de otras áreas de hospitalización, en comparación con los reportes de resistencia bacteriana en Latinoamérica del 35% y Estados unidos 25%-51%.5
En el Perú por medio de un estudio realizado a pacientes ambulatorios del Hospital Daniel Alcides Carrión con infección del tracto urinario adquiridas en la comunidad, se reportó que Staphylococcus aureus representa un 100% de resistencia a penicilinas. En el mismo estudio se reportaron, resistencias de 48%, 58% y 31% para Oxacilina, Eritromicina, Ciprofloxacino respectivamente. En la ciudad de Iquitos se reportó 11.8% y 33.3% para fármacos Cotrimoxazol y Tetraciclina respectivamente, fármacos como Cloranfenicol y Gentamicina aún pueden ser considerados para su empleo por la menor resistencia encontrada con 33%. 6
7
OBJETIVOS
GENERAL:
Determinar la actividad antibacteriana in vitro del extracto etanólico de las hojas de Ruta graveolens “Ruda”, mediante el método de macrodilución frente a Staphylococcus aureusyEscherichia coli.
ESPECIFICOS:
Obtener el extracto etanólico de las hojas de Ruta graveolens “Ruda”.
Realizar el tamizaje fitoquímico de las hojas de Ruta graveolens “Ruda”.
Evaluarla Concentración Inhibitoria Mínima (CMI) del extracto etanólico de las hojas de Ruta graveolens “Ruda”frente Staphylococcus aureus mediante el método de macrodilución.
Evaluar la Concentración MínimaInhibitoria (CMI) del extracto etanólico de las hojas de Ruta graveolens “Ruda” frente Escherichia coli, mediante el método de macrodilución.
9
1.1. MARCO REFERENCIAL
1.1.1. ANTECEDENTES:
Bayoud (2007), encontró que el extracto etanólico de la hoja de Ruta graveolens a una concentración de 10mg/ml, presentó actividad antimicrobiana contra Pseudomona aeruginosa con un resultado de un halo de 9mm.8
Lujan col.2007, demostró la actividad antimicrobiana de los extractos etanólicos de Ruda (Ruta graveolens),Tomillo (Thymus vulgaris), Perejil (Petroselinum sativums),contra cepas hospitalarias con resistencia múltiple a Staphylococcus aureus, los extracto se maceraron en alcohol de 70 grados, las pruebas de susceptibilidad lo realizaron de acuerdo con las recomendaciones de la NCCLS, también detectaron la presencia de omega 3 y 6, donde concluyen que los responsables de la actividad bactericida son timol, carvacrol y eugenol (ejemplo).9
Alonso J., Helsinki (2004), demostró que extractos alcohólicos de Ruta graveolens presentaron efecto inhibidor del crecimiento in vitro de los hongos Epidermophyton floccosum, Trichophyton rubrum y T. mentagrophytes; y efecto bacteriostático frente a Micrococcus pyogenes var. aureusy Escherichia coli. Sobre Pseudomonas aeruginosa demostraron efectos inhibitorios a dosis de 25 mg/mL. El mismo resultado observaron sobre Bacillus subtilis y Staphylococcus aureus en dosis de 12,5 mg/mL. También demostraron que el extracto acuoso de Ruta graveolens tiene actividad inhibitoria in vitro frente a Erwinia amylovora, E. carotovora, Pseudomonas syringae y Xanthomonas campestris. Asimismo, revelaron propiedades sobre Culex quinquefasciatus y repelentes frente a Popillia japónica.10
Naveda G. (2010), Demostró que el extracto etanolico de Ruta graveolens (Ruda), presentó concentración mínima inhibitoria (CMI) de 22,85 mg/ml. Staphylococcus aureusfue la cepa más sensible, seguida por Pseudomona aeruginosa.11
10
Amoxicilina y Gentamicina. La CMI de los extractos crudos mostraron entre uno a dos logaritmos por debajo de las CMI de los antibióticos. 11
K. Meepagala K. et.al (2005), K. SCHRADER, D. WEDGE, A. IVANOVA,I. KOSTOVA,J. VILLEGAS, J. MORTON Evaluaron que los aceites ensayados de Ruta graveolens presentaron un amplio rango de actividad tanto para bacterias Gram positivas (S. aureus y E. faecalis) como Gram negativas (E. coli y K. pneumonie). Analizaron los datos obtenidos en este ensayo y pudieron observar que la muestra IMinhibió un total de cuatro bacterias, exhibiendo una CIM de 100 μg/ml para S. aureus(7mm) y 200 μg/mL para E. faecalis(8mm), E. coli(9mm) y K pneumonie (7 mm); mientras que la ME mostró actividad contra S. aureus (8mm), E. coli (9 mm) y K. pneumonie (8 mm) a una CIM de 200 μg/ml para cada bacteria.3
Pokorny et al. (2005). Afirmó que los compuestos fenólicos identificados en varias especies vegetales, poseen actividad antibacteriana frente a un cierto número de bacterias Gram positivas y Gram negativas, además inhiben el crecimiento de microorganismos psicrotofros, coliformes fecales. En un intento para estimular el uso de antimicrobianos de origen natural, muchos autores han investigado la actividad antibacteriana de los compuestos fenólicos en varias especies vegetales, de las cuales Pokorny et al., confirmo y demostró que poseen actividad antibacteriana.12
11
naturalizada y cultivada en diversas partes del mundo. En América se la encuentra en Canadá, Estados Unidos, México, Bolivia, Brasil, Colombia, Ecuador, Perú y Chile. 131.2.1.2. Descripción botánica
La Ruda es una planta resistente, perenne y arbustiva que mide desde 50 hasta 100 cm. de altura. Esta provista de una raíz leñosa, fasciculada y de tallos cilíndricos, diámetro y están agrupados en ramilletes terminales. La flor central tiene 5 pétalos y 5 sépalos, mientras que las restantes tienen 4 pétalos y 4 sépalos. Los pétalos son cóncavos y dentados. 15, 16
El fruto es una capsula redondeada que contiene semillas de color negro con forma arriñonada.15
1.2.1.3.Partes Usadas Medicinalmente:
12
1.2.1.4.Descripción Taxonómica:
La Ruda pertenece a la Familia de las Rutáceas que comprende 161 géneros y más de 1600 especies cosmopolitas que van desde pequeñas “matas” hasta arbustos y árboles. El género Ruta incluya siete especies de arbustos aromáticos. 17, 4
Esta familia agrupa gran cantidad de plantas útiles en medicina, puesto que son ricas en aceites esenciales, alcaloides, glucósidos.17, 4
1.2.1.5.Clasificación Taxonómica:
1.2.1.7. Cultivo de Ruta graveolens “Ruda”
13
1.2.1.7.1. Cosecha
La Ruda florece entre los meses de mayo y agosto. La etapa correcta de recolección depende de la parte de la planta que se requiera usar. Si se necesitan hojas, tallos o flores se debe recolectar al principio de la floración, en estado de botón, puesto que es en este periodo cuando más principios activos poseen. Si se necesitan solo hojas y tallos, es mejor hacer la recolección antes de la floración, dado que en esta etapa los principios activos están concentrados en la savia. La cosecha se realiza con un corte de 12 a 15 cm. del suelo. 11
1.2.1.7.2. Post-Cosecha de las Hojas.:
a. Limpieza y esterilización:
Primero se someten a una clasificación por tamaño, seleccionando los de mejor desarrollo y uniformidad, eliminando las hojas en mal estado. Posteriormente se lava para eliminar la tierra, se esteriliza con agua hervida durante unos 15 minutos.14
b. Desecado:
Las hojas son extendidas para facilitar el secado, que puede ser natural (varios días al sol) o mecánico. 14
c. Molienda:
Es un proceso industrial. Se utilizan baterías de molinos en serie hasta obtener un polvo impalpable.16
1.2.1.8. Composición Fitoquímica y Propiedades Medicinales.
a. Composición fitoquímica
14
bergapteno, psoraleno, dafnoretina, isoimperatorina, escopoletina, umbeliferona, pangelina, etc. 18,19
Alcaloides furoquinólicos: Arborinina, arborotina, rutamina, graveolina, graveolinina, 6-metoxidictamina, furoquinolina, t-fagarina, gammafagarina, kokusaginina, skimianina, cocusaginina, rutacridona, metilacridona, dictamnina, isogravacridonclorina (furanocridona).18, 19
Flavonoides: Rutina (1-2%), quercetina. 18, 19
Otros: Resina, goma, ácido ascórbico, ácido málico, taninos, lignanos (raíz), sustancias amargas, glucósidos solubles en agua (sinapoil-6-feruloilsucrosa, metilcnidiósido, metilpicraquasiósido A, 3¢, 6¢-disinapoilsucrosa, cnidiósido A, picraquasiósido A, etc.), naftoherniarina, suberona e isorutarina, xantoxina, rutamarina e isopimpenelina.18, 19
b. Propiedades Medicinales:
A la Ruda se le atribuyen propiedades antiespasmódicas, sudoríficas, rubefacientes, antiparasitarias, hipotensoras, sedantes, alelopáticas, citotóxicas, antisépticas, emenagogas, venotónicas y vasoprotectoras.16, 18
En la Amazonía brasileña se le reconocen propiedades sedantes, antiasmáticas y analgésicas. 18, 19
c. Usos
15
En patologías externas, la Ruda se utiliza para el vitiligio, la sarna, el reumatismo, los golpes, la ciática, el dolor de oído. También, aplicada en la cabeza para evitar la caída del cabello, antipirético y aplicada en el pecho es eficaz contra la bronquitis crónica.14, 17
Sin embargo, varios autores concuerdan que es una planta, cuya dosis debe ser aplicada con sumo cuidado, puesto que si supera los valores permitidos, puede resultar toxica y provocar dolor de estómago, de cabeza, vómito, diarrea, hemorragias, aborto y lesiones en la piel al contacto con la planta. Por ello, su uso está contraindicado en casos de dermatosis, embarazo, prostatitis y gastroenteritis.17
d. Administración Tópica
El aceite se usa externamente en fricciones sobre zonas dolorosas: luxaciones; como también en procesos dermatológicos: eczema, psoriasis (recordar que las furocumarinas son fotosensibilizantes), lesiones óseas y antiinflamatorio. Infusiones o champús son utilizados contra la pediculosis y sarna.18, 19
1.2.1.9.Propiedades que Presenta la Ruda.
A. Bloqueador de canales de potasio
A nivel neurológico, algunos componentes de la Ruta graveolens han demostrado ejercer una acción bloqueadora de los canales de potasio, lo que abre las puertas de una eventual investigación en el tratamiento de la esclerosis múltiple. Sobre el atrio aislado de ratas, la Ruta graveolens ha demostrado efectos inotrópico y cronotrópico positivos.18
B. Actividad venotónica:
16
vitamínico P. La rutina en conjunto con troxerrutina han mostrado ser buenos agentes flebotónicos, aunque menos potentes que la escina.10
Dicho reforzamiento venotónico evita la liberación de enzimas tóxicas liberadas por los lisosomas de la célula muscular de la pared venosa durante situaciones de anoxia e inflamación tisular. Por otra parte disminuyen la permeabilidad de los capilares, aumentando su resistencia a través de una acción a-adrenérgica. Esta acción es potenciada por la escina. También protegen el sustrato extracelular, evitando la degradación de los proteoglicanos. Además permite distribuir correcta y adecuadamente el colágeno, de ahí sus nuevas aplicaciones dentro del campo de la Mesoterapia. Las altas dosis de troxerrutina (3 gr), equivalentes a 400 mg de benzopirona, han resultado útiles en la reabsorción de edemas linfáticos. Se destaca la troxerrutina pues mejora la microcirculación en todas las afecciones vasculares con compromiso distal, como por ejemplo la diabetes, favoreciendo el paso de los eritrocitos a nivel capilar, mejorando así la oxigenación tisular.10,18
C. Antiinflamatorio, antihistamínica y antiespasmódica
La arborina presenta actividad antihistamínica, antiespasmódica y antiinflamatoria. En ratas, el extracto de Ruta graveolens demostró efecto antinociceptivo, de manera dosis-dependiente.10,18
Contiene ácido octadecatrienoico 9,12,15 metil éster (ácido linoleico) conocido como omega 6 y del ácido octadecadienoico 9,12 metil éster (ácido α linolenico) conocido como omega 3, ambos compuestos son ampliamente conocidos por sus propiedades como antioxidantes, es decir tienen una amplia capacidad para atrapar radicales libres causantes del estrés oxidativo lo cual les atribuye un efecto beneficioso en la prevención de padecimiento tales como enfermedades cardiovasculares, circulatorias, cancerígenas y neurológicas, también poseen actividades antiinflamatorias, antialérgicas, antitrombóticas, antimicrobianas y antineoplásicas.19
D. Psoriasis
17
E. Efecto sobre la movilidad de los espermatozoides
Un extracto acuoso liofilizado de Ruda (Ruta graveolens) ha mostrado un efecto inhibidor, in vitro, sobre la movilidad de espermatozoides humanos.Tras el tratamiento de muestras de semen humano, obtenidas de una Clínica de Fertilidad, se observó un efecto concentración-dependiente e inmediato de inmovilización en los espermatozoides. A la concentración de 10 mg/ml este efecto se producía en el 100% de los espermatozoides (106 por muestra de semen). Además, éstos permanecían vivos y tras ser lavados recuperaban la motilidad. Los autores discuten el posible mecanismo de acción por un efecto bloqueante de los canales de potasio, relacionados con la movilidad de esperma, y que podría estar relacionado con la presencia de cumarina en el extracto.20
F. Anticonceptiva.
Estudios previos realizados al extracto acuoso de Ruta graveolensreportaron actividad anticonceptiva observándose que interfiere en el sistema reproductivo, alterando el nivel hormonal y la morfología de los ovarios en ratas hembras jóvenes.21
En relación a la composición química se han reportado alcaloides del tipo acridinas y quinolinas; flavonoides, cumarinas, fitotoxinas y terpenos; algunos de estos compuestos se les han atribuido propiedades citotóxicas y anticoagulantes.22, 23
G. Antifungico
Diferentes extractos de Ruta graveolens demostraron actividad inhibitoria in vitro sobre Candida albicans la cual fue obtenida de pacientes durante el curso de vaginitis aguda. Las fracciones cumarínicas de la Ruta graveolens exhibieron actividad inhibitoria frente a Rhizoctonia solani y Heterobasidium annosum. En diluciones homeopáticas de las hojas de Ruta graveolens junto a fosfato cálcico en casos de cisticercosis intracraneana, demostraron beneficios en la administración, observándose mejorías en el 69,4% de los casos, con una excelente tolerancia.10, 18
H. Actividad Inmunomoduladora - Antitumoral:
18
la irradiación), se fijen firmemente al ADN, alterando así la división celular que realizan las células tumorales. De esta manera, el 8-metoxipsoraleno expuesto a radiaciones de determinadas longitudes de onda, ha demostrado ser una sustancia fotoactiva útil en el abordaje del linfoma cutáneo de células T, conocido como Síndrome de Sezary y cierto tipo de leucemias. Trabajos previos también señalaban a la rutina con la capacidad de generar un efecto inhibitorio en la formación de tumores en piel de ratones tras inducción con benzopireno. Finalmente, el extracto de 6 éter-petrólico de Ruda.10
1.2.1.10. Reacciones adversas y advertencias.
a. Reacciones adversas:
En humanos, las furanocumarins originan eritemas, vesicación e hiperpigmentación sobre piel sometida a los rayos UVA (fotodermatitis) o radiación actínica, e incluso dermatitis de contacto en cultivos de jardín.15, 16,10
La esencia de Ruta graveolens puede causar dermatitis por contacto si se usa frecuentemente.16,10
La dosis terapéutica puede causar conducta melancólica, trastornos del sueño, cansancio, desvanecimiento, vértigo y espasmos, mientras que el jugo de las hojas puede provocar irritación gástrica e intestinal, desmayos, somnolencia, hipotensión, aborto, hinchazón de la lengua y piel húmeda, por lo que su administración debiera descartarse.16, 10
La hierba contiene furanocumarinas las cuales tienen acciones fototóxicas y mutagénicas.10
En un ensayo clínico realizado en el A. K. Tibbia College para el tratamiento de vitíligo, en donde a los pacientes se les administró 2-3 mg de Ruta graveolens en forma oral y tópica; se observaron en 21 pacientes los siguientes efectos adversos: epistaxis (12 pacientes), náuseas/vómitos (8 pacientes), y hematuria (1 paciente).19
b. Advertencias
19
Nunca usar internamente en embarazo o lactancia porque sus principios activos son embriotóxicos. No usar internamente en niños pequeños o jóvenes. No usar en pacientes cardíacos o con daño renal.20
1.2.2. CARACTERÍSTICAS DE LAS CEPAS EN ESTUDIO:
1.2.2.1. Staphylococcus aureus
Especie : Staphylococcus aureus
1.2.2.1.2. Características
Staphylococcus aureus, conocido comúnmente como estafilococo áureo o dorado, es una bacteria anaerobia Gram positivo productora de coagulasa y catalasa que se encuentra ampliamente distribuida por todo el mundo, estimándose que una de cada tres personas se hallan colonizadas, pero no infectadas, por ella. Este microorganismo fue descrito por vez primera en el año 1880, concretamente en la ciudad escocesa de Aberdeen, por el cirujano Alexander Ogston, en el que drenaba un absceso infectado.24
20
La variabilidad de Staphylococcus aureus, la rápida respuesta adaptativa frente a cambios del medio, y su continua adquisición de determinantes de resistencia antibiótica, han hecho de éste un residente habitual del hábitat hospitalario, donde origina problemas de multirresistencia, ocasionalmente importantes. Aunque el término resistencia a meticilina incluye resistencia a derivados ß-lactámicos, las cepas SARM presentan, en general, resistencia múltiple a varios grupos de antibióticos. A través de diversos mecanismos, estos aislados presentan resistencia al cloranfenicol, tetraciclinas, macrólidos, lincosaminas, aminoglucósidos e incluso, quinolonas, describiéndose cada vez con mayor frecuencia brotes SARM sensibles sólo a los glucopéptidos.26
1.2.2.1.3. Patogenia.
Staphylococcus aureus es un agente patogénico que actúa como un microorganismo saprófito, se encuentra en la piel del individuo sano pero en ocasiones en que las defensas disminuyen pueden causar enfermedad. El principal grupo de riesgo son pacientes hospitalizados o inmunocomprometidos.
Infección de piel y partes blandas. Neumonía, sialadenitis, sepsis con o sin metástasis (osteítis, artritis, endocarditis, abscesos localizados). Enfermedades por toxinas (síndrome de piel escaldada por estafilococo, síndrome del shock tóxico y gastroenteritis).25
Staphylococcus aureus posee resistencia a través de una beta-lactamasa inducible que le confiere resistencia ante la penicilina, esta beta-lactamasa está codificada en un plásmido presente en más del 90% de las cepas.25
21
enfermedad, para separar dichos organismos en patotipos.2722
1.2.2.2.3. Patogenia.
Escherichia coli puede causar infecciones intestinales y extraintestinales generalmente graves, tales como infecciones del aparato excretor, cistitis, meningitis, peritonitis, mastitis, septicemia y neumonía Gram-negativa.
El grupo Escherichia enteroinvasiva y Shigella spp. Se encuentra relacionada genética y bioquímicamente. Se asocia fundamentalmente con brotes de origen alimentario por alimentos importados, 5 siendo responsables de la “diarrea del viajero”. El mecanismo de patogenicidad de ECEI es la invasión del epitelio del colon, sin producción de toxinas LT y ST, dando lugar a una diarrea disenteriforme acuosa que se manifiesta con sangre y mucosidad en heces acompañado de fiebre y dolor abdominal6. En algunos casos sólo se produce diarrea. 27
Escherichia coli rica está dividida por sus propiedades virulentas, pudiendo causar diarrea en humanos y otros animales. Otras cepas causan diarreas hemorrágicas por virtud de su agresividad, patogenicidad y toxicidad. En muchos países ya hubo casos de muerte con esta bacteria. Generalmente les pasa a niños entre 1 y 8 años. Causado por la contaminación de los alimentos, y posterior mala cocción de los mismos.29
Debido a su alta presencia en el intestino, la Escherichia coli se utiliza como el indicador principal para detectar y medir la contaminación fecal en la evaluación de la inocuidad del agua y de los alimentos. Consideradas comensales inofensivas, las cepas de Escherichia coli constituyen alrededor del 1% de la población microbiana normal del intestino. Si bien la mayoría de las cepas dentro del intestino son agentes patógenos gastrointestinales beneficiosos para el ser humano, otros son perjudiciales.30
23
1.2.3. ENSAYOS ANTIMICROBIANOS.
La actividad antibacteriana de los productos naturales de origen vegetal, tanto extractos de plantas como sustancias puras, pueden ser detectadas cuando se colocan esas muestras en contacto con varias bacterias y se observa la respuestas del crecimiento bacteriano.31
Existe una gran variedad de métodos para detectar actividad antibacteriana. Dependiendo del método los resultados pueden ser grandemente influenciados una vez que ellos no son igualmente sensitivos o no se basan en los mismos principios.31Normalmente, esos métodos son clasificados en tres grandes grupos: métodos de difusión, dilución y antibiograma. Estos son los más comúnmente utilizados por los grupos de búsqueda de antibacteriano de origen vegetal y serán descritos abajo.
a. Método de Difusión en Agar.
Conocido como test de Kirby-Bauer, ese método fue estandarizado por Bauer et al. En 1996. Este es el ensayo más usado en la separación de plantas con actividad antimicrobiana bien en la práctica clínica y está recomendado por la Clinical and Laboratory Institute (CLSI). Básicamente consiste en colocar un reservorio impregnado con la muestra en contacto con un medio de cultivo inoculado y, al final del periodo de incubación, medir el diámetro de la zona clara (zona de inhibición de crecimiento) alrededor del reservorio. La medida del diámetro es un buen indicador de la actividad antimicrobiana.31
El microorganismo puede ser inoculado de diferentes formas. Normalmente ellos son inoculados en la superficie de agar sólido, pero también pueden ser mezclados en el agar de 45 a 50°C.31.Algunos autores utilizan placas Petri conteniendo dos capas de medio. La primera capa es colocada en la placa y luego, después de su solidificación, otro tipo de agar mezclado con microorganismos es colocado por encima del primero.31
24
estos son esterilizadas por medio de filtración con filtros millipore de 0.45 um. Tal procedimiento es hecho principalmente cuando se trata de extractos acuosos.32
Antes de incubar el sistema inoculado, puede ser mantenido a temperaturas más bajas por algunas horas con el objetivo de facilitar la difusión de la muestra y, consecuentemente, aumentar el diámetro de inhibición mejorando el límite de detección. Algunos estudios consideran suficiente mantener las placas a 4° C por 1 a 2 horas.32
Otros consideran suficiente dejar las placas a temperatura ambiente por 30 minutos.31Aun utilizan film plástico para sellar las placas Petri con la intención de evitar una eventual evaporación de las muestras.32 Los diámetros de las zonas de inhibición son normalmente medidas con un paquimetro. El diámetro también puede ser medido automáticamente con la ayuda de software.33 Con el objetivo de facilitar la medida del halo, las placas Petri pueden ser rociadas después del periodo de incubación con indicadores redox del tipo sal de tetrazolium.33
No existe ningún valor patrón que determina que la muestra es activa o no. Es frecuente expresar los resultados como un criterio para determinar la susceptibilidad, susceptibilidad intermedia y la resistencia. En estos casos, son creadas escalas basadas en el tamaño de las zonas de inhibición. Cuanto mayor sea el halo, más sensible es el microorganismo.38, 39 También es posible comparar los
halos de las muestras con los halos formados por los controles (antibiótico o anti fúngico).40 Algunos autores solo consideran una muestra activa si la razón del halo de la muestra por el halo del control fuera mayor que cero, o sea, el halo de la muestra es igual o mayor que al del control.31
Existe una variación del método de difusión en agar utilizado tanto para aceites esenciales como para extractos brutos. En esta técnica, los microorganismo son inoculados en el superficie del agar y después de 10 minutos, una gota de 10 uL de la muestra es colocada en el centro de la placa. Después del periodo de incubación, el diámetro de la zona de inhibición es medido.31
25
fue capaz de aumentar ese halo, sugiriendo la presencia de sustancias activadas por fluorescencia.33 Para algunos autores, la actividad de la luz UV es considerada
positiva si ambas placas, aquella dejada al oscuro y aquella dejada en el UV, muestran zonas de inhibición. Si apenas la placa expuesta al UV presentase halos, la luz es considerada fototóxica.34
El método de difusión en agar no es apropiado para investigar la actividad de muestras no polares o aquellas que no se difunden fácilmente en el agar.45 Entre tanto, esta técnica es extremadamente utilizada hasta para muestras apolares. En general, las diferencias en la propiedad química, como solubilidad, volatidad y difusión pueden afectar la potencia de diferentes muestras.31
Este método, simple y no oneroso, es generalmente usado para la separación de varios extractos. El extracto que presenta la actividad presentará su Concentración Inhibitoria Mínima (CIM) calculada posteriormente por los métodos de dilución. Es importante enfatizar que el método de difusión en agar es utilizado para la determinación cualitativa de la actividad antimicrobiana. Normalmente, esa técnica verifica cuales extractos presentan potencial actividad y cuales organismos son susceptibles.31
b. Método de Macrodilución.
Las pruebas de dilución han sido utilizadas durante años. Los procedimientos iniciales serán realizados en tubos de ensayo grandes (13 por 100 mm) con volúmenes de caldo de por lo menos 1 ml. Este método fue estandarizado en la década de los años 70 por el Estudio Cooperativo Internacional y luego la NCCLS publicó un estándar del método. Este método es llamado macrodilución en caldo. A partir de los años 60 se comenzaron a utilizar dispositivos serológicos para dispensar y diluir. Esta miniaturización simple de la técnica se conoció como macrodilución en caldo.32
26
En el método de macrodilución se emplea por cada combinación de bacteria con antibacteriano, un juego de tubos. Habitualmente se prepara el juego de tubos con 1ml de caldo MH (Müeller Hinton) suplementado con Ca++ y Mg++ estéril sin antibacteriano.32
Para un pequeño número de pruebas se preparan diluciones al doble directamente en los tubos, del modo siguiente. Se colocan 2 ml de solución de antibiótico en el primer tubo de la serie de diluciones. En cada uno de los tubos restantes se añade 1 ml de caldo MH. Con una pipeta estéril se transfiere 1 ml del primer tubo al segundo. Después de mezclar el contenido del segundo tubo, se transfiere 1 ml con una pipeta diferente (en esta transferencia y en todas las sucesivas) al tercer tubo.32
El proceso continúa hasta el penúltimo tubo, al que se le quita1 ml, que se descarta. El último tubo no recibe solución de antibiótico y sirve de control de crecimiento. Las concentraciones finales de antibióticos en esta prueba son iguales a la mitad de la serie inicial de dilución, debido al agregado de una concentración igual de inóculo en el caldo. Se prepara un inóculo bacteriano que contenga 105 a 106
27
1.3.VARIABLES Y INDICADORES
1.3.1. VARIABLES 1.3.1.1. Independiente
Extracto etanólico de las Hojas de Ruta graveolens “Ruda”.
1.3.1.2. Dependiente
Actividad antibacteriana In Vitro
1.3.2. INDICADORES
1.3.2.1. Independiente (X): concentración del extracto Concentración baja: 0.25 mg/ml
Concentración media: 4 mg/ml Concentración alta: 32 mg/ml
1.3.2.2.Dependientes (Y): grado de turbidez 4 (no inhibición),
28
Definición Operacional Indicador Índices Escala de
29
Variable Dependiente
Definición Conceptual Definición Operacional
Indicador Índices Escala de
Medición 0 Ausencia de turbidez en
los cultivos de las cepas ensayadas. Inhibición.
1 Ligera turbidez.
2 Inhibición aparente.
3 Ligera inhibición.
30
31
2.1. METODOLOGIA
2.1.1.TIPO DE INVESTIGACIÓN.
En el trabajo de investigación se empleó los diseños descriptivo, prospectivo y Longitudinal:
Descriptivo; porque en el estudio describirá e interpretará en forma clara y detallada los hechos obtenidos en la investigación.
Prospectivo; porque se desarrolló a través del tiempo, registrando la información a partir del inicio del estudio
32
2.1.2. POBLACION Y MUESTRA
2.1.2.1.Población vegetal
La población vegetal en estudio estuvo constituida por la especie vegetal Ruta graveolens “Ruda”, fueron ubicados en el centro poblado Nina Rumí en el margen derecho del Rio Nanay a 25 kilómetros de la ciudad de Iquitos, vía Carretera Iquitos Nauta. Limita por el este, norte y sur con terrenos de la Universidad Nacional de la Amazonia Peruana y por el lado oeste con el Rio Nanay.
2.1.2.2.Muestra vegetal
La muestra estuvo constituida por las hojas de Ruta graveolens “Ruda”.
2.1.2.3.Criterios de Inclusión
Hojas sin presencia de bacterias y hongos.
La especie vegetal fue identificada en el Herbarium Amazonense de la Facultad Ingeniería Forestal, el cual otorgó una constancia de la planta en estudio.
2.1.2.4. Criterios de Exclusión
Las Hojas presentaron bacterias u hongos.
2.1.2.5.Población Microbiológica.
La población microbiológica fue constituida por dos bacterias, Staphylococcus aureus ATCC 25923 y Escherichia coliATCC 25922, son bacterias anaeróbias Facultativas Gram positivas y Gram negativas.
2.1.2.6.Muestra Microbiológica.
Las muestras microbiológicas estuvieron constituidas por las bacterias. Staphylococcus aureus ATCC 25923
Escherichia coli ATCC 25922
2.1.2.7.Criterios de Inclusión Se emplearon bacterias jóvenes.
33
Erlenmeyer de 250 y 500 ml LBT GERMANY Frasco ámbar con tapa rosca.
Matraz 1000 ml LBT GERMANY Micropipeta Pasteur LABMATE SOFT Pipetas de 1, 2, 5 y 10 ml LBT GERMANY
Probetas de 10, 100, 250 y 1000 ml LBT GERMANY
Tubos ensayo con tapa rosca (75 x 120 mm.) LBT GERMANY Tubos de ensayo de 5 y 7 ml LBT GERMANY
Vasos de precipitado de 5, 10, 20, 50 y 100 ml LBT GERMANY Bagueta LBT GERMANY
Placas petri LBT GERMANY
2.2.2. Material de Metal:
34
Hisopos para medios de cultivos. Papel aluminio. Soportes para tubos LBT GERMANY Mandil o guardapolvo
Termostatos de Inmersión SELECTA PRECISTERM Cámara fotográfica profesional SONY DSC – S3000 Centrifuga CHRIST
Cocina eléctrica PREMIER. Equipo de filtración NALGENE
Cabina de bioseguridad NUAIRE CLASS II
35
Agar Müeller Hinton BD BIPLATE Agar Nutritivo BD BIPLATE
Caldo Müeller Hinton BD BIPLATE
2.3. CRITERIOS DE BIOSEGURIDAD:
Se aplicaron las medidas de bioseguridad establecidas en las normas de Bioseguridad (Serie Normas Técnicas Nº 18-INS), aplicable al personal, uso y desecho de sustancias y materiales, acceso a los locales, y el medio ambiente. Las bacterias mencionadas en el presente trabajo corresponden trabajarlas a un nivel de bioseguridad.36
Las principales medidas de bioseguridad incluyeron:
El acceso al laboratorio estuvo limitado al personal autorizado.
El personal del laboratorio realizó el cumplimiento de las normas de seguridad.
Todas las áreas estuvieron debidamente marcadas con la señal de riesgo biológico y su nivel de contención.
La ropa fue protectora, fácilmente ajustable y confortable, utilizando siempre guardapolvo o mandilón de laboratorio, así como guantes, gafas, Etc. Debe estar disponible en todo momento.
Se usaron gafas protectoras y mascarillas faciales si existe riesgo de salpicaduras y/o aerosoles.
Se utilizó guantes estériles.
Tras quitarse los guantes, se realizó un lavado de manos.
36
El procesamiento de las muestras se realizó sobre una superficie de trabajo cubierta con papel absorbente plastificado o papel de filtro.
Las superficies de trabajo fueron descontaminados por el operador antes y después de cada actividad.
Los reactivos fueron etiquetados y almacenados en viales adecuados con tapa rosca.
Todos los desechos del laboratorio fueron descontaminados adecuadamente, antes de eliminarlos en solución desinfectante o ser autoclavados a 121ºC durante 20 minutos, o incinerarse.37
2.4.PROCEDIMIENTO
2.4.1. Material Vegetal: Se utilizó las hojas de la Ruta graveolens “Ruda”.
2.4.2. Recolección de la Muestra Vegetal:
Las muestras de las hojas de Ruta graveolens “Ruda” fueron recolectadas en la comunidad de Nina Rumi (Carretera Zungarococha). Departamento de Loreto-Perú.
2.4.3. Identificación de la Muestra Vegetal:
Parte de la muestra vegetal de las hojas de Ruta graveolens “Ruda” fue identificada en el “Herbarium Amazonense”, posteriormente fue depositado en el laboratorio de Fitoquímica de la Facultad Facultad de Industrias Alimentarias de la Universidad, Nacional de la Amazonía Peruana (UNAP).Ubicado en la Av. Freyre N° 610 - Iquitos. (Anexo- Imagen N° 09).
2.4.4. Secado y Molienda de la Muestra Vegetal:
37
suficientemente pequeñas, luego se procedió a envasarlos en recipientes adecuados que serán conservadas en lugares secos y frescos.
2.4.5. Obtención del Extracto Etanólico.
El extracto etanólico se obtuvo por maceración de la muestra por 10 veces consecutivas con etanol (96 grados) durante 7 días cada vez.
Para cada extracción se maceraron 1000 g de materia prima (Ruda), en 2 000 ml de etanol, durante 7 días. La concentración del extracto se realizó por eliminación del disolvente a presión reducida en un rotavapor, a una temperatura de 60ºC y a una presión de 690 mmHg. Por espacio de 3 horas aproximadamente, posteriormente se dejará secar a temperatura ambiente por 3 días (Anexo N° 12).
2.4.6. Tamizaje Fitoquímico:
Se realizó el tamizaje fitoquímico del extracto etanólico de las hojas Ruta graveolens “Ruda” .y a continuación se detalla cada uno de los ensayos fitoquímicos.
Identificación de Alcaloides: Ensayo de Dragendorff.
La fracción se disolvió en 1ml de Ácido Clorhídricoal 1% (Densidad 1.189kg/l al 38%) en ausencia de solvente orgánico, se mezcló con 1 gota de reactivo, si hay opalescencia se considera (+), turbidez (++), precipitado (+++) de color rojo ladrillo.
Identificación de Aminoácidos y Aminas: Ensayo de Ninhidrina.
38
Identificación de aldehídos: Ensayo de Fehling.
El residuo se disolvió en 1-2 ml de agua, en caso que la fracción no sea acuosa, se adiciona 2 ml del reactivo, se calentó la mezcla en baño de agua durante 10-30 min. El ensayo se considera positivo si la solución se colorea de rojo o aparece precipitado rojo.
Identificación de cumarinas: Ensayo de Baljet.
Permitió reconocer en un extracto la presencia de compuestos de agrupamientos lactónicos, en particular cumarinas, aunque estos compuestos lactónicos pueden dar positivo al ensayo: como lactonas sesquiterpénicas, etc. Por ello si la alícuota del extracto no se encuentra en alcohol debió evaporarse el solvente en baño de agua, y redisolverse en la menor cantidad de alcohol.
En estas condiciones se adiciona 1 ml de reactivo, considerándose un ensayo positivo la aparición de coloración o precipitado rojo respectivamente.
Identificación de Glicósidos: Ensayos de Molish.
2 ml del extracto se mezcló en un tubo de ensayo y se le añadió 3 gotas de solución o-naftol al 5% en etanol. Se mezcló y por la pared del tubo se adicionó 1ml de ácido sulfúrico concentrado. La aparición de anillo violáceo en la interface indica reacción positiva.
Identificación de Glicósidos Cardiotónicos: Ensayo de Kedde.
La fracción se disolvió en 1 ml de alcohol etílico y se mezcló con 1 ml de reactivo, se deja reposar durante 5-10 minutos. Un ensayo positivo es aquel en el que se desarrolla una coloración violácea persistente durante 1-2 horas.
Identificación de Flavonoides: Ensayo de Shinoda.
39
Identificación de Fenoles y taninos: Ensayo de Cloruro Férrico.
A la fracción disuelta en 1 ml de etanol, se le añadió 0.5 ml de una solución de Cloruro Férrico al 5% en solución salina (85%). La aparición de un color o precipitado verde oscuro indica la presencia de fenoles y/o taninos. El extracto acuoso se adiciona acetato de sodio previo al ensayo.
Identificación de Mucílagos: Ensayo de mucílagos.
Permitió reconocer en los extractos vegetales la presencia de esta estructura tipo polisacárido, que forma un alcaloide hidrófilo de alto índice de masa que aumenta la densidad del agua cuando se extrae.
Para ello una alícuota del extracto en agua se enfría a 0-5 ºC y si la solución toma una consistencia gomosa al tacto el ensayo es positivo.
Identificación de Quinonas: Ensayo de Bornträger
La fracción se disolvió en 1ml de cloroformo, se agita con 1ml de solución de NaOH al 5% en agua. Si la fase acuosa alcalina (superior), se colorea de rosado o rojo, el ensayo se considera positivo (naftoquinona y antraquinona).
Identificación de Saponinas: Ensayo de Espuma.
Permitió reconocer la presencia de saponinas tanto del tipo esteroidal como triterpénica. De modo que si la alícuota se encuentra en alcohol, se diluyó con 5 veces su volumen en agua y se agita la mezcla frecuentemente durante 2 minutos. El ensayo se considera positivo si aparece espuma de más de 2 mm de altura en la superficie y persiste por más de 2 minutos. 35
2.4.7. Prueba de Susceptibilidad y Acción Antibacteriana de los Extractos por el Método de Macrodilución.
40
2.4.7.1.Concentración Mínima Inhibitoria (Método de Macrodilución):
Preparación del inóculo: El inóculo estándar, para macrodilución en caldo, se obtuvo por crecimiento de la bacteria hasta una turbidez equivalente al tubo 0.5 de la escala de Mc Farland o por suspensión directa de colonias, en caldo o solución fisiológica, hasta alcanzar dicha turbidez.
2.4.7.2.Colocación del inóculo en los tubos.
Macrodilución en caldo (tubos).
Una vez obtenido el inóculo de turbidez comparable al 0,5 de Mc Farland. Se agregó 1 ml. del inóculo estandarizado a cada tubo de dilución de muestra y al tubo control de crecimiento y se homogeniza la mezcla. No debe transcurrir más de 15 minutos entre la preparación del inóculo y su colocación en el tubo, para evitar que el número de bacterias aumente por duplicación. Se tuvo que tener en cuenta que tanto la muestra, como el inóculo sufrirán una dilución al medio. Es aconsejable realizar un control de pureza del inoculo, subcultivando una alícuota en un medio sólido no selectivo.31
2.4.7.3.Incubación.
El tiempo de incubación para la mayoría de las bacterias fue de 16 a 20 horas en una incubadora seca, para la técnica de macrodilución.
2.4.7.4. Procedimiento y Lectura e interpretación de la CIM.
La CIM corresponde a la mínima concentración de antibiótico en donde no se observa desarrollo (turbidez). La CIM se expresa en μg/ml.32
Cálculo en gramos del extracto.
41
Peso en gr. = 640 mg. x 1gr. del extracto 1000mg.
Peso en gr. = 0.64 gr. del extracto
42
2.4.8. Procedimiento de los Ensayos la Actividad Antibacteriana.
2.4.8.1.Cepas empleadas:
Se emplearon dos (02) cepas, Staphylococcus aureus y Escherichia coli, las cuales fueron proporcionadas por el departamento de Microbiología de la Facultad de Industrias Alimentarias de la Universidad Nacional de la Amazonía Peruana, la Universidad lo obtuvo del Instituto Nacional de Salud (INS-Perú), cuyas características fenotípicas están detalladas en el (Anexo - Foto Nº 04 y 05).
2.4.8.2.Preparación de la solución madre:
Se restableció la movilización de las cepas petrificadas por refrigeración, respectivamente identificadas, que son colocadas en medio caldo nutritivo glucosado de sabouraud a una temperatura de incubación de 37 ºC por 24 horas. Posteriormente se realizó el sembrío en forma de estrías con el asa bacteriológica en placas de agar Müeller-Hinton(MH) a temperatura de incubación de 37 ºC por 24 horas para lograr la producción de colonias.(Anexo - Foto N° 08 y09)
2.4.8.3.Preparación del inóculo:
Usando el asa bacteriológica, se extrajo del sembrío de agar un aproximado de 2 a 5 colonias aisladas de Escherichia coli y Staphylococcus aureus, y se depositó en un tubo conteniendo 10 ml de solución salina (NaCl) estéril al 0.9%; que se ajustó la suspensión a la turbidez de la escala 0,5 de Mc. Farland. (5 x 105 UFC/ml), para la comparación bacteriológica en estudio. (Anexo - Foto 16, 17, 18, 19, 20 y 21).
2.4.8.4. Preparación de la suspensión bacteriana y su aplicación en la prueba de macrodilución:
43
2.4.8.5.Macrodilución en caldo (tubos).
Se agrega 1 ml. del inóculo estandarizado a cada tubo de dilución de muestra y al tubo control de crecimiento y se homogeniza la mezcla. No deben transcurrir más de 15 minutos entre la preparación del inóculo y su colocación en el tubo. Se debe tener en cuenta que tanto la muestra, como el inóculo sufrirán una dilución al medio.
2.4.8.6. Ensayo de la actividad antibacteriana.
Esta técnica fue utilizada para determinar la actividad antibacteriana del extracto etanólico obtenido de las hojas de Ruta graveolens “Ruda” frente a Staphylococcus aureus y Eschericia coli.
El método ensayado se realizó según los procedimientos establecidos en el Protocolo del 2007 por el Instituto de Estándares Clínicos y de Laboratorio (CLSI por su sigla en inglés, anteriormente conocido como NCCLS)
2.4.8.7.Preparación y control de extractos.
A.Método de Macrodilución en caldo
Se pesó 640 mg del extracto en viales tipo spendorf estériles, diluidos en 1 ml de disolución metanol/agua (1:1) para alcanzar la concentración de prueba de 640 mg/ ml (Solución Madre o Stock).
De la solución madre se extrajo 0.2 ml y fue añadido al tubo N° 01 que contenía 1.8 ml de caldo Müeller Hinton.
Del tubo N° 01 se extrajo 1 ml, lo cual fue añadido al Tubo N° 02 y así sucesivamente hasta llegar al tubo N°08.
44
Después del proceso se añadió a todos los tubos 1 ml de la suspensión bacteriana.
El volumen final mínimo, en cada tubo, fue de 2 ml.
Las concentraciones estuvieron comprendidas entre los rangos de 32 mg/ml a 0.25 mg/ml.
Los extractos que no se disolvieron por agitación fueron mantenidos por algunos minutos en baño maría (temperatura de 40°C) y fueron colocados nuevamente en el vórtex.
El control positivo empleado en la prueba fue el antibiótico Gentamicina (160 mg/2ml), del cual se utilizó 0.64 ml y se enrasó hasta 5 ml en un tubo estéril para obtener una solución madre o stock de 1024 ug/ml.
De la solución madre se extrajo 0.2 ml y se añadió al tubo N° 01 que contuvo 1.8 ml de caldo Müeller Hinton.
Del tubo N° 01 se extrajo 1 ml, lo cual fue añadió al Tubo N° 02 y así sucesivamente hasta llegar al tubo N° 09.
Del tubo N° 09 se extrajo 1 ml que fue desechado.
Después de este proceso se añadió a todos los tubos 1 ml de la suspensión bacteriana.
45
FIGURA N° 04.
Procedimiento del Control del Método de Macrodilución en Caldo
B. Método de macrodilución en caldo.
Se pesó 640 mg del extracto en viales tipo spendorf estériles, diluidos en 1 ml de disolución metanol/agua (1:1) alcanzando una concentración de prueba de 640 mg/ml (Solución madre o Stock).
De la solución madre se extrajo 0.2 ml y se añadió al tubo N° 01 que contuvo 1.8 ml de caldo Müeller Hilton.
Del tubo N° 01 se extrajo 1 ml, lo cual se añadió al Tubo N° 02 y así sucesivamente hasta llegar al tubo N°08.
Del tubo N° 08 se extrajo 1 ml que fue desechado.
46
Después de este proceso se añadió a todos los tubos 1 ml de la suspensión bacteriana a concentración de 5 x 105 UFC/ml (que se obtenía al hacer dilución de 1:100 de inóculo 0.5 de Mc Farland).
El volumen final mínimo, en cada tubo, fue de 2 ml.
Se debe tener en cuenta que con el agregado de la suspensión bacteriana, las concentraciones del extracto vegetal en cada tubo se diluyeron en el medio; por lo tanto dichas concentraciones deben ser preparadas al doble de la concentración final deseada.
Las concentraciones están comprendidas entre los rangos de 32 mg/ml a 0.25 mg/ml.
Los tubos, se incubaron a 35±2ºC en aerobiosis, por espacio de 18-24 horas. La prueba se realizó por triplicado. Se consideró que el resultado del ensayo
era válido si entre cada réplica no había variación en ± una dilución (caso contrario se descartaba y se repetía la prueba).
Luego se procedió a la interpretación de los resultados, la cual se determinó a simple vista, por la falta de turbidez del caldo, para ello se comparó cada tubo con el tubo control de crecimiento.
El control positivo que se empleó en la prueba fue el antibiótico gentamicina (160 mg/2ml), del cual se utilizó 0.64 ml y se enrasó hasta 5 ml en un tubo estéril para obtener una solución madre o stock de 10240 ug/ml.
De la solución madre se extrajo 0.2 ml y fue añadido al tubo N° 01 que contendrá 1.8 ml de caldo Müeller Hinton.
47
Del tubo N° 09 se extrajo 1 ml que se desechó.
Después de este proceso se añadió a todos los tubos 1 ml de la suspensión bacteriana.
Las concentraciones estuvieron comprendidas entre los rangos de 5120 ug/ml a 20 ug/ml. Representación en la figura N° 05.
FIGURA N° 05
Procedimiento del Control del Método de Macrodilución en Caldo
2.4.8.8. Preparación del estándar (0.5 Mc Farland) para el inóculo
48
1. Preparación del estándar de turbidez:
a. Se agregó 0,5 ml de una solución de BaCl2 0,048 M (BaCl22H2O al 1,175% P/V)
a 99,5 ml de una solución de H2SO4 0,18 M (0,36 N) (1% V/V) en constante
movimiento para mantener la suspensión.
b. Se verificó la densidad correcta del estándar usando un espectrofotómetro, cuya absorbancia a 625 nm es 0,08 a 0,10 para el estándar 0,5 de Mc Farland.
c. Se distribuyó de 4 ml a 6 ml en tubos con tapa de rosca o tapón de jebe, similares a los que se usaron para preparar el inóculo.
d. Se Ajustó bien las tapas o tapones y se conservó en la oscuridad a temperatura ambiente y anotando la fecha de preparación.
e. Antes de ser usado se agitó vigorosamente dicho estándar de preferencia, en un agitador mecánico.
f. Se verificó mensualmente la densidad de los estándares de sulfato de bario, y reemplazó cuando fue necesario.
2.5.ANÁLISIS E INTERPRETACIÓN DE DATOS.
49
50
3.1.RESULTADOS
En el presente estudio de investigación con el extracto Etanólico de las hojas de Ruta graveolens “Ruda” hemos encontrado los siguientes resultados:
3.1.1.Tamizaje Fitoquímico del Extracto Etanolico.
Tabla N° 01: Resultados obtenidos del Tamizaje Fitoquímico del extracto Etanolico de las hojas de Ruta graveolens “Ruda”.
ENSAYOS PARA RESULTADOS
Leyenda: (-) Ensayo Negativo; (+) Ensayo positivo. Contenido: (+++) Abundante;
(++) Mediano; (+) Poco.
51
3.1.2. Ensayo de concentración inhibitoria mínima (CIM)
Tabla N° 02: Clasificación de la actividad antibacteriana según la concentración inhibitoria mínima (CIM)
Fuente: Protocolo de Estudio de la Actividad Antibacteriana
Tabla N° 03: Resultados obtenidos en el ensayo de concentración inhibitoria mínima del extracto Etanólico de Ruta graveolens “Ruda”
Escherichia coli
CIM Clasificación
Staphylococcus aureus CIM Clasificación
C1 32 mg/ml Inactivo 32 mg/ml Inactivo
C2 16 mg/ml Inactivo 16 mg/ml Inactivo
C3 8 mg/ml Poco activo 8 mg/ml Poco activo
C4 4 mg/ml Moderado activo 4 mg/ml Moderado activo
C5 2 mg/ml Moderado activo 2 mg/ml Moderado activo
C6 1 mg/ml Moderado activo 1 mg/ml Moderado activo
C7 0.5 mg/ml Buena actividad 0.5 mg/ml Buena actividad *
C8 0.25 mg/ml Buena actividad * 0.25 mg/ml Buena actividad
* Concentración Mínima Inhibitoria (CMI)
52
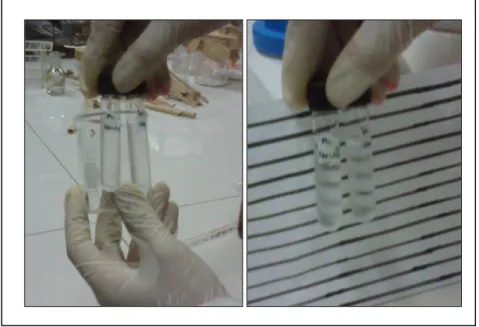
Imagen N° 01: Concentración inhibitoria mínima para Escherichia coli.
En la imagen N° 01 se evidencio que la CMI para Escherichia coli se encontró en el tubo C8 (0.25 mg/ml), ya que en él se vio el ligero cambio de turbidez característica de la prueba.
Imagen N° 02: Concentración inhibitoria mínima para Staphylococcus aureus.
53
Gráfico N° 01: Gráfico de barras del CIM encontrado del extracto Etanólico de Ruta graveolens “Ruda” frente a las cepas en estudio.
En el gráfico se observa que la mínima concentración que inhibe (CMI) el crecimiento de las bacterias en estudio es de 0,5 mg/ml y 0,25 mg/ml para Staphylococcus aureus y Escherichia coli respectivamente se considera dentro del rango de buena actividad (< 1 mg/ml).
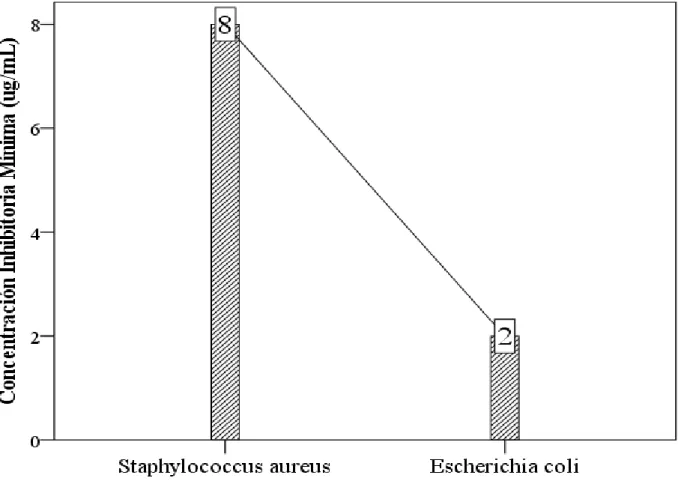
Gráfico N° 02: Gráfico de barras del Control Positivo con Gentamicina frente a las bacterias en estudio de la concentración inhibitoria mínima del extracto