Evaluación de dióxido de titanio como removedor de boro proveniente de aguas subterráneas del manto acuífero del Distrito de Socabaya
Texto completo
(2) Dedicatoria A: Dios que me dio la fortaleza y paciencia necesaria para culminar este proyecto y guiar mi camino. Mi madre por su amor, comprensión, paciencia y apoyo incondicional en cada uno de los pasos que doy en mi vida. Mi padre por su apoyo, su ejemplo de constancia, responsabilidad y perseverancia que lo caracterizan y por su amor. Mi hermano por sus palabras de aliento y preocupación en concluir esta meta. Mi abuela Adela por su amor y su valor mostrado para salir adelante. Mis abuelos (QEPD), por sus enseñanzas y quererme siempre.. Romineth Gibelly Rivera Meza.. ii.
(3) Dedicatoria A Dios, por darme la vida y estar siempre conmigo, guiándome en mí camino dándome fuerza para continuar en este proceso de obtener uno de los anhelos más deseados. A mi madre por mostrarme el camino a la superación, por su paciencia, por su inmenso amor, trabajo y sacrificio en todos estos años impulsándome para que siga adelante. A mi hermano y su familia por su cariño y apoyo incondicional, durante todo este proceso. A la memoria de mi padre y mi abuelo Moisés que me sirvieron de ejemplo y fortaleza. A todos los docentes que con su sabiduría, conocimiento y apoyo, motivaron a desarrollarme como persona y profesional. Y a todas las personas que nos han apoyado y han hecho que el trabajo se realice con éxito en especial a aquellos que nos abrieron las puertas y compartieron sus conocimientos desinteresadamente. Edgardo S. Arroyo Muñoz. iii.
(4) Agradecimientos. Gracias a Dios por guiarnos en nuestros caminos y permitir que este proyecto se concluya.. Deseamos expresar un sincero agradecimiento a nuestro docente Ing. Armando Robles por su orientación desde el inicio del proyecto y por las facilidades de los equipos y materiales necesarios para que este proyecto se realice.. También hacer extenso este agradecimiento a todas las autoridades de nuestra Universidad, por los permisos y aprobaciones en esta etapa.. A nuestros padres ya que la mejor herencia que nos pueden dejar son los estudios; ellos son los pilares de nuestra vida y por ello les dedicamos este proyecto de titulación.. A demás familiares y amigos que confiaron en nuestras capacidades. iv.
(5) PRESENTACIÒN. Señor Decano de la Facultad de Ingeniería de Procesos Señor Director de la Escuela Profesional de Ingeniería Química Señores Miembros del Jurado. Cumpliendo con el Reglamento de Grados y Títulos de Facultad de Ingeniería de Procesos de la Escuela Profesional de Ingeniería Química – Universidad Nacional de San Agustín, pongo a vuestra consideración y en particular a los miembros del Jurado la Tesis titulada “Evaluación de dióxido de titanio como removedor de boro proveniente de aguas subterráneas del manto acuífero del distrito de Socabaya”, el que contar con su venia, espero nos permitan obtener el Título Profesional de Ingeniero Químico.. Atentamente,. Bachilleres: Arroyo Muñoz Edgardo Stevents Rivera Meza Romineth Gibelly. v.
(6) RESUMEN En este trabajo de investigación se propone desarrollar un sistema de remoción de boro presente en aguas subterráneas, puesto que el boro en cantidades muy pequeñas es necesario como micronutriente esencial pero se vuelve tóxico cuando sobrepasa los niveles de 1 a 2mg/l de boro. Las aguas superficiales rara vez contienen niveles tóxicos de boro, pero en aguas subterráneas (pozos de aguas) contienen concentraciones toxicas, principalmente en las cercanías de fallas sísmicas y áreas geotérmicas. El material adsorbente con el que se trabajo fue el dióxido de titanio, este se usó para pruebas de adsorción de boro en soluciones acuosas. Dichas pruebas se realizaron en tres etapas. La primera etapa consistió en obtener la muestra de agua subterránea del distrito de Socabaya y determinar su concentración de boro presente, para la obtención de la muestra se siguió el procedimiento para muestreo de aguas subterráneas. Dicha muestra fue analizada por ALS LS Perú S.A.C, mediante un análisis por ICP – MS, espectrometría de masas con plasma de acoplamiento inductivo. Esta es una variante de las técnicas de análisis por espectrometría de masas. Esta técnica está establecida de manera estándar en laboratorios, para analizar: aguas, suelos, alimentos, muestras clínicas, entre otras; permite analizar el mayor número de los elementos e isótopos de la tabla periódica, de forma simultánea en menor tiempo (máximo cinco minutos). El resultado obtenido para boro fue de 3.73 mg/l. La segunda etapa consistió en acondicionar el equipo de prueba de jarras para adsorción en un sistema batch a nivel de laboratorio.. vi.
(7) La tercera etapa consistió en poner en contacto la solución muestra con el adsorbente dióxido de titanio en un sistema batch, teniendo como parámetros la concentración de boro y el tamaño de partícula del material adsorbente y temperatura ambiente; tomando como variables independientes la cantidad de adsorbente, pH, tiempo de agitación. Se puso en contacto 250mL de la muestra agua subterráneas que contienen Boro con las diferentes dosis de adsorbente (0.5 y 1.5g) y pH (8y 10), el tiempo de agitación fue hasta 45 minutos. La agitación fue de 200 rpm. Culminadas las etapas de experimentación se midió la concentración de boro con el método de curcumina por espectrofotometría visible. Los datos experimentales del equilibrio de adsorción de Boro fueron evaluados aplicando isotermas de Freundlich y Langmuir. Los resultados del proceso demostraron que los iones de boro fueron eficazmente adsorbidos por dióxido de titanio, obteniéndose un porcentaje de adsorción de 72.24% para aguas subterráneas, la máxima adsorción de Boro, proveniente de agua subterránea, en dióxido de titanio fue a pH de 10 y la masa de adsorbente es 0,5 g de TiO2. Los resultados de la cinética de adsorción de Boro mostraron que los datos experimentales fueron mejor ajustados por el modelo de Freundlich teniendo como resultado n < 1, lo que confirma isoterma favorable para el proceso de adsorción de boro en agua subterránea usando dióxido de titanio como material adsorbente. Mediante el uso de la isoterma de Freundlich se determinó la capacidad máxima de adsorción de Boro siendo 1,345 mg/g TiO2. Palabras claves: Agua subterránea; Boro; Dióxido de Titanio; Soluciones de Ácido bórico; Curcumina; Cinética de Adsorción; Isotermas de adsorción.. vii.
(8) SUMMARY In this research work, it is proposed to develop a boron removal system present in groundwater, since boron in very small amounts is necessary as an essential micronutrient but becomes toxic when it exceeds the levels of 1 to 2mg / l of boron. Surface waters rarely contain toxic levels of boron, but in groundwater (water wells) they contain toxic concentrations, mainly in the vicinity of seismic faults and geothermal areas. The adsorbent material with which it was worked was titanium dioxide, this was used for boron adsorption tests in aqueous solutions. Said tests were carried out in three stages. The first stage consisted of obtaining the groundwater sample from the Socabaya district and determining its present boron concentration, in order to obtain the sample, the procedure for sampling groundwater was followed. Said sample was analyzed by ALS LS Peru S.A.C, by means of an ICP-MS analysis, inductive coupling plasma mass spectrometry. This is a variant of mass spectrometric analysis techniques. This technique is established in a standard way in laboratories, to analyze: water, soil, food, clinical samples, among others; allows to analyze the largest number of elements and isotopes of the periodic table, simultaneously in less time (maximum five minutes). The result obtained for boron was 3.73 mg / l.. The second stage consisted of conditioning the jar test equipment for adsorption in a batch system at the laboratory level.. The third stage consisted in contacting the sample solution with the adsorbent titanium dioxide in a batch system, having as parameters the concentration of boron, temperature and the particle size of the adsorbent material; taking as independent variables the amount of adsorbent, pH, time of agitation. 250mL of the synthetic boron sample and viii.
(9) groundwater was contacted with the different doses of adsorbent (0.5 and 1.5g) and pH (8 and 10), the stirring time was up to 45 minutes. The stirring was 200 rpm. At the end of the experimentation stages, the boron concentration was measured with the curcumin method by visible spectrophotometry. The experimental data of the equilibrium of Boron adsorption were evaluated applying isotherms of Freundlich and Langmuir. The results of the process showed that the boron ions were effectively adsorbed by titanium dioxide, obtaining a percentage of adsorption of 72.24% for groundwater, the maximum adsorption of Boron, from groundwater, in titanium dioxide was at pH of 10 and the mass of adsorbent is 0,5 g TiO2. The results of the boron adsorption kinetics showed that the experimental data were better adjusted by the Freundlich model resulting in n <1, which confirms favorable isotherm for the boron adsorption process in groundwater using titanium dioxide as the material adsorbent. By using the Freundlich isotherm, the maximum adsorption capacity of Boron was determined to be 1,345 mg / g TiO2. Keywords: Groundwater; Boron; Titanium dioxide; Boric acid solutions; Curcumin; Adsorption Kinetics; Adsorption isotherms.. ix.
(10) INDICE GENERAL Dedicatoria………………………………………………………………………….ii Agradecimientos………………………………………………………………...….iv Presentaciòn ............................................................................................................... v Resumen……………………………………………………………………………vi Sumary……………………………………………………………………………viii Índice General ……………………………………………………………………...x Índice de Tablas …………………………………………………………………..xii Índice de Figuras ………………………………………………………………....xiv Índice de Diagramas……………………………………………………………....xvi CAPITULO 1 ............................................................................................................ 1 Fundamentos de Investigación .................................................................................. 1 1.. Fundamentos de Investigación ............................................................. 2 1.1. Antecedentes ........................................................................................ 2. 1.2. Planteamiento del Problema ................................................................. 7. 1.3. Objetivos .............................................................................................. 8. 1.4. Justificación.......................................................................................... 9. 1.5. Hipótesis ............................................................................................. 10. 1.6. Variables ............................................................................................ 10. CAPITULO 2 .......................................................................................................... 12 Marco Teórico ......................................................................................................... 12 2.. Marco Teórico .................................................................................... 13 2.1. Aguas subterráneas ............................................................................. 13. 2.2. Ciclo del agua subterránea ................................................................. 13. 2.3. Cantidad de Agua subterránea............................................................ 15. 2.4. Calidad de agua subterránea ............................................................... 21. 2.5. Contaminación de aguas subterráneas ............................................... 21. 2.6.. Contaminación de Boro ...................................................................... 22. 2.7.. Boro .................................................................................................... 23. 2.8. Marco legal......................................................................................... 33. 2.9. Métodos de depuración de Boro ........................................................ 39. 2.10.. Cuantificación de Boro ...................................................................... 46. 2.11.. Adsorción ........................................................................................... 48. 2.12. Dióxido de titanio ............................................................................... 62 x.
(11) CAPITULO 3 .......................................................................................................... 64 Planteamiento Experimental.................................................................................... 64 3.. Planteamiento Experimental .............................................................. 65 3.1. Localización ....................................................................................... 65. 3.2. Materiales y métodos ......................................................................... 65. 3.3. Parte experimental .............................................................................. 66. 3.4. Diseño experimental........................................................................... 80. CAPITULO 4 .......................................................................................................... 85 Análisis y Discusión de Resultados ......................................................................... 85 4.1. Presentación de resultados ................................................................. 86. 4.2. Discusión de resultados ...................................................................... 90. 4.2.1. Capacidad de adsorción y Porcentaje de remoción para Boro ........... 90. 4.2.2. Isotermas de adsorción ....................................................................... 95. 4.2.3. Estudio de la Cinética de adsorción ................................................. 102. 4.2.1. Análisis de Diseño Factorial en Minitab .......................................... 109. ANALISIS ECONÓMICO.................................................................................... 119 ANÁLISIS ECONÓMICO DEL PROYECTO ........................................................ 120 Costos de equipo ................................................................................................... 120 Reactivos ............................................................................................................... 120 Otros costos ........................................................................................................... 121 Evaluación económica........................................................................................... 121 Financiamiento ...................................................................................................... 121 CONCLUSIONES ................................................................................................. 122 RECOMENDACIONES ....................................................................................... 125 BIBLIOGRAFIA ................................................................................................... 127 ANEXOS ............................................................................................................... 131 ANEXO I: MUESTREO DE AGUAS SUBTERRANEAS .................................. 132 ANEXO II: CERTIFICADO DE ANALISIS DE CURCUMINA P.A. ............... 134 ANEXO III: CERTIFICADO DE ANALISIS DE DIOXIDO DE TITANIO. ..... 135 ANEXO IV: INFORME DE ENSAYO: 72150/2018 ........................................... 137 ANEXO V: RESULTADOS DE ANALISIS DE MUESTRAS SINTEICAS DE BORO .................................................................................................................... 143. xi.
(12) INDICE DE TABLAS Tabla 1 Distribución y cantidad de agua subterránea en el Perú en las diferentes regiones hidrográficas ...................................................................................... 16 Tabla 2 Ríos subterráneos en el Perú ............................................................................. 17 Tabla 3 Distribución de los pozos por distritos en Arequipa ......................................... 18 Tabla 4 Distribución de los pozoz según su estado, subcuenca Chili ............................ 19 Tabla 5 Distribución de los pozoz según su uso, subcuenca Chili ................................. 20 Tabla 6 Propuesta de Estándares de Calidad Ambienta para Aguas Subterráneas ........ 35 Tabla 7 Estándares de la calidad de agua potable en los paises de América .................. 36 Tabla 8 Subcategoría A: Aguas superficiales destinadas a la producción de agua potable. 37 Tabla 9 Subcategoría B: Aguas superficiales destinadas para recreación. ......................... 37 Tabla 10 Categoría 2: Extracción, cultivo y otras actividades marino costeras y continentales. ..................................................................................................... 38 Tabla 11 Categoría 3: Riego de vegetales. ....................................................................... 38 Tabla 12 Métodos de depuración para boro...................................................................... 40 Tabla 13 Comparación de métodos de eliminación de boro. ............................................. 45 Tabla 14 Tipos de isotermas de adsorción ........................................................................ 57 Tabla 15 Valores de RL para determinar el proceso de adsorción...................................... 60 Tabla 16 Propiedades físicas de dióxido de Titanio .......................................................... 62 Tabla 17 Matriz de análisis de variables .......................................................................... 82 Tabla 18 Niveles de la experimentación........................................................................... 83 Tabla 19 Matriz del diseño experimental para muestra de aguas subterráneas. ................. 84 Tabla 20 Concentraciones y volúmenes para la preparación de la curva de calibración .... 87 Tabla 21 Curva de calibración para Boro ......................................................................... 87 Tabla 22 Resultados de la concentración final de Boro en muestras de agua subterránea. . 89 Tabla 23 Capacidad de adsorción (Qe) y porcentaje de remoción (%R) para Boro en muestras de aguas subterráneas .......................................................................... 92 Tabla 24 Agrupamiento de datos según el pH. ................................................................. 93 Tabla 25 Cálculos para graficar la isotermas de adsorción de Langmuir al término del tiempo de agitación. ........................................................................................... 95 Tabla 26 Parámetros de la isoterma de Langmuir para muestras de agua subterránea según el gráfico 34....................................................................................................... 97 Tabla 27 Cálculos para graficar la isotermas de adsorción de Freundlich al término del tiempo de agitación. ........................................................................................... 99 Tabla 28 Constantes de la isoterma de Freundlich para muestra de agua subterránea. ..... 101 Tabla 29 Calculo de capacidad de adsorción (Qe) durante 45 minutos de agitación para la evaluación del efecto de las variables ............................................................... 103 Tabla 30 Análisis de Varianza en software Minitab 17................................................... 112 Tabla 31 Coeficientes codificados ................................................................................. 113 Tabla 32 Análisis de Varianza modelo lineal general en software Minitab 17 ................ 117 Tabla 33 Coeficientes ................................................................................................... 117 Tabla 34 Materiales y costos para la reparación del equipo de prueba de jarras. ............. 120 xii.
(13) Tabla 35 Relación de reactivos utilizados ...................................................................... 120 Tabla 36 Relación de costos adicionales. ....................................................................... 121 Tabla 37 Evaluación económica del proyecto de investigación ...................................... 121. xiii.
(14) INDICE DE FIGURAS Figura 1. Ciclo de producción de las aguas subterráneas. ............................................. 14 Figura 2. Distribución total de agua .............................................................................. 15 Figura 3. Distribución de Agua Dulce. .......................................................................... 15 Figura 4. Contaminación de Aguas Subterráneas.......................................................... 22 Figura 5. Unión de dos icosaedros por dos vértices, mediante enlaces covalentes normales B – B. .............................................................................................. 26 Figura 6. Unión de tres icosaedros por tres vértices, mediante un enlace de tres centros con dos electrones. ......................................................................................... 26 Figura 7. Estructura química de la curcumina. .............................................................. 46 Figura 8. Estructura molecular del Complejo Rosacianina (a.), Rubrocurcumina (b.) y Curcumina (c.) ............................................................................................... 47 Figura 9. Diferencia en adsorción, absorción y sorción. ............................................... 49 Figura 10. Estructura geométrica molecular para cada forma de cristalización del dióxido de titanio (anatasa, rutilo y brookita). ............................................................ 63 Figura 11. Ubicación geografía de la zona de estudio................................................... 65 Figura 12. Muestra para el análisis correspondiente. .................................................... 67 Figura 13. Dióxido de Titanio ....................................................................................... 67 Figura 14. Pesos de Dióxido de Titanio de 0,5; 1,0 y 1,5 gramos. ................................ 68 Figura 15. Agregando el Dióxido de Titanio a agua subterránea. ................................ 68 Figura 16. Ajuste del pH a las muestras. ....................................................................... 69 Figura 17. Procedimiento experimental software equipo de jarras. .............................. 69 Figura 18. Equipo de Prueba de Jarras. ......................................................................... 70 Figura 19. Muestras para determinar boro. ................................................................... 70 Figura 20. Filtros de jeringa de 0.45um ........................................................................ 70 Figura 21. Peso de curcumina ....................................................................................... 72 Figura 22. Peso de ácido oxálico ................................................................................... 72 Figura 23. Ácido Clorhídrico ........................................................................................ 72 Figura 24. Peso del ácido bórico ................................................................................... 73 Figura 25. Soluciones estándar de Boro ....................................................................... 74 Figura 26. Curva de calibración para Boro ................................................................... 75 Figura 27. Análisis de curcumina .................................................................................. 75 Figura 28. Curva de calibración para Boro después de la evaporación......................... 76 Figura 29. Curva de calibración para Boro, reconstitución del residuo con alcohol 96º ................................................................................................................ 76 Figura 30. Curva de calibración para Boro ................................................................... 77 Figura 31. Curva de calibración para boro. ................................................................... 88 Figura 32. Capacidad de adsorción (Qe) con respecto a la Concentración final (Ce) a pH 10 (recta anaranjada), 8 (recta azul) en muestra de aguas subterráneas. 93 Figura 33. Porcentaje de remoción (%R) con respecto a la Concentración final (Ce) a pH 10 (recta anaranjada), 8 (recta azul) en muestra de agua subterránea. .. 94. xiv.
(15) Figura 34. Isoterma de Langmuir para 0,5g de TiO2 (recta azul) y 1,5 g de TiO2 (recta anaranjada) ................................................................................................... 96 Figura 35. Isoterma de Freundlich para 0,5g de TiO2 (recta azul) y 1,5 g de TiO2 (recta anaranjada) ................................................................................................. 100 Figura 36. Efecto de la cantidad de adsorbente 0,5g de TiO2 (curva azul), 1.0g de TiO2 (curva anaranjada) y 1.5g de TiO2 (curva ploma) a pH 8, 9 y 10 en función del tiempo de agitación. ............................................................................. 105 Figura 37. Efecto pH 8 (curva azul), 10 (curva anaranjada) y 9 (curva ploma) a masas de TiO2 de 0,5g; 1,0g y 1,5g en función del tiempo de agitación. ............ 106 Figura 38. Grafica de la cinética de adsorción para Boro en aguas subterráneas con Dióxido de Titanio como adsorbente. ........................................................ 108 Figura 39. Grafica normal de efectos para la Concentración final (Ce). ..................... 114 Figura 40. Diagrama de Pareto de efectos para la concentración final (Ce). .............. 115 Figura 41. Grafica de probabilidad de la Concentración final (Ce). ........................... 116 Figura 42. Gráfica de efectos principales para Concentración Final (Ce). ................. 118. xv.
(16) INDICE DE DIAGRAMAS Diagrama 1. Interrelación entre compuestos: reducciones. Se observa las relaciones y procesos de obtención de alguno de estos compuestos a partir del óxido de boro. .... 25 Diagrama 2: Interrelación entre compuestos. Se observa las interrelaciones de los distintos compuestos y procedimientos para la obtención de ácido bórico. ................... 29 Diagrama 3. Diagrama equilibrio Potencial – pH para el sistema boro – agua, a 25 ªC, para soluciones de concentración 10-2, 10-4, 10-6 g de B/l. ......................................... 31 Diagrama 4. Procedimiento para el uso del espectrofotómetro UV. ............................. 79 Diagrama 5. Procedimiento experimental software Minitab 17. ................................ 111. xvi.
(17) xvii.
(18) “El conocimiento descansa no solo sobre la verdad sino también sobre el error” Carl Jung. xviii.
(19) CAPITULO 1. Fundamentos de Investigación. CAPITULO 1 Fundamentos de Investigación. 1.
(20) CAPITULO 1. Fundamentos de Investigación 1. Fundamentos de Investigación 1.1 Antecedentes La calidad de aguas subterráneas refleja los aportes desde la atmosfera, el suelo y las relaciones agua-roca, así como también desde fuentes de contaminación como minas, áreas despejadas, agricultura, lluvias acidas, residuos domésticos industriales (Sevillano G., 2017) . El agua subterránea fluye a través de los materiales porosos saturados del subsuelo hacia niveles más bajos que los de infiltración y puede volver a surgir naturalmente como manantiales y caudal de base de los ríos. La mayoría de estos devuelve el agua a los mares o la lleva a cuencas cerradas donde se evapora.. De esta manera, el agua subterránea representa una fracción importante de la masa de agua presente en cada momento en los continentes. Se encuentran almacenadas en acuíferos, ubicados a diferentes niveles de profundidad, hasta sistemas confinados que están a varios kilómetros por debajo de la superficie. Se pueden encontrar aguas subterráneas en casi cualquier parte, trátese de zonas húmedas, áridas o semiáridas. El agua del subsuelo es un recurso importante, pero de difícil gestión, por sus sensibilidad a la contaminación y a la sobreexplotación. (Envirosoil, 2018).. Estudios realizados por INGEMMET, revelan que en Cerro Colorado hay agua a 15 metros de profundidad, mientras que en Characato, Sabandía y Socabaya está a tres metros de profundidad.. 2.
(21) CAPITULO 1. Fundamentos de Investigación Según INGEMMET el 24% de la población nacional recurre a la capa freática para satisfacer su consumo y el 66% de estas aguas se derivan al agro.. El boro se encuentra ampliamente distribuido en minerales de la corteza terrestre, ocupando el lugar 51 en la lista de los elementos más comunes en la corteza terrestre con una concentración promedio de 8 mg/kg (0.0008%), de forma natural en aguas subterráneas como boratos, en el medio ambiente combinado principalmente con oxígeno formando compuestos llamados boratos (Edmunds, 2004).. La mayor exposición al boro de la población es mediante el consumo de alimentos. Estudios en animales de laboratorio revelan que las exposiciones tanto breves como prolongadas al ácido bórico o al bórax causan toxicidad para el aparato reproductor masculino, no son genotóxicos (Ciencias Naturales, s.f.).. Cuando los humanos consumen grandes cantidades de comida que contiene Boro, la concentración de Boro en sus cuerpos puede aumentar a niveles causando erupciones en la piel, náuseas vómitos (puede ser de color azul verdoso), diarrea (puede ser de color azul verdoso), dolores abdominales y de cabeza. Se ha informado de baja presión arterial y cambios metabólicos en la sangre (acidosis). También puede aparecer agitación o la reacción opuesta (debilidad, agotamiento, depresión) y se ha detectado fiebre, hipertermia, temblores y ataques.. 3.
(22) CAPITULO 1. Fundamentos de Investigación El boro en agua se encuentra en forma de anión borato, soluto muy difícil de remover mediante métodos tradicionales de desalinización. Los métodos actuales para la remoción de boro del agua son de alto costo, impidiendo su uso en agricultura y encarece el uso para agua potable. Osmosis inversa, es el método más utilizado para la desalinización del agua por su relativo costo menor, sin embargo este método no remueve más del 50% del boro presente. (Nable, Bañuelos, & Paull, 1997). López P., Alarcón H. y Apolinar C.; investigadores de México en el área de medio ambiente, realizaron estudios de investigación de la caracterización del dióxido de titanio como removedor de arsénico trivalente del agua subterránea para consumo humano, a través de mecanismos de adsorción. Realizaron el análisis experimental con una solución de 100ug/L de As (III), variando las dosis de dióxido de titanio de 0.1 y 1.7 g/L con agitación constante de 150rpm, teniendo como parámetros pH y temperatura. Los resultados obtenidos fueron que es suficiente emplear 1.2g/L de TiO2 y 23min de agitación, la capacidad máxima de adsorción del material fue de 245 ug/g.. Chillón A. María. (2009), realizo el estudio de la reducción de boro en agua procedentes de la desalación evaluando el comportamiento de tres membranas de aguas salobres y de tres resinas de intercambio iónico específicas para la eliminación de boro de diferentes fabricantes. Comparándose los resultados, ambos procesos pueden ser validos desde un punto de vista técnico y económico. La ventaja que presenta el uso de resinas frente a las membranas es la flexibilidad del sistema, permitiendo reducir. 4.
(23) CAPITULO 1. Fundamentos de Investigación boro por debajo del límite de detección; como desventaja, las resinas de intercambio iónico no resulta ser un proceso tan estable como la osmosis inversa, presentando fluctuaciones más acusadas frente a la temperatura y requiriendo un control exhaustivo ya que en caso de que la regeneración no se realice de forma adecuada, se reduce considerablemente el ciclo y puede aparecer boro en el agua tratada.. Paredes R. Juan (2012), realizo la investigación de remoción de arsénico del agua para uso y consumo humano mediante diferentes materiales de adsorción. En el trabajo de investigación se utilizaron dos tipos de agua: sintética y natural; para la sintética, se preparó una solución con arsenato de sodio heptahidratado y agua desionizada, con una concentración de As de 0.22 mg/L, y para el agua natural, se recolectó de Huautla, Morelos. Se emplearon 3 tipos de adsorbentes (Dióxido de titano, Goethita y pectina de maracuyá). Se llevaron a cabo los experimentos para obtener las cinéticas e isotermas de adsorción de acuerdo a modelos conocidos. Los resultados mostraron, en cuanto a las cinéticas de adsorción, que fueron de pseudosegundo orden con valores de sus velocidades de adsorción de arsénico, kad de: Dióxido de titanio - 0.652; Goethita - 7.409; maracuyá: pectina ácida 2.107; pectina alcalina - 0.550 g/mg min. En cuanto a las isotermas de adsorción, los datos experimentales se ajustaron al modelo de Freundlich con coeficientes de determinación (R 2) entre 0.7992 a 0.9938. Las constantes de capacidad de adsorción, KF, obtenidas son: Dióxido de titanio – 6.960; Goethita – 12.27; maracuyá: pectina ácida – 2.08; pectina alcalina – 2.032.. 5.
(24) CAPITULO 1. Fundamentos de Investigación Heredia Angélica et al. (2017), realizaron la investigación de boro en agua empleando óxidos mixtos con metales alcalinotérreos sintetizados a partir de hidróxidos dobles laminares; la remoción de Boro se llevó a cabo en un reactor Batch bajo agitación magnética durante 0,5h y luego 4h de reposo. La concentración inicial de la solución de ácido bórico fue 50 ppm, al finalizar cada experimento el sólido se separa del medio por filtración. La cuantificación del contenido de Boro en la solución antes y después del contacto con los óxidos se llevó a cabo por espectrofotometría de UV-Vis con Azometina H como reactivo colorimétrico. La muestra de Mg-Al removió el 82% de Boro mientras que las incorporadas con Ba y Ca presentaron el 63% y 44% respectivamente, estos resultados están directamente relacionados con las áreas superficiales de los óxidos y la capacidad de reconstrucción de la estructura laminar. La incorporación de un tercer metal alcalinotérreo, disminuyó el área superficial y la adsorción del oxianión en la intercapa.. También se han desarrollado métodos convencionales, como el tratamiento con sales de hierro, sulfato de aluminio y cal. Se describe un proceso para eliminar los iones de boro y de fluoruro del agua, poniendo en contacto el agua de la fuente de alimentación, en presencia de magnesio con hidróxido alcalino para producir agua tratada y un precipitado de magnesio que contiene boro y flúor. (Parks & Edwards, 2005). El método más utilizado para la eliminación del Boro son las resinas de intercambio iónico, que consiste poniendo en contacto la solución acuosa que. 6.
(25) CAPITULO 1. Fundamentos de Investigación contiene los iones de borato con una resina fenólica de intercambio aniónico insoluble en medio acuoso, en presencia de al menos una especie catiónica seleccionada del grupo de alcalinos, alcalino térreos, bases orgánicas nitrogenadas y cationes de amonio. (Voutchkov, 2005) También existe un procedimiento para eliminar el anión borato de medios acuosos utilizando azúcares anclados a una resina de tipo inorgánico. (Hancco Conza, 2018) La OMS del 2006 en su Tercera Edición la OMS propone un valor máximo de 0,05 mg/L para el boro. Este valor de referencia se designa como provisional porque con las técnicas de tratamiento disponibles será difícil alcanzarlo en zonas con concentraciones naturales de boro elevadas. 1.2 Planteamiento del Problema. El boro al ser un elemento ubicuo que entra en las aguas superficiales y subterráneas a través de dos vías: intemperismo de rocas que contienen boro y aguas residuales donde el boro se deriva de productos de limpieza y residuos industriales de pinturas, textiles, curtido de pieles. El boro se produce en forma natural al ser liberado desde la corteza terrestre a través de la erosión e infiltración hacia los cuerpos de agua; es decir, no es posible detener su aparición y cuando supera los límites permisibles tiene relevancia en los estudios de calidad del agua debido a su toxicidad tanto en animales como en plantas cultivadas y en el ser humano. Existen en nuestra ciudad empresas que usan agua del subsuelo para la producción de bebidas alcohólicas y no alcohólicas, también población que la usa para consumo doméstico de forma directa. Las aguas subterráneas además son la única reserva para el abastecimiento de agua para la población y es 7.
(26) CAPITULO 1. Fundamentos de Investigación utilizada cuando no es posible potabilizar agua del rio, a causa de huaicos, sequias o terremotos, o sencillamente cuando no existe otra fuente inmediata. En consecuencia existe el riesgo de ingesta de Boro con los consiguientes daños en salud humana u otro impacto en flora y fauna. Si bien es cierto que se tiene algunas referencias sobre la presencia de boro en el manto acuífero del Distrito de Socabaya, se desconoce el nivel de contaminación por boro en estas aguas de subsuelo y es necesario determinar ese impacto. En el tratamiento propuesto de remoción de boro utilizando como medio adsorbente dióxido de titanio, en un sistema batch, se desconoce el efecto de las variables relación de masa adsorbente a concentración de boro, pH y tiempo de agitación y la correlación entre ellas que maximicen la remoción de boro de las aguas del subsuelo que lo contienen. 1.3 Objetivos. 1.3.1 Objetivo general Evaluación del dióxido de titanio como adsorbente, para remover boro presente en aguas subterránea del manto acuífero del distrito de Socabaya. 1.3.2 Objetivos específicos Determinar el nivel de boro en aguas de subsuelo del manto acuífero del Distrito de Socabaya, estimando con los resultados el impacto contaminante. Evaluar el efecto de las variables implicadas tales como la influencia de pH, tiempo de agitación, cantidad de material adsorbente; en el 8.
(27) CAPITULO I. Fundamentos de Investigación proceso de remoción de boro con dióxido de titanio; en aguas subterráneas del manto acuífero del distrito de Socabaya. Establecer la isoterma de adsorción que exprese el mecanismo del proceso fisicoquímico. 1.4 Justificación 1.4.1. Ambiental Usualmente el agua subterránea disponible está expuesta a diversos factores que afectan su calidad como el abatimiento de los mantos freáticos (frecuente en zonas con sequías recurrentes), infiltración de contaminantes desde la superficie (aguas residuales, basura, fertilizantes, etc.) y la contaminación por disolución de rocas ricos en metales pesados, lo que la hace no apta para el consumo humano y regadío; y en el presente caso por presentar concentraciones elevadas de boro fuera de los estándares de calidad para aguas subterráneas. Estos antecedentes justifican el estudio de la presencia de contaminantes en la fuente de agua cualesquiera que fueran sus fuentes.. 1.4.2. Tecnológica Actualmente existen diversos procesos para remover el Boro del agua; sin embargo, las tecnologías más eficientes tienen costos de inversión, operación y mantenimiento elevados. Se tiene como referencia que el agua subterránea proveniente de la zona de Socabaya en la ciudad de Arequipa presenta niveles de Boro que superan los límites máximos permisibles; por ello es preciso plantear soluciones de bajo costo, que sean innovadoras y 9.
(28) CAPITULO I. Fundamentos de Investigación eficientes, siempre buscando cumplir con los exigentes niveles de calidad que indican las normas locales e internacionales. El proceso de adsorción empleando Dióxido de Titanio para la remoción de Boro, se convertiría en un técnica innovadora que ofrece muchas ventajas puesto que es una alternativa entre los tratamientos como la osmosis inversa y la micro filtración. 1.5 Hipótesis . La remoción de boro de aguas subterráneas será factible empleando dióxido de titanio como material adsorbente, constituyendo así una alternativa eficiente para el tratamiento de agua en conjunto con los factores que determinaran la adsorción de boro.. 1.6 Variables 1.6.1. Variables Independientes Cantidad de adsorbente Miriam Z. Lopez Parguay, estudió la remoción de arsénico III del agua usando óxido de titanio IV como medio adsorbente estableciendo las dosis de dióxido de titanio de 0.1 y 1.7 g con agitación constante de 150 rpm. La importancia de esta variable es fundamental con el fin de evitar un consumo excesivo de dióxido de titanio que pueda encarecer el proceso sin lograr un aumento significativo en el rendimiento de la adsorción. Tiempo de agitación. Miriam Z. Lopez Parguay, en su estudio demuestra que se logra remover el 92% de As+3, usando dosis de 1,5 g de TiO2 y 54 10.
(29) CAPITULO I. Fundamentos de Investigación minutos de agitación y para obtener agua de consumo humano es suficiente con emplear 1.2 g de TiO2 y 23 minutos de agitación. La consideración de la agitación es mantener una suspensión de dióxido de titanio brindando la máxima superficie para la adsorción de boro en forma de ion borato. pH. García-Soto 2000 removió boro en vertidos industriales usando hidróxido de magnesio logrando remover 95.38% de boro a pH de 10. La especie del boro esta principalmente controlada por el pH, de manera que en el rango de valores de pH normales en aguas naturales la especie dominante es el ácido bórico. Si aumenta su alcalinidad, la ionización del ácido bórico conduce a la formación del ion borato. (Lopez-Geta, 2005). La reacción principal de ácidobase del ácido bórico / ion borato, es posible sólo a pH básicos donde predomina el ion borato. (García M., 2000) 1.6.2. Variables dependientes Porcentaje de Remoción de Boro. 1.6.3. Parámetros Concentración de Boro determinado en las aguas subterráneas del manto freático en estudio. Temperatura ambiente Tamaño de partícula del dióxido de titanio, utilizado como adsorbente.. 11.
(30) CAPÍTULO 2. Marco Teórico. CAPITULO 2 Marco Teórico. 12.
(31) CAPÍTULO 2. Marco Teórico 2. Marco Teórico 2.1. Aguas subterráneas El primer filósofo griego en hablar del agua fue Tales de Mileto, quien la consideraba como el origen de todas las cosas. Hoy en día, pensamos solo en el agua superficial, pero una gran cantidad de agua se encuentra almacenada en acuíferos, terrenos rocosos permeables localizados bajo la superficie por donde circula el agua: Esto se le conoce como agua subterránea. (Sevillano G., 2017) El agua es un recurso natural vital para el desarrollo humano y para la propia supervivencia de todas las especies que habitan en el planeta. El ser humano sólo puede beber agua dulce (menos abundante que la salada). Parte de ella está en los acuíferos de agua subterránea, que representan el 30 % el agua dulce de todo el mundo. Además de ser importante para el consumo, este tipo de agua es sumamente importante para el riego y la industria. También es importante para el medioambiente, ya que el agua fluye en ríos y humedales, recargando el agua subterránea. (Envirosoil, 2018). Existen dos tipos de fuentes de agua subterránea:. 2.2. . Naturales, representado por los manantiales.. . Artificiales, representado por los pozos y cochas.. Ciclo del agua subterránea La producción de las aguas subterráneas forma parte del ciclo hidrológico, las aguas subterráneas están enlazadas con el ciclo hidrológico, mediante el escurrimiento subterráneo; es decir, el proceso por el cual la parte de 13.
(32) CAPÍTULO 2. Marco Teórico agua precipitada se infiltra y llega a la zona saturada, recargando los acuíferos. Casi toda el agua subterránea existente en la tierra tiene origen en el ciclo hidrológico, que es el sistema por el cual el agua circula desde océanos y mares hacia la atmósfera y de allí hacia los continentes, donde retorna superficial o subterráneamente a los mares y océanos. Como parte de dicho ciclo, el agua que cae de la precipitación pluvial tiene tres destinos: el primero, los ríos y quebradas, alimentando las aguas superficiales; el segundo, la evaporación y/o evapotranspiración (plantas); y el tercero, la infiltración entre las fracturas y poros de las rocas, circulando en profundidad hasta formar los reservorios acuíferos. (28). Figura 1. Ciclo de producción de las aguas subterráneas. Fuente: SUNASS. (2017). Nuevo régimen especial de monitoreo y gestión de uso de aguas subterráneas a cargo de las EPS. El ciclo hidrológico es el responsable de las condiciones moderadas y favorables de temperatura que prevalecen en la tierra a través de su conexión con el ciclo atmosférico global.. 14.
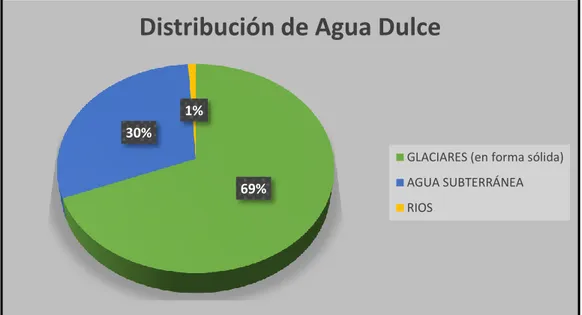
(33) CAPÍTULO 2. Marco Teórico 2.3. Cantidad de Agua subterránea Se estima que el volumen total de agua contenido en la hidrósfera es de 1386 millones de Km3.. Distribución del Agua 3.50%. OCEANOS (Agua salada) AGUA DULCE (proveniente del continente). 96.50%. Figura 2. Distribución total de agua Fuente: Introducción al monitoreo de aguas. Ing. Jose Daniel Vizcarra Llerena. INAGEP. Del 3.5% de agua dulce se tiene que:. Distribución de Agua Dulce 1% 30% GLACIARES (en forma sólida). 69%. AGUA SUBTERRÁNEA RIOS. Figura 3. Distribución de Agua Dulce. Fuente: Introducción al monitoreo de aguas. Ing. Jose Daniel Vizcarra Llerena. INAGEP. 15.
(34) CAPÍTULO 2. Marco Teórico 2.3.1. Agua subterránea en el Perú Tabla 1 Distribución y cantidad de agua subterránea en el Perú en las diferentes regiones hidrográficas. Región hidrográfica. Total (Hm3). Agua. Agua. Número de unidades. superficial subterránea (Hm3). (Hm3). hidrográficas. Extensión (km2). Cuencas Intercuencas. Total. 1768172 1765323. 2849. 159. 70. 1285215,60. Pacífico. 38481. 2849. 62. 65. 278482,44. Amazonas. 1719814 1719814. -. 84. -. 957822,52. Titicaca. 9877. -. 13. 5. 48910,64. 35632. 9877. Fuente: Autoridad Nacional del Agua (ANA) Muchos investigadores señalan que el Perú está sobre “un colchón de agua”, esto debido a que posee una gran cantidad de recursos subterráneos de lo cual la mayor cantidad de reservas se encuentran en la Selva.. 16.
(35) CAPÍTULO 2. Marco Teórico Tabla 2 Ríos subterráneos en el Perú. Ubicación. Ríos subterráneos. Orígenes. Callao - Ventanilla. 5. -. Lima - Huarochirí. 6. -. Lima – Nuevo Cañete. 18. -. Ica – Villa Curi. 31. -. Ica - Huacachina. 3. -. Ica – Pampa Los Gamonales. 35. 1. Palpa – Santa Cruz. 25. 6. -. 1. 24. -. -. 1. Caraveli - Chala. 17. -. Arequipa - Majes. 15. 1. Moquegua – Pampa Clemsi. 17. -. Tacna. 19. -. Nasca - Socos Nasca – San Juan de Marcona Caraveli – Yauca - Jaqui. Fuente: J. Baca (2018). Recursos hídricos subterráneos en el Perú. 2.3.2. Agua subterránea en la ciudad de Arequipa El inventario de pozos integral de la subcuenca del rio Chili realizado por el IRENA en el año 2002, en los distritos de Cerro Colorado, Pachacútec, Tiabaya, Sachaca, Yanahuara, Arequipa, Socabaya y Yarabamba. El total de pozos inventariados ascienden a 645 pozos; sin embargo, según algunos reportes del ALA Arequipa, actualmente la cantidad de pozos se ha incrementado. El inventario de pozos muestra que en la Zona de estudio, Socabaya, se encuentran 31 pozos. 17.
(36) CAPÍTULO 2. Marco Teórico Tabla 3 Distribución de los pozos por distritos en Arequipa. Distrito. Nº Pozos. Cerro Colorado. 408. Sachaca. 44. Tiabaya. 96. Arequipa. 14. Jacobo D. Hunter. 4. Cayma. 2. José Luis Bustamante y R.. 1. Quequeña. 1. Socabaya. 31. Yanahuara. 16. Yarabamba. 22. Sabandía. 1. Yura. 5 Total. 645. Fuente: IRENA (2002). Perímetros de protección de manantiales en la zona oriental de Arequipa. En la tabla 4 indica que hasta el 2002 existía alrededor de un 96% de pozos entre utilizables y utilizados lo que demuestra la gran demanda que existe por el agua subterránea en la ciudad de Arequipa.. 18.
(37) CAPÍTULO 2. Marco Teórico Tabla 4 Distribución de los pozos según su estado, subcuenca Chili.. Distrito. Utilizado N°. %. Utilizable N°. %. No Utilizable N°. %. Total N°. %. Cerro Colorado. 186. 28,84. 202. 31,32. 20. 3,10 408. 63,26. Sachaca. 34. 5,27. 7. 1,09. 3. 0,47. 44. 6,83. Tiabaya. 92. 14,26. 4. 0,62. 0. 0,00. 96. 14,88. Arequipa. 11. 1,70. 3. 0,47. 0. 0,00. 14. 2,17. Jacobo D. Hunter. 3. 0,47. 1. 0,16. 0. 0,00. 4. 0,62. Cayma. 2. 0,31. 0. 0,00. 0. 0,00. 2. 0,31. José L. Bustamante y R.. 1. 0,16. 0. 0,00. 0. 0,00. 1. 0,16. Quequeña. 0. 0,00. 1. 0,16. 0. 0,00. 1. 0,16. Socabaya. 21. 3,25. 9. 1,39. 1. 0,16. 31. 4,80. Yanahuara. 12. 1,86. 4. 0,62. 0. 0,00. 16. 2,48. Sabandía. 1. 0,16. 0. 0,00. 0. 0,00. 1. 0,16. Yarabamba. 12. 1,86. 10. 1,55. 0. 0,00. 22. 3,41. Yura. 3. 0,47. 2. 0,31. 0. 0,00. 5. 0,78. Total. 378. 58,60. 243. 37,67. 24. 3,72 645. 100,00. Fuente: IRENA (2002). Perímetros de protección de manantiales en la zona oriental de Arequipa. En la subcuenca del río Chili, la explotación de los pozos, en su mayoría son utilizados en la agricultura, seguido del uso doméstico, pecuario y finalmente el uso Industrial tal como se detalla en la tabla 5, donde 11 pozos en el Distrito de Socabaya son destinados para uso doméstico.. 19.
(38) CAPÍTULO 2. Marco Teórico Tabla 5 Distribución de los pozos según su uso, subcuenca Chili Doméstico. Agrícola. Pecuario. Industrial. Total. Distrito Nº. %. Cerro Colorado. 21. 5,55. Sachaca. 25. Tiabaya. %. Nº. %. 154. 40,74. 6. 1,59. 5. 1,32 186 49,21. 6,61. 4. 1,06. 0. 0,00. 5. 1,32. 34. 8,99. 66. 17,46. 23. 6,08. 2. 0,53. 1. 0,26. 92. 24,34. Arequipa. 1. 0,26. 3. 0,79. 0. 0,00. 7. 1,85. 11. 2,91. Jacobo D. Hunter. 1. 0,26. 1. 0,26. 1. 0,26. 0. 0,00. 3. 0,79. Cayma. 0. 0,00. 1. 0,26. 0. 0,00. 1. 0,26. 2. 0,53. José L. Bustamante y R.. 0. 0,00. 0. 0,00. 0. 0,00. 1. 0,26. 1. 0,26. Quequeña. 0. 0,00. 0. 0,00. 0. 0,00. 0. 0,00. 0. 0,00. Socabaya. 11. 2,91. 7. 1,85. 3. 0,79. 0. 0,00. 21. 5,55. Yanahuara. 4. 1,06. 4. 1,06. 3. 0,79. 1. 0,26. 12. 3,17. Sabandía. 1. 0,26. 0. 0,00. 0. 0,00. 0. 0,00. 1. 0,26. Yarabamba. 7. 1,85. 5. 1,32. 0. 0,00. 0. 0,00. 12. 3,17. Yura. 1. 0,26. 0. 0,00. 0. 0,00. 2. 0,53. 3. 0,79. 138. 36,51. 202. 53,44 15. 3,97. 23. 6,08 378 100,00. Total. Nº. Nº. %. Nº. %. Fuente: IRENA (2002). Perímetros de protección de manantiales en la zona oriental de Arequipa.. 20.
(39) CAPÍTULO 2. Marco Teórico 2.4. Calidad de agua subterránea. La calidad (química) del agua subterránea refleja los aportes desde la atmósfera, el suelo y las reacciones agua-roca (meteorización), así como también desde fuentes de contaminación tales como minas, áreas despejadas, agricultura, lluvias ácidas, residuos domésticos e industriales. El movimiento relativamente lento del agua a través del terreno indica que los tiempos de permanencia de las aguas subterráneas están generalmente dentro de órdenes de magnitud mayores que los de las aguas superficiales. (Edmunds, 2004). La disminución gradual de la calidad del agua en el Perú se debe a los vertidos sin tratar, especialmente de la industria minera ilegal (pequeña minería) y pasivos ambientales, pero también de municipalidades y agricultura. 2.5. Contaminación de aguas subterráneas. 2.5.1 Contaminación Natural: El agua subterránea contiene algunas impurezas, incluso si no está afectado por actividades humanas. Los tipos y concentraciones de impurezas naturales dependen de la naturaleza del material geológico a partir del cual se mueve el agua subterránea, y la calidad del agua de reposición. 2.5.2 Contaminación Agrícola: Los pesticidas, fertilizantes, herbicidas y residuos de animales son fuentes de contaminación de aguas subterráneas de origen agrícola.. 21.
(40) CAPÍTULO 2. Marco Teórico 2.5.3 Contaminación Industrial: La fabricación y servicios industriales tienen altas demandas de agua. La contaminación de las aguas subterráneas ocurre cuando el agua usada se devuelve a ciclo del agua sin tratar adecuadamente. 2.5.4 Contaminación Residencial: Los sistemas de aguas residenciales (sistemas sépticos, letrinas, pozos de drenaje para la recogida de aguas de lluvia, pozos de recarga de aguas subterránea) puede ser una fuente de gran cantidad de contaminantes. Si estas aguas residuales se localizan cerca de los pozos que alimentan las aguas de uso para beber pueden contaminarlas. (Ciencias Naturales, s.f.). Figura 4. Contaminación de Aguas Subterráneas Fuente: Aguas subterráneas. 2.6.. Contaminación de Boro Las mayores concentraciones de boro se encuentran en los sedimentos y la roca sedimentaria, particularmente, en los sedimentos marinos ricos en arcilla. Aunque menos frecuentes que los suelos deficientes, los suelos ricos en B son importantes porque en diferentes regiones del mundo causan grandes pérdidas de producción agrícola (Nable et al., 1997). En algunas 22.
(41) CAPÍTULO 2. Marco Teórico de estas regiones el B se encuentra en elevadas concentraciones de forma natural. Sin embargo, en otras aparece como consecuencia de actividades antropogénicas tales como la industria o la desalinización del agua (Parks & Edwards, 2005), una situación que se ve agravada por la presión urbanística y el turismo (Voutchkov, 2005). En la ciudad de Arequipa, aproximadamente treinta mil ciudadanos que viven en más de diez pueblos de la parte alta del distrito de Paucarpata y parte de Chiguata consumen agua contaminada con boro y hierro desde el año 2015 (Hancco Conza, 2018). OEFA analizó zona de influencia de proyecto Tía María para conocer estado previo a las operaciones, dando como resultado el agua del río supera límites de arsénico, boro y manganeso; y el suelo está salinizado por el riego (La Republica, 2018).. 2.7.. Boro. El boro fue identificado como elemento químico en 1824 por Jons Jakob Berzelius, presenta dos isótopos estables en la naturaleza con una masa atómica de 10 a 11. Es un elemento trivalente, metaloide y semiconductor que se localiza en el grupo IIIA de la tabla periódica y que presenta un pequeño átomo de numero atómico 5. El elemento libre se prepara en forma cristalina o amorfa. La forma cristalina es un sólido quebradizo, muy duro. Es de color negro azabache a gris plateado con brillo metálico. Una forma de boro cristalino es rojo. 23.
(42) CAPÍTULO 2. Marco Teórico brillante. La forma amorfa es menos densa que la cristalina y es un polvo que va del café castaño al negro (Power & Woods, 1997). 2.7.1. Propiedades Físicas y Químicas El boro es inodoro e insípido; es insoluble en agua, alcoholes y soluciones de álcalis; es soluble en ácido nítrico, sulfúrico y también en muchos metales fundidos como el aluminio, el calcio, el cobre, el hierro y el magnesio. Es difícil producir boro de una pureza elevada ya que posee un punto de fusión muy alto y es muy reactivo. Se comporta como un ácido de Lewis. El punto de fusión del boro es de 2300 ºC, su densidad es 2,34 g/cm3 y su dureza es de 9,3 en la escala de Mohs. El boro ocupa un puesto único en la Química Inorgánica. Existen cinco tipos de compuestos de boro; cada uno posee sus estructuras individualizadas y su propia sistemática química. Es el único elemento de su grupo que forma hidruros (boranos) y que se combina con elementos más electropositivos para dar boruros, en los que el boro actúa con número de oxidación -3. Los grupos mencionados son los siguientes: (Ravelo Polo, 2012) -. Boruros metálicos. -. Hidruros de boro y sus derivados. -. Trihaluros de boro, aductos y derivados. -. Oxo-compuestos: boratos, borosilicatos, peroxoboratos, etc.. -. Organoboranos y B-N compuestos 24.
(43) CAPÍTULO 2. Marco Teórico El grupo de los boruros presentan una gran variedad de estructuras y que poseen gran dureza y capacidad refractaria; los hidruros de boro o boranos; los haluros de boro y sus aductos que son muy reactivos; los nitruros y carburos de boro con propiedades de gran interés en la obtención de materiales especiales. ( De la Fuente García-Soto, 2000). Diagrama 1. Interrelación entre compuestos: reducciones. Se observa las relaciones y procesos de obtención de alguno de estos compuestos a partir del óxido de boro. Fuente: Garcia M. (2000). Diseño y desarrollo de un sistema de tratamiento para la eliminación de boro en vertidos industriales (tesis doctoral) Escuela Técnica de Ingenieros Industriales, Madrid. 2.7.2. Formación El Boro se forma en un proceso denominado astillamiento (spallation), que consiste en la rotura de núcleos más pesados que el boro a causa del bombardeo de rayos cósmicos. Al ser tan poco frecuente este proceso, la abundancia cósmica del boro es muy pequeña. 25.
(44) CAPÍTULO 2. Marco Teórico 2.7.3. Estructura El boro presenta multitud de formas alotrópicas que tienen como elemento estructural común un icosaedro regular. La ordenación de los icosaedros puede ser de dos formas distintas como se observa a continuación en la figura 3 y la figura 4.. Figura 5. Unión de dos icosaedros por dos vértices, mediante enlaces covalentes normales B – B. Fuente: Ravelo B. (2012). Adsorción de boro del agua (tesis de pregrado) Universidad Politécnica de Cataluña, Barcelona.. Figura 6. Unión de tres icosaedros por tres vértices, mediante un enlace de tres centros con dos electrones. Fuente: Ravelo B. (2012). Adsorción de boro del agua (tesis de pregrado) Universidad Politécnica de Cataluña, Barcelona.. Dentro de estas posibles uniones, en el boro cristalino los icosaedros pueden asociarse de varias maneras para originar los alótropos correspondientes: 26.
(45) CAPÍTULO 2. Marco Teórico Boro tetragonal (T - 50): formado por 50 átomos de boro por celdilla unidad, que son cuatro unidades icosaédricas unidas entre sí por algunos enlaces B - B y de dos boros elementales que actúan como unión tetraédrica entre icosaedros. Posee una densidad de 2,31 g/cm3. Boro romboédrico alfa (R - 12): está formado por láminas de icosaedros unidas paralelamente. Las uniones intralaminares se efectúan por medio de enlaces de tres centros, mientras que las uniones interlaminares se producen mediante enlaces de dos centros. La densidad de este tipo de boro es de 2,46 g/cm3, y presenta un color rojo claro. Boro romboédrico beta (R - 105): formado por doce icosaedros B12 ordenados en forma icosaédrica en torno a una unidad central de B12, es decir, B12(B12)12. Presenta una densidad de 2,35 g/cm3. (Ravelo Polo, 2012) 2.7.4. Obtención El boro en su forma circular no se encuentra en la naturaleza. La mayor fuente de boro son los boratos de depósitos evaporíticos, como el bórax y, con menos importancia, la colemanita. El boro también precipita como ácido ortobórico H3BO3 alrededor de algunas fuentes y humos volcánicos, dando sasolitas. También se forman menas de boro naturales en el proceso de solidificación de magmas silicatados; estos depósitos son las pegmatitas.. 27.
(46) CAPÍTULO 2. Marco Teórico 2.7.5. Boro en aguas subterráneas La presencia de boro en aguas subterráneas depende de su salinidad y el contenido de boro en las rocas asociadas. La adsorción de boro y retención por las arcillas está afectada por muchos factores: salinidad de las aguas, tipo de arcilla y cristalinidad, pH, temperatura, fuerza iónica de la solución y composición, ciclos de humedad y sequedad de la arcilla y presencia de sustancias orgánicas.. (López Geta, Pulido. Bosch, & Baquero Úbeda, 2005) El boro en la naturaleza se encuentra presente en aguas subterráneas en forma de ácido Bórico H3BO3 o disociado como oxianión borato B(OH)4- . (Heredia, Bálsamo, Fuente García-Soto, Narros Sierra, & Crivello, 2017) 2.7.6. Ácido bórico El ácido bórico se obtiene mediante la descomposición del mineral con ácido sulfúrico y separando el sulfato metálico subproducto mediante cristalización fraccionada.. 28.
(47) CAPÍTULO 2. Marco Teórico. Diagrama 2: Interrelación entre compuestos. Se observa las interrelaciones de los distintos compuestos y procedimientos para la obtención de ácido bórico. Fuente: Garcia M. (2000). Diseño y desarrollo de un sistema de tratamiento para la eliminación de boro en vertidos industriales (tesis doctoral) Escuela Técnica de Ingenieros Industriales, Madrid. 2.7.7 Aplicaciones El boro y sus compuestos tienen muchas aplicaciones en diversos campos, aunque el boro elemental se emplea principalmente en la industria metalúrgica por su gran reactividad a temperaturas altas, en particular con oxígeno y nitrógeno, lo hace útil como agente metalúrgico degasificante. Se utiliza para refinar el aluminio y facilitar el tratamiento térmico del hierro maleable. El boro incrementa de manera considerable la resistencia a alta temperatura, característica de las aleaciones de acero.. 29.
(48) CAPÍTULO 2. Marco Teórico El boro elemental se emplea en reactores atómicos y en tecnologías de alta temperatura. Las propiedades físicas que lo hacen atractivo en la construcción de misiles y tecnología de cohetes son su densidad baja, extrema dureza, alto punto de fusión y notable fuerza tensora en forma de filamentos. Cuando las fibras de boro se utilizan en material portador o matriz de tipo epoxi (u otro plástico), la composición resultante es más fuerte y rígida que el acero y 25% más ligera que el aluminio. El bórax, Na2B4O710H2O, refinado es un ingrediente importante en ciertas variedades de detergentes, jabones, ablandadores de agua, almidones para planchado, adhesivos, preparaciones para baño, cosméticos. Talcos y papel encerado. Se utiliza también en retardantes a la flama, desinfectantes de frutas y madera, control de hierbas e insecticidas, así como en la manufactura de papel, cuero y plásticos.. 2.7.8. Diagrama de Pourbaix El diagrama de potencial – pH o diagrama de Pourbaix nos va a proporcionar la visualización de reacciones que ocurren en un medio acuoso sin interponernos ante cálculos termodinámicos. Dado que los diagramas de Pourbaix describen solo la información de equilibrio, pueden indicar las direcciones de la reacción a partir de la termodinámica, pero no indican ninguna información cinética. Los diagramas de Pourbaix son solo una clase determinada de los diagramas de fase, lo que proporciona una útil descripción del potencial del electrodo versus pH.. 30.
(49) CAPÍTULO 2. Marco Teórico. Diagrama 3. Diagrama equilibrio Potencial – pH para el sistema boro – agua, a 25 ªC, para soluciones de concentración 10-2, 10-4, 10-6 g de B/l. 2.7.9. Toxicidad . Efectos sobre la salud Las plantas absorben Boro del suelo y a través del consumo de plantas por los animales este termina en la cadena alimentaria. El Boro ha sido encontrado en los tejidos animales pero este no parece ser que se acumule. Cuando los animales absorben grandes cantidades de Boro en un periodo de tiempo corto a través de la comida o el agua los órganos reproductivos masculinos serán afectados "toxicidad 31.
(50) CAPÍTULO 2. Marco Teórico testicular, baja motilidad de esperma y problemas de fertilidad", tanto a corto y largo plazo, como indica la Organización Mundial de la Salud (OMS). Si la exposición es durante el embarazo sus descendientes pueden sufrir defectos de nacimiento y fallos en el desarrollo. Cuando los humanos consumen grandes cantidades de comida que contiene Boro, la concentración de Boro en sus cuerpos puede aumentar a niveles causando erupciones en la piel, náuseas vómitos (puede ser de color azul verdoso), diarrea (puede ser de color azul verdoso), dolores abdominales y de cabeza. Se ha informado de baja presión arterial y cambios metabólicos en la sangre (acidosis). También puede aparecer agitación o la reacción opuesta (debilidad, agotamiento, depresión) y se ha detectado fiebre, hipertermia, temblores y ataques. La exposición crónica, puede causar deshidratación, ataques, una disminución de glóbulos rojos en la sangre, así como daño a los riñones e hígado. Cuando la exposición es con pequeñas cantidades de Boro tiene lugar la irritación de la nariz, garganta y ojos (Crank, 1975). . Efectos Ambientales Los humanos pueden ser expuestos al Boro a través de las frutas y vegetales, el agua, aire y el consumo de productos. Comer peces o carne no incrementará la concentración de Boro en nuestros cuerpos, el Boro no se acumula en los tejidos animales. La exposición al Boro a través del aire y del agua no es muy frecuente que. 32.
(51) CAPÍTULO 2. Marco Teórico ocurra, pero el riesgo de exposición al polvo de Boro en el lugar de trabajo existe. Las raíces de las plantas toman pequeñas cantidades de boro disuelto a través del suelo; el boro asciende hacia las hojas, donde el agua se pierde por transpiración y permanece en los márgenes de las hojas donde se acumula. Como el proceso continúa, la concentración de boro se convierte en lo suficientemente alta para poder dañar el tejido de la hoja; en consecuencia, las hojas se vuelven amarillas y se queman, para posteriormente caer. Los abonos borados al ser de tipo folicular, no son absorbidos por las raíces para formar parte de los nutrientes de la planta. La calidad del suelo, drenaje, clima y otros factores tales como la cantidad de lluvia, pueden modificar las concentraciones límite. Las exposiciones al Boro pueden también ocurrir al consumir productos como cosméticos y productos para lavar. (Ravelo Polo, 2012) 2.8. Marco legal En el año 2012 se ha elaborado la “Propuesta normativa de los estándares nacionales de calidad ambiental para agua subterránea” por el ministerio del ambiente; tomando en cuenta el D.S. Nº 002 – 2008 – MINAM “Estándares de Calidad Ambiental para Agua, los estudios realizados en la costa y sierra, realizados por el INRENA, además de la única norma sobre estándares de calidad ambiental de agua subterránea, publicada en internet,. 33.
(52) CAPÍTULO 2. Marco Teórico de la Republica Dominicana, y también tomando en cuenta las recomendaciones de la tercera edición de la guía de calidad de agua de la OMS publicada el 2006. Clasificación del Agua Subterránea para su aplicación La clasificación que señala la Ley Nº 29338 Ley de Recursos Hídricos son las siguientes: -. Categoría A: Aguas Subterráneas Destinadas a la Producción de Agua Potable A1: Aguas que puede ser Potabilizado con Desinfección (también en concordancia a lo fijado en la Ley 29338, Art 36 agua para uso primario) A2: Aguas que pueden ser Potabilizadas con Tratamiento Convencional o Avanzado. (Aplicable lo fijado en la Ley 29338, Art 39 agua para uso poblacional).. -. Categoría B: Aguas Subterráneas Aprovechables para uso Agropecuario (Acorde a lo fijado en la Ley 29338, Art 43 agua de tipo de uso Productivo numeral 1 tipo Agrario: pecuario y agrícola). Categoría C: Aguas Subterráneas para Conservación del Ambiente (acorde a lo fijado en la Ley 29338, y normas ambientales aplicables). 34.
(53) CAPÍTULO 2. Marco Teórico Tabla 6 Propuesta de Estándares de Calidad Ambiental para Aguas Subterráneas.. Nota. El valor que se establece para boro es un valor de referencia provisional tomado como recomendación de la OMS, porque con las técnicas de tratamiento disponibles será difícil alcanzarlo en zonas con concentraciones naturales de boro elevadas. Fuente: Ministerio del ambiente (MINAM). (2012) Propuesta de Estándares de Calidad Ambiental para Aguas Subterráneas. Dentro de la Ley Nº 29338 desde el Art. 108 al 113 trata acerca del Agua Subterránea, sobre su Uso, Exploración y Explotación (perforación de pozos) racional de la misma, así como la estipulación de las zonas de veda y zonas de restricción, pero no se trata en ningún párrafo o artículo sobre la calidad ambiental de la misma, dándose 35.
Figure



Documento similar
Pero antes hay que responder a una encuesta (puedes intentar saltarte este paso, a veces funciona). ¡Haz clic aquí!.. En el segundo punto, hay que seleccionar “Sección de titulaciones
El contar con el financiamiento institucional a través de las cátedras ha significado para los grupos de profesores, el poder centrarse en estudios sobre áreas de interés
Cedulario se inicia a mediados del siglo XVIL, por sus propias cédulas puede advertirse que no estaba totalmente conquistada la Nueva Gali- cia, ya que a fines del siglo xvn y en
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
[r]
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de