Separación de proteínas con dielectroforesis empleando estructuras aisladoras
Texto completo
(2) INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE MONTERREY. CAMPUS MONTERREY DIVISIÓN DE INGENIERÍA Y ARQUITECTURA PROGRAMA DE GRADUADOS EN INGENIERÍA. Los miembros del comité de tesis recomendamos que el presente proyecto de tesis presentado por la Ing. María Delia Gutiérrez Espinosa sea aceptado como requisito parcial para obtener el grado académico de: Maestra en Ciencias en Sistemas Ambientales Especialidad en Procesos Químicos. Comité de Tesis:. __________________________ Dra. Blanca Lapizco Encinas Asesor. ___________________________ Dr. Joaquín Acevedo Mascarúa Sinodal. _______________________ Dr. Enrique Ortiz Nadal Sinodal. Aprobado:. _______________________ Dr. Francisco Ángel Bello. Director del Programa de Graduados en Ingeniería Mayo, 2007.
(3) ÍNDICE GENERAL. 1. RESUMEN ....................................................................................... 8. 2. INTRODUCCIÓN ..........................................................................10. 3. OBJETIVO .....................................................................................12. 4. ANTECEDENTES..........................................................................14. 4.1. ELECTROCINÉTICA (EC) ..........................................................14. 4.1.1 ELECTROFORESIS (EF)..............................................................................16 4.1.2 FLUJO ELECTROOSMÓTICO (EO)............................................................18. 4.2. DIELECTROFORESIS (DEF) ......................................................20. 4.2.1 TEORÍA DE LA DIELECTROFORESIS ......................................................23 4.2.2 CLASIFICACIÓN DE LA DIELECTROFORESIS .......................................27. 4.3. DIELECTROFORESIS CON ELECTRODOS ............................29. 4.4. DIELECTROFORESIS CON AISLADORES..............................31. 4.5. APLICACIONES DE LA DIELECTROFORESIS ......................33. 4.5.1 DIELECTROFORESIS PARA LA MANIPULACIÓN DE MICROORGANISMOS............................................................................................34 4.5.2 APLICACIONES DE LA DIELECTROFORESIS EN SISTEMAS AMBIENTALES.......................................................................................................35 4.5.3 APLICACIONES CLÍNICAS DE LA DIELECTROFORESIS. .....................35. 5. MATERIALES, EQUIPOS Y MÉTODOS ...................................39. 5.1. MATERIALES ...............................................................................39. 5.1.1 ALBÚMINA DE SUERO DE BOVINO (ASB) .............................................39 5.1.2 TINTE ISOTIOCIANATO DE FLUORESCEÍNA (ITCF).............................39.
(4) 5.2. EQUIPOS ........................................................................................40. 5.2.1 5.2.2 5.2.3 5.2.4 5.2.5. 5.3. SVM 340 .......................................................................................................40 H VS 448.......................................................................................................41 CENTRÍFUGA EPPENDORF 5804R............................................................42 HORNO TERMOLYNE 62700 .....................................................................42 MICRODISPOSITIVO EMPLEADO ............................................................43. MÉTODOS......................................................................................46. 5.3.1 PROCEDIMIENTO PARA TEÑIR PROTEÍNAS .........................................46 5.3.2 PROCEDIMIENTO PARA LA PREPARACIÓN DEL MEDIO DE SUSPENSIÓN...........................................................................................................47 5.3.3 PROCEDIMIENTO PARA LA PREPARACIÓN DEL MICRODISPOSITIVO …………………………………………………………………………………47. 6. RESULTADOS ...............................................................................51. 6.1. PROCESO DE ETIQUETADO DE LA PROTEÍNA .........................................52. 6.2. OBSERVACIONES EXPERIMENTALES .......................................................54. 6.3. GEOMETRÍA 1, PH 8, CONDUCTIVIDAD 27 µS/CM....................................55. 6.4. GEOMETRÍA 1, PH 8, CONDUCTIVIDAD 50 µS/CM....................................56. 6.5. GEOMETRÍA 1, PH 8, CONDUCTIVIDAD 75 µ/CM......................................57. 6.6. GEOMETRÍA 2, PH 8, CONDUCTIVIDAD 27 µS/CM....................................57. 6.7. GEOMETRÍA 2, PH 8, CONDUCTIVIDAD 50 µS/CM....................................58. 6.8. GEOMETRÍA 2, PH8, CONDUCTIVIDAD 75 µS/CM.....................................59. 6.9. GEOMETRÍA 1, PH 9, CONDUCTIVIDAD 27 µS/CM....................................60. 6.10. GEOMETRÍA 1, PH 9, CONDUCTIVIDAD 50 µS/CM....................................61. 6.11. GEOMETRÍA 1, PH 9, CONDUCTIVIDAD 75 µS/CM...................................62. 6.12. GEOMETRÍA 2, PH 9, CONDUCTIVIDAD 27 µS/CM....................................63. 6.13. GEOMETRÍA 2, PH 9, CONDUCTIVIDAD 50 µS/CM....................................64. 6.14. GEOMETRÍA 2, PH 9 CONDUCTIVIDAD 75 µS/CM....................................65. 7. DISCUSIÓN DE RESULTADOS ..................................................70. 2.
(5) 8. CONCLUSIONES ..........................................................................73. 9. LISTA DE SÍMBOLOS..................................................................75. 10. GLOSARIO.....................................................................................76. 11. BIBLIOGRAFÍA ............................................................................78. 12. ANEXOS .........................................................................................83. 3.
(6) ÍNDICE DE FIGURAS Figura 1. Reperesentación de la Electroforesis para partículas cargadas. .......................17 Figura 2. Representación del flujo electroosmótico sobre una superficie de vidrio y solución buffer. .............................................................................................................19 Figura 3. Comparación de la electroforesis con la dielectroforesis .................................21 Figura 4. Movimiento de una partícula en un campo eléctrico no uniforme (dielectroforesis positiva). .............................................................................................24 Figura 5. Esquema del comportamiento de las fuerzas dielelectroforética y electrocinética con respecto al campo eléctrico. ....................................................................................25 Figura 6. Representación del movimiento de partículas en los electrodos hiperbólicos..29 Figura 7. Representación de un electrodo polinominal ...................................................30 Figura 8. Típica geometría del recipiente y regiones donde la DEF positiva y negativa están localizadas............................................................................................................31 Figura 9. Típica geometría del dispositivo y regiones aisladoras donde la DEF positiva y negativa están localizadas..............................................................................................33 Figura 10. Prototipo del dispositivo de para la Investigación del cáncer mediante dielectroforesis ..............................................................................................................36 Figura 11. Levitación de la célula de Leucemia K562 del electrodo 1 al 2 ....................36 Figura 12. Vista lateral del microcanal para dielectroforesis y fracción del campo de flujo ......................................................................................................................................37 Figura 13. Espectro de absorción y emisión del tinte Isotiocianato de fluoresceína (ITCF) ......................................................................................................................................40 Figura 14. Imagen del microscopio SVM 340................................................................41 Figura 15. Imagen del secuenciador HVS 448 ...............................................................41 Figura 16. Imagen de la centrífuga Eppenfor 5804R ......................................................42 Figura 17. Imagen del horno Termoline 62700. .............................................................43 Figura 18. Vista superior del microdispositivo de vidrio. ...............................................44 Figura 19. Vista superior del microcanal de vidrio.........................................................44 Figura 20. Vista lateral del microdispositivo de vidrio. ..................................................44. 4.
(7) Figura 21. Distribución de los ocho canales de un microdispositivo elaborado en vidrio. ......................................................................................................................................45 Figura 22. Esquema del arreglo experimental de la Dielectroforesis con Aisladores.......49 Figura 23 Esquema de los resultados utilizando microdispositivo de vidrio. ..................51 Figura 24. Proteína teñida suspendida en buffer de Na2CO3 con pH=9 y etapas de centrifugación................................................................................................................52 Figura 25. Atrapamiento de proteína a 2150 V/cm en un canal con un diámetro de los postes de 470 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio. ............................................................................................55 Figura 26. Atrapamiento de proteína a 1500 V/cm en un canal con un diámetro de los postes de 470 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio. ............................................................................................56 Figura 27. Atrapamiento de proteína a 650 V/cm en un canal con un diámetro de los postes de 470 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio. ............................................................................................57 Figura 28. Atrapamiento de proteína a 1300 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 520 micras en un microdispositivo de vidrio .............................................................................................58 Figura 29. Atrapamiento de proteína a 1100 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 520 micras en un microdispositivo de vidrio .............................................................................................59 Figura 30. Atrapamiento de proteína a 500 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 520 micras en un microdispositivo de vidrio.. ...........................................................................................60 Figura 31. Atrapamiento de proteína a 2950 V/cm en un canal con un diámetro de los postes de 470 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio .............................................................................................61 Figura 32. Atrapamiento de proteína a 2500 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio. ............................................................................................62. 5.
(8) Figura 33. Atrapamiento de proteína a 1050 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 510 micras en un microdispositivo de vidrio .............................................................................................63 Figura 34. Atrapamiento de proteína a 2400 V/cm en un canal con un diámetro de los postes de 470 micras y con una distancia de centro a centro de 520 micras en un microdispositivo de vidrio .............................................................................................64 Figura 35. Atrapamiento de proteína a 2100 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 520 micras en un en microdispositivo de vidrio. ............................................................................................65 Figura 36. Atrapamiento de proteína a 750 V/cm en un canal con un diámetro de los postes de 440 micras y con una distancia de centro a centro de 520 micras en un en microdispositivo de vidrio. ............................................................................................66 Figura 37. Gráfica mostrando el campo eléctrico mínimo para lograr el atrapamiento dielectroforético en la Geometría 1. ...............................................................................67 Figura 38. Gráfica mostrando el campo eléctrico mínimo para lograr el atrapamiento dielectroforético en la Geometría 2. ...............................................................................68 Figura 39. Gráfica que muestra el campo eléctrico mínimo para lograr el atrapamiento de proteínas........................................................................................................................69 Figura 40. Comparación de la Geometría 1 con respecto a la Geometría 2 de los postes aisladores. .....................................................................................................................72 Figura 41. Imagen de un microdispositivo con postes con geometría trapezoidal para atrapar ADN..................................................................................................................85 Figura 42. Concentración y separación de células bacterianas vivas y muertas...............86 Figura 43. Voltaje mínimo requerido para lograr la DEF atrapante en los dispositivos estudiados .....................................................................................................................89 Figura 44. Diagrama de un microdispositivo de plástico. ...............................................96 Figura 45. Imagen del canal de plástico en un canal con un diámetro de los postes de 200 micras y con una distancia de centro a centro de 250 .....................................................98 Figura 46. Imagen de proteína ASB atrapada a 1500 V/cm en un canal con diámetro de los postes de 200 micras y con una distancia de centro a centro de 250 micras en un microdispositivo de plástico ..........................................................................................99. 6.
(9) Figura 47. Imagen de proteína ASB atrapada a 1500 V/cm en un canal con diámetro de los postes de 200 micras y con una distancia de centro a centro de 250 micras en un microdispositivo de plástico.. ........................................................................................99 Figura 48. Dielectroforesis con pH 8 para una sola geometría en plástico. ................... 100. ÍNDICE DE TABLAS Tabla 1. Resumen de las fuerzas electrocinéticas (Hughes, 2003). .................................23 Tabla 2. Características de los microcanales con postes aisladores del microdispositivo de vidrio.............................................................................................................................45 Tabla 3. Conductividad y pH de los diferentes medios de suspensión. ...........................47 Tabla 4. Orden de los Resultados...................................................................................53 Tabla 5. Dimensiones de los microcanales de la geometría 1 y la geometría 2. ..............53 Tabla 6. Resultados de los experimentos realizados en microdispositivos de vidrio. ......66 Tabla 7. Factor de Claussius-Mossotti para los medios de suspensión empleados. .........69 Tabla 8. Características de los microcanales del microdispositivo de plástico. ...............96. 7.
(10) 1 RESUMEN. La dielectroforesis es el movimiento de partículas ocasionado por efectos de polarización en un campo eléctrico no uniforme. Una vez formado el campo eléctrico no uniforme, las partículas pueden quedar atrapadas en regiones de alta intensidad de campo eléctrico o ser repelidas produciéndose dielectroforesis positiva y/o negativa, respectivamente (Pohl y Hawk, 1966). Los postes aisladores representan una opción viable para generar campos eléctricos no uniformes y poder llevarse a cabo la dielectroforesis. La dielectroforesis tiene que vencer a la fuerza electrocinética conformada por la electroforesis y el flujo electroosmótico para que pueda dominar el comportamiento de las partículas y atraparlas. Se realizaron experimentos con el objetivo de demostrar la factibilidad de la dielectroforesis para atrapar proteínas utilizando postes aisladores en microdispositivos de vidrio en corriente directa, observando el efecto del campo eléctrico aplicado, del pH y de la conductividad del medio de suspensión de las biopartículas así las diferentes geometrías que tienen los microdispositivos de vidrio. En cada experimento se buscó el campo eléctrico mínimo para lograr el atrapamiento de proteínas. En los experimentos se observó que a medida que se incrementa la conductividad el campo el requerido para lograr el atrapamiento disminuye; cuando se aumenta el pH del medio de suspensión, se aumenta la intensidad de campo eléctrico requerido para lograr atropamiento; y se requiere aplicar mayor campo eléctrico para atrapar proteínas en la geometría con una distancia menor entre los postes (Geometría 1) que en la geometría con una distancia mayor entre los postes (Geometría 2). Este trabajo constituye el primer reporte en emplear la dielectroforesis con aisladores y campos de Corriente Directa para lograr el atrapamiento de proteínas en México por lo que se pueden realizar más investigaciones en el futuro para el desarrollo de esta técnica y así lograr que sus aplicaciones tengan un beneficio para la ciencia.. 8.
(11) 2 INTRODUCCIÓN Las técnicas para bioseparaciones están tomando mayor importancia día con día en campos como análisis clínicos, producción de fármacos, obtención de nutracéuticos, ingeniería ambiental, etc. Una técnica de bioseparación es aquella que permite la concentración/purificación de bioproductos sin alterar su funcionalidad. Entre las técnicas de bioseparaciones más empleadas se tienen: la concentración con membranas, adsorción, cromatografía, cristalización, liofilización, electroforesis y dielectroforesis. La dielectroforesis (DEF) fue descubierta en 1951 por Pohl y se ha desarrollado e investigado cada vez más, ya que mediante su aplicación se pueden separar una gran variedad de biopartículas. Incluso las aplicaciones de la dielectroforesis pueden ser ambientales ya que se pueden separar contaminantes de algún fluido en poco tiempo y económicamente factible (Pohl y Hawk, 1966). La DEF es el movimiento de partículas ocasionado por efectos de polarización en un campo eléctrico no uniforme. Una vez formado el campo eléctrico no uniforme, las partículas pueden quedar atrapadas en regiones de alta intensidad de campo eléctrico o ser repelidas produciéndose dielectroforesis positiva y/o negativa, respectivamente (Pohl y Hawk, 1966). La dielectroforesis es una técnica que puede escalarse fácilmente para la purificación, el enriquecimiento y la caracterización de un gran rango de componentes ambientales, biológicos y clínicos. Las fuerzas dielectroforéticas pueden ser usadas para desviar la trayectoria de partículas en una corriente del flujo de acuerdo a las características dieléctricas de las partículas (Gascoyne y Vykoukal, 2002). El presente trabajo muestra la aplicación de la dielectroforesis en microdispositivos de vidrio. Se utilizaron arreglos de postes aisladores con el fin de producir campos eléctricos 10.
(12) no homogéneos. Los campos eléctricos aplicados fueron de corriente directa (CD). La importancia de este estudio es que constituye el primer trabajo de dielectroforesis separando biopartículas como es la proteínas albúmina suero de bovino. La fuerza dielectroforética no es un fenómeno aislado, sino que ocurre en presencia de otras fuerzas electrocinéticas como lo son la electroforética y la electroosmótica. Para que la dielectroforesis sea el fenómeno dominante y se genere el atrapamiento y concentración de partículas, la DEF debe vencer las fuerzas anteriormente mencionadas. En esta investigación se analizaron los diferentes factores que afectan al fenómeno de la dielectroforesis, como son el efecto de la magnitud del campo eléctrico aplicado, el pH y la conductividad del medio de suspensión de las biopartículas, la geometría de los postes aisladores. Lo anterior tiene trascendencia ya que con base a los resultados analizados se puede optimizar la separación dielectroforética para las aplicaciones que se hagan en un futuro. Este trabajo representa un avance en el desarrollo de la Dielectoforesis teniendo como objetivo lograr mejores separaciones de biopartículas en tecnología de microfluídica. En este caso la DEF se enfocó a proteínas, que puedan tener aplicaciones importantes y con ello se pueda lograr un avance constituyendo así un beneficio importante para la ciencia. La dielectroforesis tiene un gran número de aplicaciones entre las que se encuentra la separación de contaminantes, ya es posible aislar esos contaminantes aplicando corriente eléctrica con uso de aisladores para generar un campo eléctrico no homogéneo con intensidad suficiente para atrapar los contaminantes. Existe una promesa considerable de la dielectroforesis basada en aisladores para la concentración, separación e identificación de partículas ya que tiene grandes áreas potenciales de aplicación las cuales se irán desarrollando en el futuro para el mejoramiento de esta técnica.. 11.
(13) 3 OBJETIVO El alcance de este trabajo consistió en demostrar la factibilidad de la técnica de la dielectroforesis empleando postes aisladores para el atrapamiento de proteínas; es decir, el objetivo de este trabajo es demostrar que es posible atrapar la proteína Albúmina de Suero de Bovino utilizando la técnica de la dielectroforesis.. 12.
(14) 4 ANTECEDENTES Actualmente se utilizan una variedad de técnicas de separación de partículas y biomoléculas; entre ellas, la dielectroforesis, que se ha empleado para la manipulación de microorganismos y biomoléculas, así como en aplicaciones clínicas, incluso se ha utilizado para separar células cancerígenas. A continuación se presentan los mecanismos o fuerzas presentes en los sistemas se separación bajo la acción de un campo eléctrico, dichas fuerzas son la fuerza dielectroforética y la fuerza electrocinética que está conformada por la electroforesis y la electroósmosis.. 4.1 ELECTROCINÉTICA (EC) Las fuerzas electrostáticas pueden manifestarse a sí mismas en diversas formas y tienen un gran número de aplicaciones. Dentro de estos mecanismos de transporte electrostáticos se encuentran diferentes fuerzas, una de ellas es la electrocinética que está compuesta por la fuerza electroforética y por el flujo electroosmótico (Cummings y Singh, 2003). Los efectos electrocinéticos ocurren debido a la interacción de dipolos inducidos con campos eléctricos. Han sido usados por muchos años para la manipulación y análisis de células biológicas y partículas en la escala micrométrica. Una variedad de movimientos pueden ser realizados cambiando la naturaleza del campo eléctrico, incluyendo atracción, repulsión y rotación (Durán y col., 2003). A continuación se definen la velocidad electroforética y la electroosmótica:. υ EF = μ EF E. (1). υ EO = μ EO E. (2). Donde μ EF es la movilidad electroforética y μEO es la movilidad electroósmotica y E es el campo eléctrico aplicado.. 14.
(15) La fuerza electrocinética se ha utilizado extensamente para el movimiento de fluidos/analitos dentro de microdispositivos. Una de las ventajas es que el movimiento del fluido/analito está dado con un perfil de velocidad uniforme (flujo pistón), el cual es sustancialmente diferente al perfil de velocidad parabólico del flujo hidrodinámico (Hughes, 2003). La velocidad electrocinética (EC), la cual es proporcional al campo eléctrico, comprende los efectos de electroósmosis y electroforesis. La velocidad electrocinética υ EC es relativamente lineal con el campo eléctrico:. υ EC = μ EC E. (3). μ EC = μ EF − μ EO. (4). donde:. define la movilidad electrocinética como la superposición de la movilidad electroforética ( μ EF ) y la movilidad electroósmotica, ( μEO ), del flujo opuesto generado por la interfase del liquido del canal. Normalmente las biopartículas en soluciones acuosas tienen una carga superficial negativa, así la μ EF tiene el mismo signo que μ EO cuando el sustrato utilizado tiene una superficie cargada negativamente como es el caso del vidrio (Hughes, 2003). La electrocinética es el movimiento resultante del líquido y de las partículas suspendidas en un canal inmóvil que tiene solamente fuerzas electrostáticas débiles (Simmons y col., 2006). A continuación se describe a detalle la dielectroforesis y el flujo electroosmótico.. 15.
(16) 4.1.1 ELECTROFORESIS (EF). La electroforesis es el movimiento de partículas cargadas en un campo eléctrico (Pohl y Hawk, 1966). La principal diferencia entre la electroforesis y la dielectroforesis es que para ésta última, la partícula no necesariamente debe estar cargada, en cambio, la electroforesis forzosamente trabaja bajo el principio de que las partículas poseen carga eléctrica (Feeley y Pohl, 1981). La electroforesis (EF) es una fuerza impartida sobre una partícula cargada debido a la atracción del campo eléctrico y las cargas de la partícula, causando que la partícula se mueva hacia el electrodo de polaridad opuesta. El principio de la electroforesis es que las partículas cargadas se mueven a través de un líquido sin movimiento en un campo eléctrico a una velocidad proporcional a la razón carga/masa, la velocidad de las partículas pequeñas con mucha carga es mayor que la velocidad de partículas más grandes pero con poca carga eléctrica, ya que éstas se mueven más despacio (Hughes, 2003). A continuación se muestra en la Figura 1 una representación de la electroforesis al aplicarse un campo eléctrico. Se observan tres casos particulares; el primero de ellos ocurre cuando una partícula negativa es expuesta a la acción de un campo eléctrico se genera un movimiento hacia el electrodo positivo debido a las fuerzas de atracción entre la partícula negativa y el electrodo positivo. Caso contrario ocurre cuando se aplica un campo eléctrico sobre la partícula positiva provocándose que se mueva hacia el electrodo con carga opuesta (negativo) y dicho movimiento es conocido como electroforesis. La electroforesis sólo puede ocurrir con partículas cargadas y en la Figura 1 se muestra que la partícula neutra no se moverá al aplicarse un campo eléctrico.. 16.
(17) Figura 1. Reperesentación de la Electroforesis para partículas cargadas.. A pesar de que la electroforesis es una fuerza importante para la manipulación de partículas de escala nanométrica tales como proteínas, la electroforesis opera mejor sobre escalas de aparatos a mayor escala tales como la electroforesis en gel para las bandas de ADN usadas. en medicina y ciencia forense para la determinación de la identidad. (Hughes, 2003). Los experimentos controlados de electroforesis requieren la aplicación de un campo eléctrico que actúa en una dirección solamente. Además, cuando se tienen campos eléctricos de corriente directa y de magnitud constante (CD), las partículas mantienen una velocidad constante independiente del tiempo o posición. A causa de que la magnitud y la dirección de la fuerza son proporcionales al campo eléctrico aplicado, un campo eléctrico alterno (CA) puede causar que la partícula se tambalee alrededor de un eje pero aún así no se mueve del que es el punto promedio sobre el tiempo (Hughes, 2003). El transporte electroforético es linealmente proporcional al campo eléctrico local (Cummings y Singh, 2003). La electroforesis ha tenido numerosas aplicaciones en bioseparaciones, en medicina y microbiología. Dentro de esas aplicaciones de la electroforesis se tiene el trabajo desarrollado por Amstrong y colaboradores sobre la separación de bacterias utilizando dos métodos de separación de capilaridad electrocinética. Ambos métodos tienen una alta 17.
(18) eficiencia de separación de una variedad de bacterias como son Escherichia coli K12, Pseudomonas putida y Serratia rubidae, entre otras. La primera separación de microbios se basa en el tamaño y forma de los mismos y el otro sistema de separación que se enfoca en separar bacterias similares por la carga superficial. Lo anterior tiene gran relevancia debido a que revolucionó aspectos de microbiología, evaluación de suelos contaminados para agricultura, bio remediación, control de calidad en procesos de fermentación, estudios ambientales y muchas otras áreas de estudio (Amstrong y col., 1999).. 4.1.2 FLUJO ELECTROOSMÓTICO (EO). Hughes define el flujo electroosmótico como el movimiento de un fluido generado por la interacción entre cargas libres en una doble capa eléctrica y un campo eléctrico tangencial a esa doble capa (Hughes, 2003). El flujo electroosmótico o electroósmosis es creado por la aplicación de un campo eléctrico externo sobre una superficie de doble capa formada por la interacción de una solución electrolítica con una superficie dieléctrica en presencia de un campo eléctrico. El flujo electroosmótico es un método comúnmente empleado para bombear líquidos en microdispositivos, ya que evita el uso de microbombas. Cuando un electrolito (buffer) se pone en contacto con una superficie sólida (como puede ser el vidrio) ocurre una reacción espontánea entre el líquido y la superficie dando como resultado una redistribución de cargas y se formará una capa con iones negativos en la superficie que van a alinearse con los iones positivos de la solución electrolítica formando una doble capa, donde se van a mover los iones positivos de la solución hacia el electrodo negativo por la acción de un campo eléctrico y ese flujo es llamado flujo electroosmótico. La electroósmosis es utilizada en microdispositivos en biomedicina para transportar líquido para diferentes propósitos, tales como inyección de muestras, reacciones químicas y separación de especies (Yao, 2003).. Otro aspecto es que el movimiento del fluido/analito no será afectado drásticamente por las dimensiones del canal. Además, la velocidad del fluido/analito puede ser manipulada. 18.
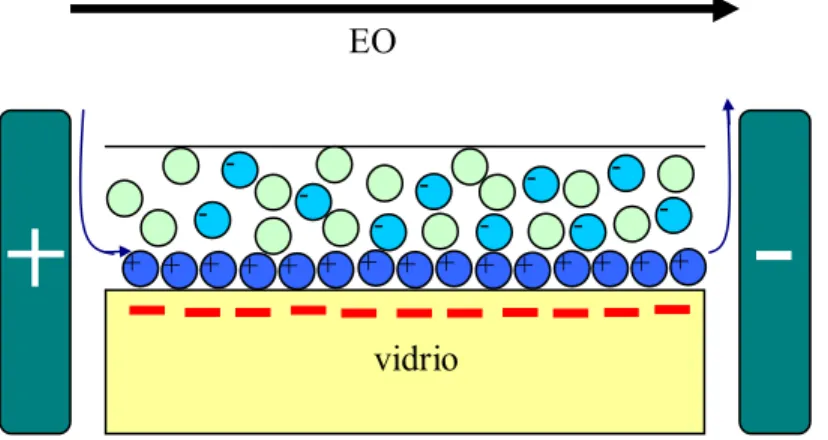
(19) fácilmente variando cualquiera de los parámetros como son el campo eléctrico aplicado, densidad de la carga de la superficie del canal, o las características de la solución (Hughes, 2003). En la. Figura 2Figura 2 se observa una representación del flujo electroosmótico en una superficie. de vidrio en contacto con una solución buffer con iones positivos y negativos. El flujo electroosmótico se lleva acabo en dirección del electrodo de carga positiva hacia el electrodo de carga negativa, debido a que el vidrio posee carga negativa, lo cual atrae los iones cargados positivamente. Los iones positivos forman una capa sobre la superficie de vidrio, y cuando el campo eléctrico es aplicado, los iones positivos son atraídos hacia el electrodo negativo generándose así el flujo electroosmótico (Cummings y Singh, 2003).. EO -. -. -. -. -. + + + + + + + + + + + + + + + -. vidrio. Figura 2. Representación del flujo electroosmótico sobre una superficie de vidrio y solución buffer.. La velocidad del flujo electroosmótico es lineal con el campo eléctrico aplicado y se describe con la Ecuación (2).. 19.
(20) La μ eo denota la movilidad electroosmótica, que es una magnitud la cual puede ser una función de la concentración de iones, pH y temperatura del medio de suspensión y se define como sigue (Huson, 2005):. μ eo =. εζ 4πη. (5). donde ε es la constante dieléctrica, ζ es el potencial zeta y η denota la viscosidad dinámica del medio. El potencial zeta puede definirse como la razón de la velocidad de flujo electroosmótico y el campo eléctrico aplicado, que es una medida de la densidad efectiva de la carga superficial (Simmons y col., 2006). Para los sistemas electrocinéticos en microfluídica fabricados en vidrio o en sílice, los iones en la superficie cargada de dichos materiales, entran en contacto con la solución electrolítica y así se produce una doble capa eléctrica que está formada de una superficie sólida cargada y una región cercana a la superficie que soporta un exceso neto de iones (Breuer, 2003). La electroósmosis no solamente se presenta en superficies de vidrio, también se puede presentar en superficies de polímeros ya que la densidad de carga neta que se forma espontáneamente en superficies de vidrio y de polímeros en contacto con agua produce una doble capa eléctrica. Un campo eléctrico aplicado tangencialmente a lo largo de la superficie produce una fuerza neta sobre el líquido dentro de la capa Debye (doble capa) donde hay un desbalanceo neto de cargas móviles como un resultado de la atracción y repulsión de la superficie cargada. Esta fuerza de los cuerpos electrostáticos produce la electroósmosis. En canales rectos teniendo cargas superficiales uniformes y conteniendo líquidos uniformes, el bombeo electroosmótico no produce ningún efecto en el flujo fuera de la doble capa, dando como resultado perfiles planos de la velocidad en el flujo (en el solvente adherido). Partículas cargadas sumergidas en líquido generalmente se mueven también electroforéticamente bajo un campo eléctrico aplicado como resultado de fuerzas electrostáticas en la carga neta de las partículas (Simmons y col., 2006).. 20.
(21) 4.2 DIELECTROFORESIS (DEF) La dielectroforesis es el movimiento que resulta de la fuerza generada por la acción de un campo eléctrico no uniforme sobre una partícula. Cualquier dipolo (inducido o permanente) en un cuerpo tendrá una separación finita de igual número de cargas positivas y negativas. El campo eléctrico provocará el alineamiento del dipolo con él. En un campo eléctrico no uniforme (que es divergente) al final del dipolo habrá una región de menor intensidad de campo eléctrico que el otro. Una fuerza neta resultará y el cuerpo será empujado hacia la región de mayor intensidad de campo eléctrico (Pohl y Hawk, 1966).. Figura 3. Comparación de la electroforesis con la dielectroforesis (Pohl y Hawk, 1966).. En la Figura 3 se compara la dielectroforesis con la electroforesis. La dirección del movimiento de la partícula cargada es dependiente de la dirección del campo eléctrico aplicado. El objeto cargado positivamente es empujado hacia el electrodo que es negativo, con lo que se representa el comportamiento de la electroforesis. En cambio, el objeto neutral (mostrado como el cuerpo más grande) es empujado hacia la región de alta intensidad de campo eléctrico. Si el campo es cambiado de dirección, la dirección del dipolo inducido es también cambiada de dirección, pero la fuerza neta es más grande hacia el lugar de mayor concentración de campo eléctrico, por lo que se muestra el. 21.
(22) comportamiento de la dielectroforesis. El éxito de la dielectroforesis depende de la existencia de una diferencia en el volumen polarizable entre la partícula y el medio (Pohl y Hawk, 1966). De acuerdo con Betts cualquier dipolo tendrá una separación finita entre cantidades iguales de cargas positivas y negativas y dicho dipolo se va a alinear con el campo eléctrico pero si éste es no homogéneo un lado del dipolo estará en la región de más baja intensidad de campo eléctrico y el otro lado del dipolo estará en la región de intensidad más alta y esto va a producir un desbalance en las fuerzas electrostáticas (Betts, 1995). La dielectroforesis es el movimiento de un objeto polar o polarizable en la dirección del gradiente eléctrico. La dielectroforesis atrapante es el atrapamiento de dichos objetos en altas regiones de campo eléctrico (Prinz y col., 2002). Hughes define a la dielectroforesis (DEF) como un movimiento de translación de partículas inducidas por efectos de polarización en un campo eléctrico no uniforme. Ciertos tipos de partículas, cuando son sujetas a un campo eléctrico, se polarizarán; las cargas inherentes separadas forman un dipolo. Los dipolos interactúan con el campo eléctrico y generan una fuerza electrostática (Hughes, 2003). La dielectroforesis es un mecanismo de transporte electrocinético con una dependencia no lineal con el campo eléctrico. La dielectroforesis es un método de rápida respuesta con selectividad suficiente para la separación y concentración de biopartículas. La dielectroforesis es un efecto de segundo orden del campo eléctrico; en cambio, tanto la electroforesis como la electroósmosis son de primer orden con el campo eléctrico (Hughes, 2003). La DEF puede llevarse a cabo en campos eléctricos de corriente alterna o de corriente directa. Además, la DEF es una herramienta importante para la manipulación, la separación y caracterización de biopartículas microscópicas en la investigación biomédica y de micro-analizadores. La dielectroforesis tiene un enorme potencial para la. 22.
(23) concentración y separación de biopartículas (Hughes, 2003). En la Tabla 1 se muestran las fuerzas electrocinéticas y la fuerza dielectroforética.. Tabla 1. Resumen de las fuerzas electrocinéticas (Hughes, 2003).. Fuerza. Corriente Alterna o. Origen. Corriente Directa Electroforesis. Corriente Directa. Causadas. en. expuestas. a. partículas un. campo. eléctrico. Dielectroforesis. Corriente Alterna / Corriente Directa. Causada por un dipolo inducido. en un campo. eléctrico no uniforme. Electroósmosis. Corriente Alterna /. Causado por la interacción. Corriente Directa. entre cargas libres en una doble capa eléctrica y un campo eléctrico tangencial.. Aplicaciones de la dielectroforesis incluyen la separación de partículas coloides, la separación de objetos biológicos tales como células de levaduras, virus y células cancerígenas así como el atrapamiento y manipulación de moléculas de ADN. También la dielectroforesis ha sido aplicada para la separación de nanotubos semiconductores de carbón de pared sencilla (Chou y col., 1997).. 4.2.1 TEORÍA DE LA DIELECTROFORESIS. 23.
(24) En la Figura 4 se representa el movimiento de una partícula neutra en un campo eléctrico no uniforme, el campo eléctrico no homogéneo es creado por dos electrodos de distinta forma, ya que un electrodo es de placa y el otro es de varilla colocado en forma vertical y horizontal respectivamente. La partícula neutra posee tres cargas positivas y tres cargas negativas. La región de mayor intensidad de campo eléctrico es la cercana al electrodo de varilla (horizontal) y es donde se encuentra el lado negativo del dipolo, es decir, donde están las tres cargas negativas de la partícula y esto provoca que las cargas negativas estén más concentradas que las cargas positivas generando una efecto de carga negativa en la partícula que era neutra y a su vez, produciendo un movimiento de la partícula hacia el electrodo positivo (Betts, 1995).. Electrodo. -. Campo eléctrico no uniforme. +. + + -+. Electrodo. Densidad de carga mas alta. Movimiento neto Densidad de carga mas baja. Figura 4. Movimiento de una partícula en un campo eléctrico no uniforme (dielectroforesis positiva).. La Figura 5 muestra la tendencia que siguen las fuerzas electrocinética y dielectroforética en función del campo eléctrico aplicado. Se puede observar que el comportamiento de la fuerza electrocinética con respecto al campo eléctrico es lineal; a campos eléctricos bajos la fuerza electrocinética es mayor a la dielectroforética; sin embargo, al aplicar una mayor intensidad de campo eléctrico se aprecia que la fuerza dielectroforética comienza a aumentar y llega a un punto en el que es mayor que la fuerza electrocinética. Lo anterior se debe a que la fuerza dielectroforética tiene un comportamiento de segundo orden con respecto a la intensidad del campo eléctrico.. 24.
(25) Figura 5. Esquema del comportamiento de las fuerzas dielelectroforética y electrocinética con respecto al campo eléctrico.. La dielectroforesis depende del gradiente de potencial del campo eléctrico. Si el campo eléctrico es de una intensidad baja, la dielectroforesis será despreciable comparada con la electrocinética (Figura 5), si se aumenta la intensidad del campo eléctrico a un grado tal que la DEF y el flujo electrocinético sean similares se tendrá un movimiento de biopartículas dirigido por la dielectroforesis, conocido como dielectroforesis de corriente. Si se continúa aumentando el campo eléctrico, se llega a un grado en el que la DEF es mayor que la electrocinética, la difusión y otros mecanismos de transporte; a este régimen se le denomina dielectroforesis atrapante (Cummings y Singh, 2003). La velocidad dielectroforética, la cual tiene una dependencia de segundo orden con el campo eléctrico, puede ser expresada como:. υ DEF = − μ DEF ∇( E • E ). (6). donde υ DEF es la velocidad dielectroforetica, μ DEF es la movilidad dielectroforética, y E es el campo eléctrico. La fuerza dielectroforética a un tiempo promedio que actúa sobre una partícula esférica, inmersa en un medio y expuesta a un campo eléctrico no uniforme puede ser descrita por:. 25.
(26) FDEF = 2πε m R 3p Re[K (ω )]∇E 2. (7). donde ∇E 2 es el gradiente del cuadradazo del campo eléctrico, ε m es la permitividad compleja del medio de suspensión, RP es el radio de la partícula (Zhang y col., 2005). Con el fin de simplificar la expresión para la fuerza dielectroforética, se define el factor de Claussius - Mossotti:. σ *p − σ m* K (ω ) = * σ p + 2σ m*. (8). Donde σ *p y σ m* son las conductividades complejas de la partícula y el medio respectivamente, las cuales se definen como: ⎛σ p ⎞ σ *p = σ p − j ⎜⎜ ⎟⎟ ⎝ω ⎠. ⎛σm ⎞ ⎟ ⎝ ω ⎠. σ m* = σ m − j⎜. (9). (10). donde j = − 1 , σ *p es la permitividad compleja de la partícula y σ m* es la permitividad compleja del medio de suspensión que contiene a la partícula (Zhang y col., 2005). A bajas frecuencias, debido a que el efecto electrostático dominante que es la conducción, Re[K (ω )] depende solamente de la conductividad de la partícula y del medio suspendido. En muchos sistemas, a frecuencias por debajo de 100 kHz o cuando se utiliza corriente directa, el factor de Claussius – Mossotti también puede definirse en base a las conductividades reales de la partícula y del medio como se muestra a continuación: (Zhang y col., 2005):. 26.
(27) K (ω ) =. σ p −σ m σ p + 2σ m. (11). donde σ p y σ m representan las conductividades de las partículas y del medio respectivamente. Por lo tanto, si la conductividad de la partícula es mayor que la conductividad del medio, la partícula exhibirá dielectroforesis positiva y viceversa (Zhang y col., 2005). En la presente investigación se utilizaron campos eléctricos de corriente directa, por lo tanto, el factor Claussius- Mossotti se puede definir en términos de las conductividades de la partícula y del medio. Al sustituir K (ω ) en la Ecuación 7 resulta otra definición de fuerza dielectroforética que está dada por: ⎡ σ p −σm ⎤ 2 FDEF = 2πR p3 ε m ⎢ ⎥∇ E ⎢⎣σ p + 2σ m ⎥⎦. (12). La fuerza dielectroforética tiene dos componentes, el primer componente deriva del componente real del momento dipolo inducido en la partícula por el campo eléctrico que conduce y da lugar al movimiento de la partícula hacia regiones de alto o bajo gradiente del campo eléctrico. El segundo componente de la fuerza dielectroforética deriva del componente imaginario del dipolo inducido y las variaciones espaciales en la fase del manejo del campo eléctrico (Allsopp y col., 1999).. 4.2.2 CLASIFICACIÓN DE LA DIELECTROFORESIS. El factor de Claussius– Mossotti no solamente depende de las propiedades dieléctricas de la partícula y el medio, también depende de la frecuencia del campo eléctrico aplicado. Las variaciones en este factor aumentan la fuerza dielectroforética, que es la frecuencia. 27.
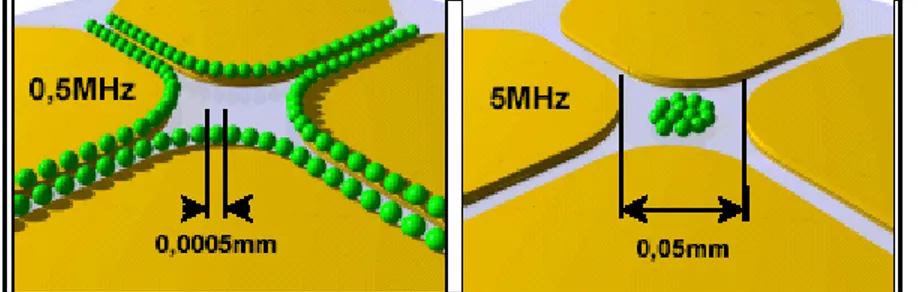
(28) dependiente y única para un tipo particular de partícula. Para una esfera, la parte real de K (ω ) está limitada por − 0.5⟨ Re[K (ω )]⟨1 y varía con la frecuencia del campo eléctrico aplicado y la permitividad compleja del medio. En base al factor de Clausius- Mossotti se han clasificado dos tipos de dielectroforesis que se explican a continuación: Dielectroforesis positiva: La dielectroforesis positiva ocurre cuando Re[K (ω )]⟩ 0 (el. factor toma valores entre 0 y 1) la fuerza dielectroforética es dirigida hacia la región de mayor intensidad de campo eléctrico (Zhang y col., 2005). Si la polarización de la partícula es mayor que la del medio de inmersión, el dipolo inducido es paralelo al campo eléctrico y la partícula es dirigida hacia las regiones de mayor intensidad de campo eléctrico y el factor de Clausius- Mossotti es positivo (Gascoyne y Vykoukal, 2002). Dielctroforesis negativa: La dielectroforesis negativa ocurre cuando Re[K (ω )]⟨ 0 (el. factor toma valores entre 0 y -0.5), la fuerza dielectroforetica es dirigida hacia la región de menor intensidad del campo eléctrico (Zhang y col., 2005). Si la polarización de las partículas es menor que la del medio de inmersión, el dipolo inducido es antiparalelo al campo eléctrico y la partícula es repelida hacia regiones de menor intensidad de campo eléctrico y el factor de Clausius- Mossotti es negativo. Una misma partícula puede exhibir dielectroforesis positiva o negativa dependiendo de la frecuencia del campo aplicado (Gascoyne y Vykoukal, 2002). Gascoyne y Vykokual realizaron un estudio utilizando microelectrodos de tipo hiperbólico (Figura 6). En estos experimentos se hicieron variaciones en la frecuencia del campo eléctrico aplicado con el fin de observar las respuestas dielectroforéticas de las partículas (Gascoyne y Vykoukal, 2002). La imagen de la Figura 6 (a) muestra partículas con dielectroforesis positiva a una frecuencia de 0.5 MHz, se observa que las partículas quedaron atrapadas alrededor de las regiones de alta intensidad de campo eléctrico junto al electrodo. La Figura 6 (b) muestra partículas con dielectroforesis negativa cuando se aplicó un campo con una frecuencia de 5 MHz y se puede observar que las partículas fueron repelidas por las regiones de alta 28.
(29) intensidad de campo eléctrico y se ubicaron en el centro de los electrodos, donde la intensidad del campo eléctrico es menor (Gascoyne y Vykoukal, 2002).. (a) DEF positiva. (b) DEF negativa. Figura 6. Representación del movimiento de partículas en los electrodos hiperbólicos. (Gayscone y Vykoukal, 2002).. 4.3 DIELECTROFORESIS CON ELECTRODOS En gran parte de las investigaciones que se han realizado con dielectroforesis se han empleado electrodos para producir los campos eléctricos no homogéneos. Los primeros experimentos con DEF para biopartículas fueron llevados a cabo por Pohl y Hawk en 1966, ellos utilizaron electrodos en forma de varilla y en forma de placa para diferenciar las células de levaduras vivas y muertas en la superficie del electrodo (Pohl y Hawk, 1966). Actualmente los dispositivos dielectroforéticos comunes emplean microelectrodos metálicos (generalmente de oro o de platino) depositados en un sustrato de vidrio o de silicio localizado dentro de un microcanal para generar un campo eléctrico no uniforme que interactúa con partículas cercanas a la superficie de los electrodos. Los campos eléctricos son típicamente generados por una fuente de fase sencilla, pero fuentes multifases pueden atrapar y secuencialmente transportar partículas en una técnica llamada dielectroforesis de onda viajera. Estos dispositivos para DEF basados en electrodos han demostrado ser efectivos para separar y concentrar células, proteínas, ADN y virus y también para manipular nanotubos de carbón (Simmons y col., 2006).. 29.
(30) La DEF se puede utilizar para separar diversas partículas de una mezcla a través de su migración y su posterior recolección en una región del campo diferente. La geometría de electrodos más comúnmente usada para generar un campo eléctrico no uniforme es la polinominal y se muestra en la Figura 7. Como se puede observar, cuatro electrodos se utilizan para producir una geometría cuádruple donde los electrodos son colocados a 90 grados uno del otro. La aplicación del voltaje es logrado con electrodos de alambres colocados diagonalmente enfrente uno de otro en forma idéntica. Una vez que el voltaje se aplique después de la introducción de la muestra, las partículas que experimentan DEP positiva se moverán a los bordes del electrodo, y ésas que experimentan DEP negativa se moverán en el centro, donde seguirán atrapados. La desventaja principal detrás de este método es que las partículas no se pueden recoger por separado por procesos de purificación (Zhang y col., 2005).. Figura 7. Representación de un electrodo polinominal (Zhang y col., 2005).. La Figura 8 representa tres distintas configuraciones de electrodos que se utilizan comúnmente: a).- polinominal, b).- electrodos dentados y no dentados, c).- circular. En dispositivos que contienen cuatro distintas configuraciones de electrodos, la aplicación del voltaje puede variar. Una posibilidad es usar patrones donde los electrodos estén alternados y tengan voltajes aplicados. Otra posibilidad es tener un voltaje que varíe con los cuadrados concéntricos (González y Remcho, 2005).. 30.
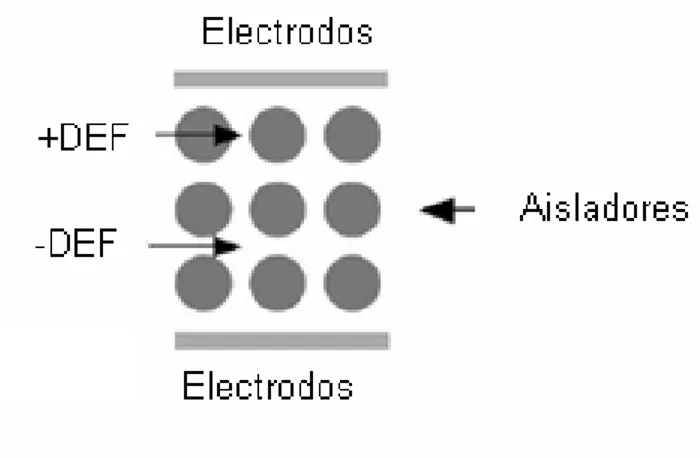
(31) Figura 8. Típica geometría del recipiente y regiones donde la DEF positiva y negativa están localizadas. La Figura 8 (a) muestra un arreglo de electrodos polinominal, la Figura 8 (b) muestra una geometría de electrodos con electrodos dentados y no dentados. La Figura 8 (c) muestra un arreglo de electrodos circulares (González y Remcho., 2005).. Con el arreglo de geometrías de electrodos, la región de potencial elevado está localizada sobre la superficie del electrodo y hay partículas que experimentan dielectroforesis positiva y se moverán hacia la superficie de los electrodos. Partículas que experimentan dielectroforesis negativa se moverán hacia la región de potencial bajo y se localizan en áreas más alejadas de los electrodos (González y Remcho, 2005).. 4.4 DIELECTROFORESIS CON AISLADORES Los aisladores representan una opción viable para generar campos eléctricos no uniformes y poder llevarse a cabo la dielectroforesis. Los aisladores pueden tener diferentes geometrías y ser de distintos materiales. El propósito de las estructuras aisladoras es funcionar como “obstáculos” para el campo eléctrico y así obtener regiones de diferente intensidad de campo eléctrico. La dielectroforesis (sin electrodos) basada en aisladores es un nuevo enfoque en el cual el campo eléctrico no uniforme requerido para crear la dielectroforesis es producido por aisladores y esta técnica a su vez, evita problemas asociados con el uso de electrodos 31.
(32) (Lapizco-Encinas y col., 2004a). Esta técnica utiliza obstáculos aisladores en lugar de electrodos dentro del dispositivo para producir regiones no uniformes del campo eléctrico que es aplicado a través del líquido suspendido. La eliminación de electrodos metálicos en contacto con líquidos permite el uso de campos eléctricos de corriente alterna a una frecuencia menor a 1 kHz y también de corriente directa (Simmons y col., 2006). Las ventajas de la dielectroforesis sin electrodos con aisladores son las siguientes: 1) No hay evaporación del metal durante la fabricación, 2) la estructura es mecánicamente robusta y químicamente inerte y 3) un campo eléctrico muy alto se puede aplicar sin la evolución del gas debido a la electrólisis del metal en los electrodos de la dielectroforesis (Chou y col., 2002). La gran mayoría de los trabajos, donde se ha utilizado la dielectroforesis con aisladores para la concentración y separación de biopartículas, se han llevado a cabo utilizando campos eléctricos con corriente alterna. Chou y colaboradores demostraron la concentración de ADN utilizando un microdispositivo con postes aisladores dentro de un microcanal y esto lo hicieron aplicando un campo eléctrico con corriente alterna (CA) (Chou, 2002). Suehiro y colaboradores utilizaron micro-esferas de vidrio, como aisladores, para la concentración y separación de células de levadura en agua (Suehiro, 2003a, 2003b, 2003c y Zhou, 2002). Se han reportado diversas maneras para producir la dielectroforesis atrapante utilizando estructuras aisladoras en lugar de microelectrodos metálicos demostrando que el ADN se puede atrapar utilizando esos dispositivos. En un canal para micro fluídica, la construcción de estos aisladores es usada para contraer el campo eléctrico en una solución conductiva, tal como un buffer iónico (Chou y col., 2002). El arreglo consiste en construir diferentes microdispositivos con postes del mismo material, que en este trabajo fue con vidrio y con plástico con diversas geometrías. La Figura 9 muestra una geometría sin electrodos donde las regiones de baja intensidad de campo eléctrico son producidas por la compresión del campo eléctrico entre un arreglo. 32.
(33) de aisladores y así se crean regiones de alta y baja intensidad de campo eléctrico, es decir, la no homogeneidad del campo eléctrico (González y Remcho, 2005).. Figura 9. Típica geometría del dispositivo y regiones aisladoras donde la DEF positiva y negativa están localizadas (González y Remcho., 2005).. La dielectroforesis con aisladores tiene diversas aplicaciones utilizando corriente directa. Cummings y Singh desarrollaron un método alternativo en el cual arreglos de los postes aisladores en un canal de un microdispositivo producen los campos eléctricos no uniformes que son necesarios para la dielectroforesis. Los microdispositivos empleados fueron de vidrio y cada canal contenía arreglos uniformes de postes en forma de diamantes, cuadrados y circulares a diferentes ángulos con respecto al campo eléctrico aplicado. En su investigación tuvieron resultados interesantes ya que a bajos campos eléctricos la dielectroforesis es muy pequeña comparada con la fuerza electrocinética y a altos campos eléctricos aplicados, la dielectroforesis domina sobre otros mecanismos de transporte (Cummings y Singh, 2003). 4.5 APLICACIONES DE LA DIELECTROFORESIS La dielectroforesis es el movimiento de las partículas en la presencia de un campo eléctrico no uniforme. Este fenómeno fue descubierto por Pohl en 1951 (Pohl, 1951 y 1958). La dielectroforesis como técnica de separación tiene una gran capacidad para la concentración y la manipulación de partículas (Jones, 1995) y tiene diversas aplicaciones que se mencionan a continuación.. 33.
(34) 4.5.1 DIELECTROFORESIS. PARA. LA. MANIPULACIÓN. DE. MICROORGANISMOS.. Existe un gran interés en la manipulación dielectrofororética de microorganismos y biomoléculas como ADN y proteínas (Morgan 1997 y Hughes 1998, 2001, 2002). La dielectroforesis es un método de rápida respuesta, con selectividad suficiente para la separación y concentración de microorganismos, lo que representa una gran ventaja sobre los métodos tradicionales de análisis (Lapizco-Encinas y col., 2004a). La aplicación de la dielectroforesis para la separación de microorganismos fue demostrada por primera vez en 1966 (Pohl y Hawk, 1966). Pohl y Hawk en su trabajo de investigación separaron células de levadura vivas de las muertas utilizando dielectroforesis. Las diferencias en el comportamiento de las células bajo la acción de un campo eléctrico no uniforme puede ser usado para producir migración selectiva de células sencillas de organismos (Pohl y Hawk, 1966). Se han llevado a cabo separaciones de bacterias Gram-positivas y Gram-negativas con micro electrodos interdigitados (Markx, 1994a). También se han llevado a cabo separaciones entre células vivas y muertas con sistemas de microelectrodos (Li, 2002 y Markx, 1994b). Sistemas de electrodos en tres dimensiones se han utilizado para levitar células bacterianas dentro de un microdispositivo, logrando aislar células separadas (Medoro, 2002a , 2002b y 2004). Además, existen reportes que usando la dielectroforesis con electrodos se pueden concentrar y analizar parásitos protozoarios (Quinn, 1996). La dielecroforesis es una técnica eficiente como los microsistemas integrados que diseñaron Lagally y colaboradores para atrapar células de una muestra de una corriente de flujo continuo vía dielectroforesis positiva y así redujeron el volumen que rodeaba a las células capturadas para posteriormente realizar una detección genética en el analito y este tipo de análisis genéticos de células bacterianas constituye uno de los principales objetivos de la biotecnología (Lagally, 2005). 34.
(35) 4.5.2 APLICACIONES DE LA DIELECTROFORESIS EN SISTEMAS AMBIENTALES.. Muchos de los métodos bacteriológicos para el análisis del agua, actualmente implican largos pasos de cultivo para obtener muestras concentradas, las cuales conducen a retrasos indeseados en el análisis. Por ejemplo, el detectar organismos coniformes en el agua requiere métodos de presencia-ausencia, filtro de membrana, y fermentación con múltiples tubos, los cuales requieren incubación por 24-48 hrs en medios basados en lactosa y/o sustrato definido. La Dielectroforesis (DEF) es un mecanismo de transporte electrostático con una dependencia no lineal en campos eléctricos, y puede ser utilizada para concentrar y separar microorganismos, motivando su uso como una alternativa a los sistemas de monitoreo de cultivo en agua (Lapizco-Encinas y col, 2004b). Betts y Brown realizaron análisis de la presencia de bacterias. Las células se mueven hacia los electrodos debido a sus propiedades dieléctricas en agua empleando dielectroforesis. Las células bacterianas se mueven hacia los electrodos debido a sus propiedades dieléctricas como son la conductividad y la permitividad y la carga como ocurre en la electroforesis. La polaridad y la magnitud de la fuerza dielectroforética varían como una función de la frecuencia del campo eléctrico (Betts y Brown, 1999).. 4.5.3 APLICACIONES CLÍNICAS DE LA DIELECTROFORESIS.. Los recientes desarrollos de avances analíticos y metodologías de bioseparación basadas en microarreglos y biosensores es uno de los objetivos estratégicos de los también llamados post–genómicos. En este campo, el desarrollo de dispositivos microfabricados donde se experimenta la dielectroforesis puede generar nuevas oportunidades en una gran cantidad de aplicaciones, tales como oncología predictiva, diagnósticos e investigación de nuevos medicamentos para el tratamiento antitumoral. Ver Figura 10 (Gambari y col., 2003).. 35.
(36) Gambari y colaboradores experimentaron en la investigación oncológica ya que existe una gran variedad de aplicaciones de la DEF en esa área, cuyo estudio incluyó la separación y caracterización de células tumorales normales sin usar anticuerpos como monoclones (Ver Figura 11), así también realizaron estudios de proteómica y perfiles de expresión genética y avances en descubrimientos de nuevos medicamentos cancerígenos. Desde el punto de vista metódico Gambari y colaboradores consideraron que en muchos dispositivos no ópticos donde se emplea la DEF es necesario seguir el movimiento de objetos biológicos atrapados tales como células observando diferentes respuestas dielectroforéticas. En la mayoría de los dispositivos donde se emplea la DEF, la localización y el movimiento de células son controladas. Con su trabajo, Gambari y colaboradores demostraron que la cuantificación de células es posible (Gambari y col., 2003).. Figura 10. Prototipo del dispositivo de para la Investigación del cáncer mediante dielectroforesis. (Gambari y col., 2003).. Figura 11. Levitación de la célula de Leucemia K562 del electrodo 1 al 2 (Gambari y col., 2003).. 36.
(37) Se han llevado a cabo estudios para la identificación de células cancerígenas empleando la dielectroforesis con varios métodos en los que la dielectroforesis puede ser usada para la selección de una población específica de células. Se toma como base para esta selección la morfología de la célula para atrapar dicha célula mientras se liberan otras empleando la dielectroforesis donde la partícula experimenta un perfil de flujo como se muestra en la Figura 12. Existe un método que consiste en la combinación de dielectroforesis con el fraccionamiento del campo de flujo para poder detectar células tumorales y separarlas de una mezcla de células normales (Gascoyne y Vykoukal, 2002).. Figura 12. Vista lateral del microcanal para dielectroforesis y fracción del campo de flujo (Gascoyne y Vykoukal 2002).. 37.
(38) 5 MATERIALES, EQUIPOS Y MÉTODOS Durante el desarrollo de esta investigación se utilizaron distintos materiales, equipos y métodos que se describen a continuación.. 5.1 MATERIALES 5.1.1 ALBÚMINA DE SUERO DE BOVINO (ASB). Es una proteína cuyo peso molecular es alrededor de 66.430 KDa. La ASB es una cadena polipéptida sencilla que consiste de aproximadamente de 583 residuos de aminoácidos y no está formada por carbohidratos. En un rango de pH de 5 a 7 contiene 17 intracadenas de disulfido y un grupo sulfhidrilo. La ASB es sometida a un protocolo de teñido para que se pueda observar en el microscopio. El protocolo de teñido se menciona en la sección de Métodos.. 5.1.2 TINTE ISOTIOCIANATO DE FLUORESCEÍNA (ITCF). Es un tinte muy utilizado para agregarle una etiqueta fluorescente a las proteínas que contienen grupos aminos. El grupo isotiocianato reacciona con el término amino y con las aminas primarias en la proteína. Este tinte ha sido utilizado para etiquetar proteínas incluyendo anticuerpos y lecitinas. Su apariencia es la de un polvo color amarillo y naranja, cuya fórmula molecular es C21H11NO5S. Este tinte fue comprado a la compañía Sigma Aldrich Química S.A. de C.V. (Toluca, Edo. de México). Los espectros de absorción y emisión del tinte isotiocianato de fluoresceína se presentan en la Figura 13.. 39.
(39) Figura 13. Espectro de absorción y emisión del tinte Isotiocianato de fluoresceína (ITCF) (Crisp, 2006).. En la Figura 13 se puede observar que la absorción del tinte ITCF se lleva a cabo en el rango de 430– 510 nm y la emisión se lleva a cabo en el rango de 460- 630 nm. El microscopio de trabajo emite luz azul que excita a 480 nm, como se observa en la Figura 13, el tinte ITCF tiene su máxima excitación a una longitud de onda de 495 nm, por lo tanto es adecuado utilizar este tinte ITCF con este microscopio. Además el tinte ITCF emite luz a 520 nm y el microscopio de trabajo nos permite ver emisiones con longitud de onda mayores a 515 nm por lo tanto sí es posible observar la emisión.. 5.2 EQUIPOS 5.2.1 SVM 340. Es un microscopio de video invertido para microfluídica y microbiología que incluye una cámara fotográfica que permite grabar videos a una velocidad de 30 cuadros por segundo. Este microscopio permite colocar el microdispositivo en su parte superior, de tal manera que el microdispositivo es iluminado en la parte inferior. Para la realización de los experimentos se utilizó un objetivo 4X. La cámara de video integrada al microscopio. 40.
(40) permite grabar los resultados de los experimentos como videos y fotografías, mediante la utilización del software que acompaña al microscopio.. Figura 14. Imagen del microscopio SVM 340 ( LabSmith. Livermore, CA, USA).. 5.2.2 H VS 448. El secuenciador de alto voltaje de LabSmith HVS448 provee ocho canales de alto voltaje, con la capacidad de programarse para utilizar un nuevo nivel de la manipulación del voltaje. El rango del voltaje es ± 3,000 V y la corriente tiene un rango de ± 100 mA. Con la fuente de poder se aplica el voltaje través de los electrodos colocados a la entrada y salida de cada canal. El voltaje aplicado a los electrodos es controlado con el software que acompaña a la fuente de poder.. Figura 15. Imagen del secuenciador HVS 448 ( LabSmith. Livermore, CA.).. 41.
(41) 5.2.3 CENTRÍFUGA EPPENDORF 5804R. La centrífuga marca Eppendorf modelo 5804R fue comprada a Brinkman donde el rango de volumen de las muestras que se introducen en la centrífuga es de 4 a 100 ml y el rango del tiempo de centrifugado es de 1 a 99 minutos. El rango de temperatura es de -9 a 40 oC y tiene un rotor que puede centrifugar hasta 14,000 revoluciones por minuto (rpm). En esta centrífuga se introduce la proteína después del procedimiento de etiquetado y se realizan 3 lavados de 1 hora a 3000 rpm. Cada lavado se realiza con el buffer de carbonato de sodio con pH 9.. Figura 16. Imagen de la centrífuga Eppenfor 5804R (Brinkman, USA).. 5.2.4 HORNO TERMOLYNE 62700. El horno marca Termolyne modelo 62700 tiene un elemento de calefacción en forma ovalada que se encaja directamente en el aislamiento de fibra de cerámica para la distribución uniforme del calor a través del compartimiento con un puerto incorporado a un respiradero para que elimine los contaminantes y la humedad indeseables, es muy útil ya que en él se incineran los residuos de materia orgánica del microdispositivo de vidrio en el cual se realizaron los experimentos.. 42.
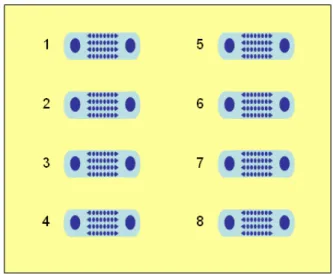
(42) Figura 17. Imagen del horno Termoline 62700 (USA).. 5.2.5 MICRODISPOSITIVO EMPLEADO. Se emplearon microdispositivos fabricados en vidrio para el atrapamiento de proteínas, pero además se anexa una demostración de atrapamiento de proteínas utilizando microdispositivos de plástico con el único objetivo de probar que sí se pueden atrapar proteínas en ese material, pero no es el propósito de este trabajo;. ambos. microdispositivos se describen a continuación. Los microdispositivos de vidrio fueron fabricados por la compañía NexGen (Atlanta, GA, USA). Están fabricados de un vidrio especial para microfluídica llamado Schott D263 comprado a Howard Glass Company (Worcester, MA). Los microdispositivos fueron fabricados usando grabado húmedo y están compuestos por dos obleas cuadradas de 2 pulgadas cada lado, el ancho de cada oblea es de 1.1 mm; los microdispositivos contienen 8 microcanales, cada microcanal tiene una longitud de 10.16 mm, un ancho de 2 mm y una profundidad de 10 micras. Cada canal está alineado con dos reservorios para el flujo de entrada y salida del líquido. Los reservorios están en la oblea superior y los canales están en la oblea inferior. Los arreglos de los postes son circulares y atraviesan la profundidad del microcanal. En la Figura 18 se puede observar la vista superior del microdispositivo de vidrio.. 43.
(43) Figura 18. Vista superior del microdispositivo de vidrio.. En la Figura 19 se puede observar una vista superior del microcanal así como los postes de los microcanales que se describirán más adelante y en la Figura 20 se observa una vista lateral del microcanal. Los postes tienen una altura de 10 micras y el diámetro de los micropostes varía y está en un rango entre 200 – 400 micras.. Figura 19. Vista superior del microcanal de vidrio.. Figura 20. Vista lateral del microdispositivo de vidrio.. En la Figura 21 se maestra la distribución de los ocho microcanales de un microdispositivo de vidrio.. 44.
(44) Figura 21. Distribución de los ocho canales de un microdispositivo elaborado en vidrio.. Un lado del microdispositivo tiene canales con barreras (canales 1-4) y el otro lado tiene canales con postes que se emplean en el presente trabajo (canales 5-8). En la Tabla 2 se describe los últimos cuatro microcanales del microdispositivos de vidrio. Tabla 2. Características de los microcanales con postes aisladores del microdispositivo de vidrio.. No. Tipo de de aislador. canal. Distancia entre los postes. No. de filas. Diámetro Distancia del poste de dentro a centro. No. de postes por fila. 5, 6. Postes. 40 micras. 8. 470 micras. 510 micras. 4. 7, 8. Postes. 80 micras. 8. 440 micras. 520 micras. 4. El potencial zeta del vidrio es negativo en el rango de pH (en este trabajo se emplearon soluciones con pH entre 8 y 9) para la mayoría de las muestras biológicas (entre 5 y 8) ( Simmons y col. , 2006).. 45.
Figure



Documento similar
¿Cómo se traduce la incorporación de ésta en la idea de museo?; ¿Es útil un museo si no puede concebirse como un proyecto cultural colectivo?; ¿Cómo puede ayudar el procomún
Primeros ecos de la Revolución griega en España: Alberto Lista y el filohelenismo liberal conservador español 369 Dimitris Miguel Morfakidis Motos.. Palabras de clausura
"No porque las dos, que vinieron de Valencia, no merecieran ese favor, pues eran entrambas de tan grande espíritu […] La razón porque no vió Coronas para ellas, sería
Volviendo a la jurisprudencia del Tribunal de Justicia, conviene recor- dar que, con el tiempo, este órgano se vio en la necesidad de determinar si los actos de los Estados
Porcentaje de radiación solar interceptada (RSI; 0,35 - 2,5 µm) y de radiación fotosintéticamente activa interceptada (RFAI) a lo largo del ciclo de cultivo para las
En cuarto lugar, se establecen unos medios para la actuación de re- fuerzo de la Cohesión (conducción y coordinación de las políticas eco- nómicas nacionales, políticas y acciones
b) El Tribunal Constitucional se encuadra dentro de una organiza- ción jurídico constitucional que asume la supremacía de los dere- chos fundamentales y que reconoce la separación