Esta obra está bajo una Licencia Creative Commons Atribución- NoComercial-CompartirIgual 2.5 Perú. Vea una copia de esta licencia en
UNIVERSIDAD NACIONAL DE SAN MARTÍN - TARAPOTO
FACULTAD DE CIENCIAS AGRARIAS
DEPARTAMENTO ACADÉMICO AGROSILVO PASTORIL
ESCUELA ACADÉMICA - PROFESIONAL DE AGRONOMÍA.
“EFECTO DE MICROORGANISMOS EFICACES (EM)
EN EL RENDIMIENTO DE CEBOLLA CHINA
(Allium fistolosum L.) VARIEDAD ‘SIMBA’ EN EL
BAJO MAYO – SAN MARTÍN”.
TESIS
PARA OPTAR EL TÍTULO PROFESIONAL DE
INGENIERO AGRÓNOMO
PRESENTADO POR EL BACHILLER:
EDWARD TANGOA TUESTA.
TARAPOTO – PERÚ
DEDICATORIA
A Dios Padre que ilumina y guía cada paso que doy en esta vida.
A mis Querido Padres Eduardo y Lila, que con su gran Amor me Orientan y me Protegen, por su Apoyo incondicional, por su abnegado sacrificio, dedicación y entrega en lo moral, económico y espiritual que me brindaron para ser un profesional a demás por sembrar en mi la ambición de la superación y por brindarme la mejor herencia que es la educación, el cual es el cimiento de mi propio porvenir.
A mis Hermanos, Carlos
Alberto e Ivonne, que siempre me
brindan cariño, comprensión, por su apoyo constante que de una u otra forma, me apoyaron en los momentos mas difíciles y sobre todo me ayudan a seguir Adelante.
AGRADECIMIENTO
• Al Ingº. EYBIS JOSÉ FLORES GRACÍA, por darme la oportunidad de formar parte de su equipo y por el asesoramiento brindado en la realización de mi proyecto de Tesis.
• Al Ingº. DARIO MALDONADO VASQUEZ, por los sabios consejos brindados, durante el presente trabajo.
• Al Ingº. JORGE LUIS PELAES RIVERA, por su amistad, por el seguimiento en el presente proyecto, por los sabios consejos brindados, y sobre todo por ser un buen docente y compañero.
• A los miembros de la mesa de honor que estuvieron como Jurado calificador del presente proyecto, por los consejos y las observaciones brindadas.
ÍNDICE
Pág.
I. INTRODUCCIÓN 01
II. OBJETIVOS 03
III. REVISIÓN DE LITERATURA 04
3.4 Los Microorganismos y su Importancia en el Suelo 08
3.4.1. Microorganismos que benefician a las plantas 09
3.5 La tecnología de los microorganismos eficaces (EM) 11
3.5.1 Aspectos generales. 11
3.6 Modo de acción de los microorganismos eficaces (EM). 16
II. INTRODUCCIÓN
La naturaleza alberga una gran riqueza biológica y cultural, que a través del tiempo y de los aportes investigativos ha brindado beneficios a la humanidad, por lo que se hace necesario conservarla.
Debido al desarrollo de los países considerados del primer mundo, nuestro sistema ecológico se está deteriorando, que nos lleva a pensar que en corto plazo nuestro planeta será inhabitable.
Por otro lado, la fabricación de productos agroquímicos y su incorrecto uso están causando graves problemas de contaminación de suelo, agua, aire, hoy en día los grandes compradores de nuestros productos agrícolas exigen un producto orgánico, es por ello que se han implantado estándares de calidad, siendo esto una dificultad para nuestro país, puesto que nuestra agricultura es en su mayoría a base de productos agroquímicos ya prohibidos en Norte América, Europa y Asia. Como casos puntuales los productores que pasan a diario estos problemas de no aprobar los estándares de calidad.
La cebolla china (Allium fistolosum L.) es una hortaliza que por su rendimiento económico es muy importante en muchos países. Este producto por su alto valor nutricional rico en vitaminas A, B, C, y la variedad de formas en su consumo forma parte de nuestra dieta. En este cultivo se deben emplear buenas prácticas de campo para obtener productos en cantidad y de buena calidad.
Los consumidores se ven beneficiados con la seguridad de consumir un producto 100% natural, libre de químicos, saludables y de alto valor nutritivo.
III. OBJETIVOS.
2.1 Objetivos generales.
Evaluar y Comparar el efecto del producto conocido como Microorganismos Eficaces (EM) a diferentes concentraciones de aplicación foliar sobre el crecimiento, rendimiento, calidad del cultivo cebolla china (Allium
fistolosum L.) Variedad “Simba” conducido bajo cultivo orgánico.
2.2 Objetivos específicos.
Identificar las especies patógenas de hongos en cada uno de los análisis microbiológicos y el efecto que causa los Microorganismos Eficaces EM.
IV. REVISIÓN DE LITERATURA
3.1 AGRICULTURA ORGÁNICA O NATURALEZA
ZARB y LITTERICK (2001), menciona que toma como modelos a los procesos que ocurren de manera espontánea en la naturaleza, evita la utilización de agroquímicos para la producción. La agricultura Orgánica en el mundo es visto como un sistema de agricultura alternativa, que podría mejorar la calidad de los ambientes degradados.
3.2 MATERIA ORGÁNICA DEL SUELO.
La materia orgánica procede de los seres vivos (plantas o animales superiores o inferiores) y su complejidad es tan extensa como la composición de los mismos, la descomposición en mayor o menor grado es provocada por la acción de los microorganismos o por factores abióticos que da lugar a un abanico muy amplio de sustancias en diferentes estados que son los constituyentes principales de la materia orgánica y este contiene casi el 5% de nitrógeno total, contiene otros elementos esenciales para las plantas como: fósforo, magnesio, calcio, azufre y micronutrientes
(BOTERO, 2005); en cuanto a las mejoras observadas con respecto a las características químicas, físicas y biológicas da soporte a todo un mundo de microorganismos cuya actividad resulta beneficiosa para el cultivo. El uso de materia orgánica es primordial en la agricultura o biológica
3.2.1 ABONOS ORGÁNICOS.
GUERRERO (2008); dice que se denomina abono orgánico a la
degradación y mineralización de materiales orgánicos como material vegetal o animal que sufre una biotransformación a través del tiempo por acción de los microorganismos; el uso de abonos orgánicos es una herramienta para el mejorar suelos degradados, empobrecidos por el uso agrícola a través del tiempo para así mejorar las características físicas, químicas, biológicas y consecuentemente mejorar la fertilidad, por lo que debemos destacar que es un proceso.
PERSONS (1993), menciona que los abonos orgánicos se aplican antes de la siembra o transplante; el estiércol y la paja deben picarse, esparcirse o incorporarse a la tierra por lo menos 4 semanas antes de la siembra.
cultivos en crecimiento cantidades pequeñas de elementos metabólicos, reduciendo así la densidad aparente del suelo aumentando la infiltración y el poder de retención de agua en el suelo.
3.2.2 Tipos de abonos orgánicos.
a. El humus.
BRAVO y RADICKE (1998), citado por CRUZ (2002), expresa que el humus es el mejor abono orgánico, ya que posee un contenido muy alto en nitrógeno, fósforo, potasio, calcio y magnesio asimilables, acompañado por gran cantidad de bacterias, hongos y enzimas que continúan el proceso de desintegrar y transformar la materia orgánica.
b. El compost.
El Compost como un producto de descomposición de residuos vegetales y animales, con diversos aditivos. Este grupo es el más amplio de los abonos orgánicos; comprende desde materiales sin ninguna calidad, procedente de los basureros, hasta sustratos perfectamente preparados con alto poder fertilizante.
c. El abono verde.
INIA (2005), menciona que se cortan en la época de floración (10 - 20%) y se incorporan en los 15 primeros centímetros del suelo, para regular su contenido de nitrógeno y carbón y mejora sus propiedades físicas y biológicas
d. Los bioles.
BRAVO y RADICKE (1998), citado por CRUZ (2002), indica que es una fuente de fitorreguladores que se obtienen como producto de la descomposición anaeróbica de los desechos orgánicos, a diferencia de los nutrientes en pequeñas cantidades, es capaz de promover actividades fisiológicas y estimular el desarrollo de las plantas, sirviendo para actividades agronómicas como: enraizamiento (aumenta y fortalece la base radicular), acción sobre el follaje (amplía la base foliar), mejora la floración y activa el vigor y poder germinativo de las semillas, traduciéndose todo esto en aumento significativo de las cosechas.
3.3 MICROBIOS EN LA AGRICULTURA.
animales, otros producen reacciones desfavorables como desarrollo de organismos que producen enfermedades en plantas.
CIIAN – Japón, (1994), indica que los factores que afectan la abundancia de los organismos del suelo son: humedad, temperatura, aireación, suministro de nutrientes, pH del suelo y el tipo de cultivo
3.4 LOS MICROORGANISMOS Y SU IMPORTANCIA EN EL SUELO.
TORO CASTAÑO (2006) menciona que, los microorganismos son
organismos normalmente formados por una sola célula, al principio, no eran vistos como un tipo diferente de organismo.
+ USOS.
El uso de los microbios en forma de lodos y estiércol animal tiene una larga historia en la agricultura, el uso de Rhizobium y Micorrízas añade una nueva dimensión a la tecnología de microorganismos en la agricultura, las investigación han demostrado claramente los beneficios de la utilización de inoculantes naturales de los microbios en el aumento de la productividad de la agricultura convencional y ecológico, los microorganismos del suelo, son los componentes más importantes, constituyen su parte viva y son los responsables de la dinámica de transformación y desarrollo, en un gramo de tierra, encontramos millones de microorganismos beneficiosos para los cultivos (TISDAL, 1994).
disponibles para la planta, o una población microbiana que libere nutrientes que permitan un buen desarrollo vegetal; en la agricultura tradicional se alternaban las líneas de cultivo en el suelo, o bien se dejaba descansar la tierra durante un tiempo. Actualmente, en la agricultura intensiva, el suelo apenas está sin cultivo, y se planta siempre en la misma línea de terreno, por lo que degradamos el suelo rápidamente (AEET, 2005).
Por todas estas razones, se está empleado lo que se denomina “Tecnología EM”, que consiste en aumentar el número de microorganismos de un suelo, para de esta forma, acelerar todos los procesos microbianos, aumentar la cantidad de nutrientes asimilables por la planta, los microorganismos actúan a la vez como agentes de control biológico, con lo que reducimos aquellos microorganismos indeseables en el suelo y favorecemos los organismos útiles para los cultivos, con lo que aumentamos la producción de la planta (EARTH, 2009).
3.4.1 Microorganismos que benefician a las plantas.
juntos habitualmente (pero no necesariamente), con beneficio recíproco para el hospedero (planta) y el simbionte (bacteria).
(FERNÁNDEZ, 2008), menciona que, no solo existen hongos
beneficiosos para los cultivos, sino que existen otros seres mucho más pequeños que los anteriores, que también tienen grandes efectos positivos en la planta, algunas bacterias, han demostrado una gran capacidad en la fijación biológica de nitrógeno libre y no simbiótico, elaboran una serie de metabolitos como vitaminas, enzimas y otros compuestos beneficiosos, que van a ser absorbidos por las raíces, estos nutrientes estimulan el crecimiento y desarrollo de la planta.
La mayor actividad de estos microorganismos se realiza desde la superficie del suelo, hasta unos 20 centímetros de profundidad. Sus colonias permanecen adheridas en las partículas del suelo y sobre las raíces de las plantas, ya que así les aportan sustancias orgánicas, que son utilizadas como alimento (UNAC –Colombia, 2005),
En presencia de materia orgánica, bacterias y algas fotosintéticas pueden utilizar longitudes de onda que van desde 700 a 1200 nm;
bacterias, actinomiceto, hongos, algas y protozoarios considerados habitantes de la comunidad. Las bacterias tienen una amplia diversidad bioquímica por ello son las mas abundantes de los cuatro grupos (HIGA, 1994).
Restaurar la vida del suelo para incrementar la producción de nuestros cultivos, la causa de la pérdida de fertilidad es causada por la excesiva explotación y la utilización de altas dosis de abonos químicos, que ha desembocado en un empobrecimiento de la tierra que afecta a su fertilidad, como la destrucción de la materia orgánica, la microestructura del suelo, la erosión, la pérdida de fertilidad y de la vida en los suelos (RAAA, 2004).
3.5 LA TECNOLOGÍA DE LOS MICROORGANISMOS EFICACES (EM).
3.5.1 Aspectos generales.
En el curso de su investigación, el profesor dispuso de una mezcla de microorganismos cerca de algunos arbustos. Encontró allí más adelante, crecimiento vegetal abundante. Inspirado por el feliz accidente, Higa empezó a investigar las mejores combinaciones hasta que en 1982 hizo la presentación formal, EM es una tecnología prebiótica y natural desarrollada, está compuesto por organismos benéficos y altamente eficientes, no son nocivos, ni patógenos, ni genéticamente modificados, ni químicamente sintetizados (EARTH, 2009).
Originalmente, fue desarrollada como alternativa para los fertilizantes químicos y pesticidas, sin embargo, el uso de la Tecnología EM, en las dos últimas décadas, se ha expandido de la agricultura al tratamientos de aguas y efluentes, control de malos olores, granjas y salud animal, salud humana e innumerables tratamientos industriales; actualmente el EM es usado alrededor del mundo. Más de 30 Centros de Investigación, distribuidos por varios países, diariamente, crean y analizan nuevas alternativas para incrementar y expandir aún más el rango de uso de esta Tecnología
(EMRO - Europa, 2008).
organismos beneficiosos de 3 géneros principales: bacterias fototrópicas, bacterias de ácido láctico y levadura. Estos microorganismos - efectivos, cuando entran en contacto con materia orgánica secretan sustancias beneficiosas como vitaminas, ácidos orgánicos y antioxidantes. Cambian la micro y la macroflora de la tierra, mejora el equilibrio natural y ésta a su vez tiene la capacidad de transformarse en tierra azimogénica.
Los efectos antioxidantes promueven la descomposición de materia orgánica y esto, a su vez, puede mejorar la calidad del suelo y la salud, lo cual aumenta el crecimiento, el rendimiento y la calidad de los cultivos, sirve como una excelente herramienta para la producción sostenible en la agricultura orgánica. (EARTH, 2009)
3.5.2 Principales microorganismos contenidos en el EM.
HIGA (2003) expresa que, los hongos, las bacterias, los
Actinomicetos y la levadura se encuentran en todos los ecosistemas, utilizados ampliamente en el sector alimenticio y esta especie desempeña papel vital en agricultura para mantener y también para realzar la productividad, mientras más completo sea el complejo de microorganismos benéficos mejor papel desempeñará en la biotransformación de la materia orgánica.
a. Bacteria fotosintética (Fototrópica).
• Bacterias Fotosintéticas: Rhodopseudomonas plastrus,
SANZ (2007), expresa que las bacterias fotosintéticas son microorganismos autosuficientes e independientes, sintetizan las substancias útiles producidas por la secreción de las raíces, materia orgánica y/o gases perjudiciales (como el sulfuro de hidrógeno) utilizando la luz solar y el calor del suelo como fuentes de energía. Las sustancias benéficas está compuestas por aminoácidos, ácidos nucleicos, sustancias bioactivas y azúcares, todas las cuales ayudan al crecimiento y desarrollo de las plantas.
Al crecer las bacterias fotosintéticas en los suelos aumentan la cantidad de otros microorganismos eficaces, pueden fijar el Nitrógeno atmosférico y el bióxido de Carbono en moléculas orgánicas tales como aminoácidos y carbohidratos, Llevan a cabo una fotosíntesis incompleta, lo cual hace que la planta genere nutrimentos, carbohidratos, aminoácidos, sin necesidad de la luz solar, eso permite que la planta potencialice sus procesos completos las 24 horas del día.
b. Bactérias Acido Lácticas.
• Bacterias del ácido láctico: Lactobacillus plantarum,
Lactobacillus casei, Streptococcus lactics.
desde hace un largo tiempo. El ácido láctico es un potente esterilizador, como tal, combate los microorganismos perjudiciales y acelera la descomposición de las materias orgánicas, facilitan la fermentación de materiales tales como la celulosa y evitando así causar perjuicios similares a los que se originan cuando estos materiales entran en descomposición. Ayuda a solubilizar la cal y el fosfato de roca.
c. Levaduras.
• Levaduras: Saccharomyces cerevisiae.
Las levaduras sintetizan y utilizan las substancias antimicrobianas que intervienen en el crecimiento de las plantas, a partir de los aminoácidos y azúcares producidos por las bacterias fotosintéticas, así como las de la materia orgánica y de las raíces de las plantas. Las substancias bioactivas, tales como hormonas y enzimas producidas por las levaduras incrementan la actividad celular y el número de raíces. Sus secreciones son substratos útiles para ciertos microorganismos efectivos, tales como las bacterias ácido lácticas y los Actinomycetes.
d. Actinomicetos.
materia orgánica, que suprimen hongos dañinos y bacterias patógenas, pueden coexistir con la bacteria fotosintética, ambas especies mejoran la calidad de los suelos a través del incremento de la actividad microbiana.
Funcionan como antagonistas de muchas bacterias y hongos patógenos de las plantas debido a que producen antibióticos (efectos biostáticos y biocida). Benefician el crecimiento y actividad del azotobacter y de las micorrizas
e. Hongos de Fermentación
Los hongos de fermentación como el Aspergillus y el Penicilina actúan descomponiendo rápidamente la materia orgánica para producir alcohol, esteres y substancias antimicrobianas.
Esto es lo que produce la desodorización y previene la aparición de insectos perjudiciales y gusanos(HIGA, 1997).
3.6 MODO DE ACCIÓN DE LOS MICROORGANISMOS EFICACES (EM).
encuentran, se incrementa la actividad de los microorganismos naturales, enriqueciendo la microflora, balanceando los ecosistemas microbiales, suprimiendo microorganismos patógenos.
3.6.1 Efecto de “EM” sobre el crecimiento y producción de las
cosechas.
FERNÁNDEZ (2008), menciona que, EM mejora el crecimiento y la
producción de cultivos incrementando la población de microorganismos beneficiosos en el suelo y aportando nutrientes a la planta, Inhibiendo otras bacterias y organismos nocivos, disminuye el grado de contaminación de agroquímicos; así también brinda mayor floración. En este aspecto, el efecto del EM en los cultivos fue probado a través de experimentos prácticos de campo.
Los resultados experimentales mostraban que un tratamiento primerizo con EM-1 era bueno para las plantas, ya que mejoraba el crecimiento radicular y los contenidos totales de nitrógeno en el suelo y clorofila en las hojas. Consecuentemente incrementaban el crecimiento del cultivo.
Cuadro 01: Efecto del tiempo de aplicación de EM en el
crecimiento de los cultivo
Cuadro 02: Efecto del EM- 1 en la producción de col china.
3.7 TRABAJOS REALIZADOS CON LA APLICACIÓN DE LA TECNOLOGÍA
EM.
a. Aplicación de la tecnología “EM” en la hidroponía – Brasil.
EMRO – Brasil (2009), indica que, la aplicación se hizo para determinar la mejor dosis de implantación de la Tecnología EM en el sistema de producción por hidroponía.
− 1 l de EM•1 por cada 500 l de solución nutritiva.
− 1 l de EM•1 por cada 1000 l de solución nutritiva.
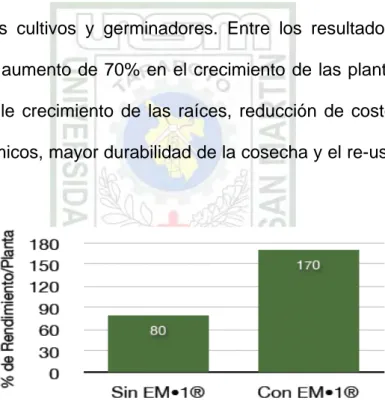
La dosis que presentó mejor efectividad y relación costo/beneficio fue la de 1 l de EM•1 para cada 2000 l de solución nutritiva diluido directamente en el tanque de bombeo una vez por semana durante todo el ciclo productivo, asociado al uso quincenal de EM•1 al 2% fumigado sobre los cultivos y germinadores. Entre los resultados mas notables están el aumento de 70% en el crecimiento de las plantas, aumento de 50% en le crecimiento de las raíces, reducción de costos y del uso de agroquímicos, mayor durabilidad de la cosecha y el re-uso de la solución nutritiva.
Gráfico 01: Resultado final de la Aplicación de EM en Hidroponía
b. EM usado en la nutrición y control de Sigatoka en EARTH– Costa
Rica.
Los resultados obtenidos motivan para continuar la investigación y desarrollo de la tecnología EM como un método eficaz para la sustitución de los fungicidas químicos en los programas de control de la Sigatoca Negra.
c. Evaluación del efecto que tienen los microorganismos eficaces
(EM) sobre la composición nutritiva y el consumo de los bloques
multinutricionales (BMN) – Costa Rica.
Buscando nuevas alternativas para suplementar el Ganado a bajo costo, se realizó este estudio en la Universidad EARTH, determinando el efecto que tienen los Microorganismos Eficaces (EM) en la composición nutritiva y consumo de los bloques Multinutricionales (BMN). El estudio reveló que hay pérdida del valor nutricional en el tiempo de almacenamiento de los BMN. Pero, 4 % y 6 %, el EM evitan en gran parte esa pérdida de su valor nutricional y además aumentan el consumo de BMN por parte de los rumiantes. Por eso, es recomendable utilizar entre 4 % y 6 % de EM para mantener el valor nutritivo y aumentar el consumo de los BMN.
3.8 CARACTERÍSTICAS MORFOLÓGICAS DE LA CEBOLLA CHINA (Allium
fistolosum L ).
MOROTO (1986), indica que la cebolla china es una planta de bulbo, hojas numerosas. Su periodo vegetativo es de 45 días, etapa en la que se cosechan los primeros macollos de una planta, dejando alguno de ellos para que cumpla su ciclo vegetativo, el bulbo de esa planta es usado como semilla, muchos horticultores lo cosechan mensualmente. (PÉREZ, 1979)
breve, bulbo poco ensanchable, ovoides, blanquecinos o rosados; a veces con solo un ligero ensanchamiento de la parte inferior de la planta, es una planta herbácea, hortícola cultivada por sus hojas con fines comerciales y culinarios.
Hoja de forma cónica, la parte interior vacío, el color de la hoja al trasplante cuando están tiernas es verde claro y a la cosecha verde oscuro, desprendiendo un olor característico, son plantas cuyas hojas son bien delicadas y se marchitan al sufrir algún incidente; (ARMAS, 2009) durante los tres primeros días, la frecuencia de riego son continuos.
(JUNTA DE USUARIOS DE RIEGO, 2008) de acuerdo al uso consultivo
del agua para aplicación de agua en la región san martín, la utilización de agua para las hortalizas es de 4.000m3 /ha/campaña
3.8.1 Ciclo vegetativo.
CASAS (2006), menciona que en el ciclo vegetativo de la cebolla se distinguen cuatro fases:
a. Crecimiento herbáceo.
Comienza con la germinación, formándose un tallo muy corto, donde se insertan las raíces y en el que se localiza un meristemo que da lugar a las hojas. Durante esta fase tiene lugar el desarrollo radicular y foliar.
b. Formación de bulbos.
base de las hojas interiores, que a su vez se engrosan y dan lugar al bulbo. Durante este periodo tiene lugar la hidrólisis de los prótidos; así como la síntesis de glucosa y fructosa que se acumulan en el bulbo. Se requiere fotoperiodos largos, y si la temperatura durante este proceso se eleva, esta fase se acorta.
c. Reposo vegetativo.
La planta detiene su desarrollo y el bulbo maduro se encuentra en latencia.
d. Reproducción sexual.
Se suele producir en el segundo año de cultivo. El meristemo apical del disco desarrolla, gracias a las sustancias de reserva acumuladas, un tallo floral, localizándose en su parte terminal una inflorescencia en umbela.
3.8.2 Ecologia de la cebolla china
IICA (2003), indica que, la cebolla china requiere de suelo fértil, franco arcilloso con buen drenaje pH optimo entre 5.5 a 6.5 y con pendiente de 2% de caída. Los suelos abonados tienen a producir plantas más pesadas y cuellos gruesos haciendo más dificultoso el cuidado. Bajo condiciones de irrigación en suelo medianamente pesado, limo arenoso.
3.8.3 Desórdenes patológicos:
a. Pudrición del cuello: La pudrición acuosa se inicia en la zona del
grisáceo del hongo es generalmente visible en la zona del cuello y en las escamas externas, causado por el hongo Botrytis sp.
b. Moho negro: Coloración negra y deshidratación en el cuello y escamas externas son causadas por el hongo Aspergillus niger. Usualmente está asociado con magulladuras y pudriciones bacterianas blandas.
c. Moho azul: Pudrición acuosa en el cuello y escamas externas, (ocasionalmente amarillo-verdoso) es causado por el hongo
Penicillium sp Se debe minimizar las magulladuras y otros daños mecánicos.
3.8.4 Trabajos realizados en el cultivo.
VARGAS (1996), en el trabajo de investigación sobre evaluación de cuatro densidades de siembra de Cebolla China menciona que la densidad de la planta esta definido como el número óptimo de plantas por ha (10x20= 500,000 plantas/ha), lo cual no existe ningún tipo de competencia entre ellas ya sea por luz, agua y suelo. La producción por ha equivale al producto del rendimiento medio por planta y el numero de plantas existentes en una ha. Estos dos factores se influyen mutuamente y la densidad óptima es la que proporciona el máximo beneficio económico.
aplicaciones de Fentinacetato a la dosis de 1g/l a la densidad de 15 x 20 obtuvo un rendimiento de 14 937.50 Kg/ha; ARMAS (2009), con aplicaciones de potasio al suelo y su efecto en el volumen y frecuencia de riego , obtuvo 25 326,7 Kg/ha.
3.8.5 VALOR NUTRICIONAL
CASAS (2006), Señala que la cebolla china en la selva alta se puede sembrar todo el año. También nos alcanza su valor nutricional que es como sigue.
Agua : 88.7%
Energía calórico : 39 Kcal
Proteína : 2.3 g
Grasa : 0.4 g
Carbohidratos : 7.5 g
Ca + Mg : 141,00 mg
Vit B1 : 0.02 mg
3.9 COMERCIALIZACIÓN
ANÓNIMO (2009) indica que la cebolla china, igualmente que otras
3.10 LOS MICROORGANISMOS BENEFICIOSOS Y EFICACES PARA UNA
AGRICULTURA SOSTENIBLE HACIA LA AGRICULTURA SIN
PRODUCTOS QUÍMICOS Y CON UN ÓPTIMO RENDIMIENTO.
RAAA (2008), indica que, los medios de control de los microorganismos beneficiosos del suelo como componente importante del medio ambiente agrario; además sustentan que los defensores de la naturaleza, agricultura convencional y agricultura orgánica porque argumentan que los microorganismos beneficiosos del suelo aumentarán naturalmente. Sin embargo, en la mayoría de los casos, los microorganismos del suelo, beneficiosos o perjudiciales, a menudo han sido controlados en diversas zonas agroecológicas donde se cultivan en la secuencia correcta (es decir, las rotaciones de los cultivos) y sin el uso de plaguicidas.
Esto explicaría por qué han sido durante mucho tiempo los científicos interesados en la utilización de microorganismos beneficiosos del suelo y la planta de inoculantes para cambiar el equilibrio microbiológico de forma tal que aumente la calidad del suelo y el rendimiento y la calidad de los cultivos.
V. MATERIALES Y METODOLOGÍA
4.1 MATERIALES
4.1.1 UBICACIÓN DEL ÁREA EXPERIMENTAL
El trabajo de investigación se realizó en el “Fundo Miraflores”, campo experimental propiedad de la UNSM – T; que esta ubicado en el trayecto de la carretera Bello Horizonte sector Ahuashiyacu del distrito de la Banda de Shilcayo, a 3, 5 Km de la ciudad de Tarapoto.
UBICACIÓN POLÍTICA
Sector : Ahuashiyacu - Fundo Miraflores (UNSM-T) Distrito : Banda de Shilcayo
Provincia : San Martín Departamento : San Martín
UBICACIÓN GEOGRÁFICA
4.1.2 HISTORIA DE CAMPO EXPERIMENTAL
El Fundo Miraflores cuenta con 22, 25 hectáreas, aproximadamente el 60% del área es pendiente y el resto es plana, la cobertura vegetal del área esta compuesta de pasturas con especies de Braquiaria común (Brachiaria decumbens), Andropogon gayanas, Brachiaria Brizantha y pasto natural cashucsha (Imperata sp), además de especies arbóreas como otras malezas.
El año 1995 (Marzo), fue transferido por, OFECOD (Ministerio del Interior), a la UNSM – Tarapoto.
El predio estaba dedicado anteriormente a la producción de cultivos tales como frijoles y yuca; entre otros, en esta oportunidad solo será utilizada para la siembra de hortalizas (cebolla china) en estudio.
4.1.3 VÍAS DE ACCESO
4.1.4 CARACTERÍSTICAS CLIMÁTICAS.
De acuerdo a la clasificación de Holdridge (1984), el campo experimental presenta una zona de vida bosque seco tropical (Bs-T), con una precipitación promedio de 1147, 8 mm y una temperatura que varía entre los 28 y 34 °C, con temperatura media anual de 26, 28 ºC. , la humedad relativa de 78,5%, los vientos van en dirección norte y alcanzan velocidades anuales de 4,9 km /h
Según SENAMHI 2001, la zona tiene las siguientes características climáticas
CUADRO: 3 Características climáticas del campo.
Bosque Seco Tropical (Bs-T)
Suelo Ultisol.
Tº media anual 26º C. Pp media anual 1147.8mm. Época de máxima PP. Febrero a Mayo.
Época de mínima PP. Junio a Septiembre.
4.2 METODOLOGÍA
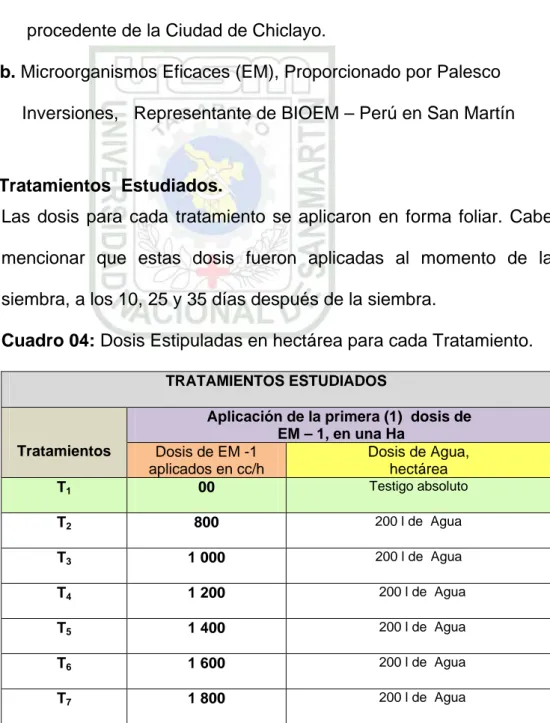
4.2.2 Tratamientos Estudiados.
Las dosis para cada tratamiento se aplicaron en forma foliar. Cabe mencionar que estas dosis fueron aplicadas al momento de la siembra, a los 10, 25 y 35 días después de la siembra.
Cuadro 04: Dosis Estipuladas en hectárea para cada Tratamiento. TRATAMIENTOS ESTUDIADOS
Tratamientos
Aplicación de la primera (1) dosis de EM – 1, en una Ha
Nota: Se hicieron Cuatro aplicaciones de EM – 1 en fechas distintas.
Como se puede notar en el Cuadro 04, el T1 testigo absoluto no se
aplico ninguna dosis de EM – 1, mientras que en los tratamientos restante se aplicaron dosis distintas, así en la primera aplicación después de la siembra T2 se aplico 800cc/h por 200 litros de agua,
para el T2, así en sucesivamente se aplico las dosis establecidas
para cada tratamiento restantes.
4.2.3 Diseño Experimental.
En el presente trabajo de investigación se aplicó el Diseño de Bloques Completamente al Azar (DBCA) con siete (07) tratamientos y tres (03) repeticiones, de las cuales seis (06) tratamientos fueron aplicados diferentes dosis de Microorganismos Eficaces (EM) y un (01) tratamiento testigo, manteniendo la misma densidad de siembra en todos los tratamiento, empleando en total 21 unidades experimentales, en el cultivo de cebolla china.
Cuadro 05: Tratamiento en el campo experimental
Cuadro 06. Esquema del ANVA del diseño experimental
Fuentes de variabilidad GL
BLOQUES (r – 1) = 2
TTOS (t – 1) = 6 ERROR (r – 1) (t – 1) = 12
4.2.4 Características Del Campo Experimental.
Área.
• Largo : 26,0m
• Ancho : 10,0 m
• Área total : 260 m2
• Nº de bloques : 3
• Nº de unidades experimental : 21,0
Bloques experimentales
• Largo : 26,0 m
• Ancho : 2,0 m
• Área total de un bloque : 52,0 m2
• Número de parcelas por bloque : 7 • Separación entre bloques : 1,0 m
• Separación entre parcelas : 0,5m
Unidades experimentales o parcela.
• Largo : 3,0 m
• Ancho : 2,0m
4.3 CONDUCCIÓN DEL EXPERIMENTO.
A. Fase de Campo.
a. Instalación del experimento. (20/05/09)
Está labor se inició con la limpieza del terreno, eliminación de malezas y/o desyerbado del área.
b. Datos meteorológicos
En el Cuadro 07, se muestra la información meteorológica ocurrida desde el momento de la siembra del cultivo de Cebolla china en campo, hasta el término del mismo (cosecha).
c. Muestreo y análisis de suelo. (01/06/09), (02/09/09).
El muestreo se efectuó antes de la siembra a campo definitivo y después de la cosecha, se tomaron submuestras a una profundidad de 20 cm, haciendo un recorrido en zig – zag por el campo experimental, se homogenizaron entre si para formar una muestra
representativa de 1Kg de peso. La misma que fue llevada al Laboratorio de Suelos del Instituto de Cultivos Tropicales (ICT – T) y al Laboratorio de suelos de UNSM – T, para el análisis físico – químico respectivo. Como se muestra en las Foto 3 y 4
Resultado del análisis físico – químico del suelo.
• pH : Potenciómetro, relación 1:2.5
• Textura : Hidrometro
• C.E : Conductimetro, relación 1:2.5
• Carbonatos : Vaso – Volulumetrico
• Fosforo : Olsen Modificado Extract. NaHCO = 0.5M, pH 8,5
• Potasio : Absorción Atómica Extract. NaHCO = 0.5M, pH 8,5
• M. O. : Walkley Black.
• Ca y Mg. : Absorción Atomica. Extract. KCl 0.1N
• Aluminio : Extract. KCl 1N
Como se puede observar en los análisis se suelos respectivos realizados antes y después de la siembra, existe una diferencia significativa, notándose un incremento en la Materia orgánica.
d. Preparación del terreno e incorporación de gallinaza.
(27/05/09)
Antes de la siembra Incorporamos gallinaza descompuesta (Como fuente de microorganismos) al suelo a una cantidad de 500 g/m2, haciendo un total de 5 t/h, con la finalidad de activar los Microorganismos Eficaces (EM - Compost) que se encuentran en estado de latencia.
Para la respectiva preparación del terreno hicimos 03 aplicaciones de EM-Compost cada 10 días, con una mochila pulverizadora de 20 litros, con una primera aplicación de 1 400 cc de EM – Compost por hectárea por 200 litros de agua, previo riego del terreno.
La aplicación de EM – Compost (Microorganismos Eficaces), en el momento de la preparación del terreno, tiene como objetivo establecer en el suelo los microorganismos benéficos presentes en EM - Compost para promover el desarrollo vigoroso de los cultivos. De igual manera, se busca trasformar la materia orgánica, dentro del terreno, favoreciendo el reciclaje de nutrientes y la mejora de las características físicas, químicas y microbiológicas del suelo.
e. Parcelado del terreno. (07/07/09)
Una vez removido el suelo se procedió a la delimitación de las parcelas de acuerdo al diseño experimental, delimitando los bloques, parcelas y calles, para esta labor se utilizó estacas, wincha y cordel.
f. Tratamiento de semilla.
Se realizó una aplicación de EM - Compost momentos antes de la siembra, la cual consiste en: selección de la semilla eliminando los bulbos que estaban enfermos, o con algunos signos de malformación, para luego sumergirlas en un recipiente a una dosis de 5cc/l de agua del producto EM - Compost hasta cubrir por completo el recipiente, durante 10 minutos.
Esto tiene como objetivo generar una barrera protectora con microorganismos benéficos alrededor del bulbo para que al momento de entrar en contacto con el suelo, reduzca la incidencia de enfermedades alojadas en el medio (principalmente enfermedades y otros patógenos que se encuentran presentes en el suelo), por otra parte se buscar promover la germinación, brotación
Foto. 12: Trazado del terreno ,distanciamiento entre Hilera de 15 cm
vigorosa y uniforme de los bulbos sembrados por la generación de hormonas, aminoácidos y sustancias antioxidantes.
g. Siembra. (08/07/09).
La siembra se realizó a los 42 días después de la preparación del terreno, previo riego, está operación se realizó en forma manual, colocando un (01) bulbo por golpe a un distanciamiento de 7cm entre plantas y 15 cm entre hileras.
Foto. 9: Aplicación del Producto EM - Compost
Foto. 11: Selección y Desinfección de los Bulbos.
Foto. 10: Dosificación del Producto EM - Comp.
Foto. 13: Bulbos desinfectados con EM - Compost. Listo para la siembra.
Foto. 18: Primera Foto. 17: EM-1 , en la pulverizadora
de 20 l.
Foto. 16: Dosificación de EM - 1
h. Aplicaciones de EM- 1 a cada tratamiento vía foliar.
Se aplicó Microorganismos Eficaces (EM – 1) vía foliar, con una mochila aspersor de 20 litros, de acuerdo a las dosis dadas a cada tratamiento.
Se aplicaron en 04 etapas, al momento de la siembra, a 10, 25 y 35 días después de la siembra.
08/07/09 17/07/09 01/08/09 11/08/09
B. Fase de Laboratorio.
a. Preparación del Medio de Cultivo PDA (Papa - Dextrosa - Agar).
Se preparó colocando en un recipiente 200 g de papa picada sin pelar, puestas es un recipiente con 500 ml de agua y colocarlos al horno microondas por 20 min. En otro recipiente se colocó 20 g de Agar Agar añadiéndose también 500 ml de agua y puesto en el microondas por 10 min.
Se filtró el caldo de papa con un tamiz en el recipiente con el Agar fundido, añadiendo luego 20 g de glucosa (dextrosa) mezclándolo y se aumentó con agua hasta 1000 ml distribuyendo 100 ml/botella para ser esterilizados en el Autoclave a 121°C (15 lb de presión) por 20 min.
Foto. 25: Colocando al
horno por 20min. Foto. 26: Pesamos 20 g de AGAR AGAR Foto. 22: Lavado
Producto (Papa)
Foto.23: Pesado de 200gr del Producto
Foto. 24: Picado del Producto
Foto. 27: Filtrado del Caldo de Papa
Foto. 28: Llenado del
b. Llenado de las Placas Petri con Medio de Cultivo (PDA).
Se procedió seguidamente al Plaqueado del medio PDA en placas Petri (en la cámara de flujo laminar), las placas fueron previamente esterilizados, para así evitar contaminaciones posterior, este trabajo se hizo manteniendo una asepsia adecuada,
Se Plaquearón 10 muestras para cada análisis de las cuales 05 de ellas fueron con antibiótico (Amoxicilina) que fueron previamente incorporado al medio PDA para observar la sensibilidad de una determinada bacteria al antibiótico y 05 fueron Sin Antibiótico (S.A.).
c. Recolección de muestras Microbiológicas de Suelo y Aire.
Las muestras fueron recolectadas en campo, que posteriormente fueron llevadas al Laboratorio de Fitopatología de la UNSM- T para ser analizadas e interpretados así saber que microorganismos patógenos se encuentra, identificarlo y cuantificarlo.
1. Muestra de Medio Ambiente.
Se procedió a llevar las placas petri con medio de cultivo (PDA), una vez llegado al lugar asignado abrimos la placa por 10 Foto. 30: Cámara de Flujo
Laminar
Foto. 31: Plaqueado con el Medio PDA
minutos en diferentes lugares del campo experimental para tomar diferentes Muestras de Medio ambiente del lugar.
Las muestras recolectadas fueron llevadas al laboratorio, con sumo cuidado y dejamos incubar a temperatura ambiente por 24 horas, para realizar el recuento de microorganismos.
El análisis microbiológico del aire fue llevado a cabo en un medio de cultivo general (PDA); en el que pueden crecer muchos microorganismos. Con el fin de identificar mesófilos aerobios.
La atmósfera no tiene una microbiota autóctona pero es un medio para la dispersión de muchos tipos de microorganismos (esporas, bacterias, virus y hongos), procedentes de otros ambientes. Los microorganismos dispersados por el aire tienen una gran importancia biológica y económica.
Producen enfermedades en plantas, animales y humanos, causan alteración de alimentos y materiales orgánicos
Foto. 33: Recolección de Muestras de Medio Amb.
2. Muestra de Suelo.
Con las muestras tomadas se hizo la disolución y siembra respectiva de la muestra de suelo en 10 placas con el medio PDA, de las cuales 05 de fueron con antibiótico (C.A) y 05 sin antibiótico (S.A)
+ Dilusiones.
En 10 g de suelo agregar 100 de agua destilada.
Extraer de la solución 1 ml y agregar 9 ml de agua
en un tubo de ensayo.
Y así repetir el procedimiento 2 veces mas.
+ Siembra.
De los 2 últimos tubos de ensayo sacar 0.1ml de cada uno
de ellos y poner en 10 diferentes placas petris.
Finalmente esparcirlo con un hisopo.
Placas con PDA y la muestra lo dejamos a temperatura
ambiente por 24 horas, para el conteo respectivo.
Incubamos por 5 días para la identificación del patógeno. Foto. 35: Sacamos con la Pipeta
0.1 ml de muestra
d. Observación de Colonias de Hongos y Bacterias.
Se realizó la observación, de colonias tanto hongos y bacterias haciendo un cuadrante en las placas para posteriormente contar cuantas colonias existen de hongos y bacterias, el color, la forma y el aspecto de las colonias.Con la visualización directa de la colonia en la placa se hizo para determinar el color, la forma, y tamaño que presenta.
e. Identificación de Microorganismos.
Con las muestras ya incubadas se realizó la identificación de hongos, esto se hizo en dos etapas antes de la siembra y después de la cosecha con la finalidad de evaluar el efecto de Microorganismos Eficaces (EM) en el suelo y medio ambiente.
Se realizó la observación a través de un microscopio compuesto (objetivo 40x / ocular 10x) para determinar la forma y color del hongo para su posterior identificación.
Foto 37: Observación y Conteo de Hongos Y Bact. (C.A)
Foto. 42: Observación de Patogenos Foto. 39: Placa de colonias de hongos
Foto. 40: Repique del Hongo
Foto. 41: Diseminación de Colonia de Hongo
4.4 LABORES CULTURALES.
a. Riego.
El riego se realizó de manera continua con baldes de 4 l , aplicando de manera homogénea a todos los tratamientos un total de 16 l de agua diario, el primer riego se aplico después de la siembra a campo definitivo para evitar el estrés hídrico que pudieran sufrir las futuras plantas, luego se suministraron agua de riego diario.
b. Control de Malezas.
Consistió en la eliminación manual de malezas presentes en el cultivo, el primer deshierbo se hizo a los 15 días y el segundo a los 30 días de la siembra, entre la población de malezas que se erradicó en su mayoría eran exclusivamente Portulaca oleracea, Eleusine indica, Ipomoea sp.
+ Primer Control : 22/07/09 + Segundo Control : 08/08/09
Foto. 45: Riego Continuo al cultivo. Foto. 46: Riego homogéneo de 16 l/Tto
Fig. 47: El deshiervo se dio de forma manual.
c. Cosecha. (25/08/09)
La cosecha de la Cebolla China se hizo cuando el cultivo se encontraba en su madurez fisiológica. Las plantas cosechadas de cada unidad experimental fueron limpiadas y se eliminaron las hojas secas, para luego pesarlas en una balanza en kilogramos, obteniendo el rendimiento por parcela, posteriormente se le transformó a hectárea.
Foto. 50: Cosecha manual del Cultivo Foto. 51: Ccosecha
Foto. 53: Cebolla China CON Aplicación de EM - 1
Foto. 52: Resultado final de la Cosecha
4.5 PARÁMETROS EVALUADOS.
a. Porcentaje Emergencia de hojas Aciculares.
Se realizó el conteo del número de plantas que emergieron expresando el valor en porcentaje, alcanzando un (96.8%) de cada unidad experimental, a los 8 días después de la siembra, esta actividad se realizó, el 16 de Julio del 2009.
b. Altura promedio de planta
Se evaluó utilizando una wincha metálica de 3 m, midiendo desde la base de la planta hasta el ápice de la misma, registrándose los datos de 10 plantas al azar por unidad experimental. La evaluación se realizó a la primera semana y posterior a la cosecha.
+ Primera Evaluación : 15/07/09 + Segunda Evaluación : 24/08/09
Foto. 55: Primera evaluación “Porcentaje de Emergencia”
Foto. 57: Apuntes de la Medición de Altura de Plata.
c. Peso de producto comercial, Cebolla china.
Se procedió a pesar una planta al azar por tratamiento que fueron debidamente limpiadas para pesarlo respectiva, para saber cuanto es el peso promedio de cada planta y saber cual es el efecto que causo el microorganismos eficaces (EM ),en el cultivo.
d. Número de bulbos promedio por planta
Se contaron el número de bulbos que hay por cada planta sembrada y se observó la diferencia que hay en los tratamientos evaluados.
e. Diámetro promedio de bulbos
Se sacaron el diámetro cortando a los bulbos en forma vertical y horizontal y se obtener dos mediadas y promediarlos para tener uno solo.
Foto. 58: Conteo del Numero de Bulbos por Plata
Foto. 59: Cepas del Cultivo encontradas con 16 y 14 Bulbos respectivamente.
Foto. 64: Conteo de Hojas por planta.
f. Diámetro promedio de Hojas
Se saco el diámetro cortando las hojas en forma horizontal para así obtener las mediadas y posteriormente se promediaron para ver las diferencias con los tratamientos estudiados.
g. Numero de Hojas por Planta
Se contaron el número de hojas que hay por cada planta (bulbo) sembrada y se observara la diferencia que hay en los 6 tratamientos evaluados.
h. Coloración de Hoja a la Cosecha.
Se evaluó el color de la hoja a la cosecha, para poder determinar la calidad del producto.
+ La barra 03 nos muestra la Calidad del producto, un verde claro, no muy requerida por el publico consumidor.
+ La barra 02 nos muestra un verde opaco, donde puede ser considerado bueno para el consumidor.
+ La barra 01 es Considerada la Selecta, nos muestra un color verde oscuro, tiene mayor valor comercial por su consistencia y calidad.
i. Rendimiento Kg/ha
Una vez culminada toda la cosecha de las parcelas experimentales por tratamiento se procedió a calcular el rendimiento de cada parcela en Kg y luego se procedió a llevar a datos estimados por hectárea.
Peso en campo (Kg) X 10 000 m2 X 1 t Área de cosecha (m2) 1 h 1 000 Kg
Donde:
+ R : Rendimiento en t/h
+ Peso de campo : Peso de gramos obtenidos de cada
Sub -Parcela experimental expresado
en Kg
+ Área de cosecha : Espacio delimitado para la cosecha,
Expresados en m2.
j. Análisis Costo-Beneficio (C/B) de cada tratamiento
Para el cálculo de la relación costo/beneficio de cada tratamiento, se utilizó las siguientes fórmulas:
Ingreso Bruto = Rendimiento Kg x Precio de venta S/. / Kg.
Ingreso Neto (unidad) = Ingreso bruto – Costo de producción
Relación C/B = Costo de producción
--- Ingreso Bruto
Relación B/C = Ingreso Neto (unidad)
VI. RESULTADOS.
5.1 FASE DE CAMPO.
a. PORCENTAJE DE EMERGENCIA DE HOJAS CEBOLLA CHINA.
Cuadro 10: Análisis de Varianza (ANVA), para porcentaje de Emergencia de Cebolla China.
N.S: No Significativo
R2 = 59 % C.V = 0,66% CME = 0,64 = 97,28 %
b. ALTURA DE PLANTA.
Cuadro 11: Análisis de Varianza (ANVA), para altura en cm de Cebolla China.
**
Altamente SignificativoR2 = 80 % C.V = 6,76 % CME = 2,51 = 37,23 cm
.
c. PESO DE PRODUCTO COMERCIAL CEBOLLA CHINA (g /Cepa.)
Cuadro 12: Análisis de Varianza (ANVA), para el peso del producto comercial de Cebolla China en g /Cepa.
* *
Altamente significativo
R2= 90 % C.V = 7,31 % CME = 6,85 = 93,77 g
Grafico 4: Prueba de Duncan para el peso del producto comercial de Cebolla China en g /cepa.
d. NÚMERO DE BULBOS PROMEDIO POR PLANTA.
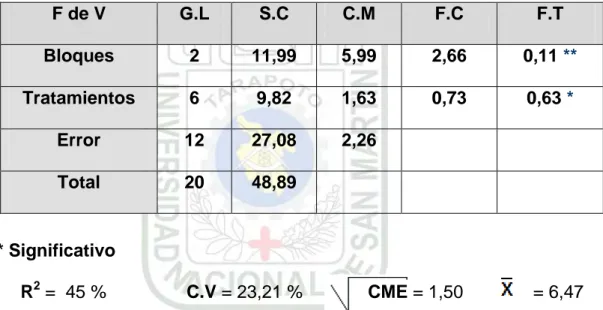
Cuadro 13: Análisis de Varianza (ANVA), para el número de bulbos promedio por planta
* Significativo
R2= 45 % C.V = 23,21 % CME = 1,50 = 6,47
e. DIÁMETRO DE BULBOS (cm)
Cuadro 14: Análisis de Varianza (ANVA), para el diámetro de bulbos por planta (cm.)
* Significativo
R2= 59 % C.V = 10,09% CME = 0,19 = 1,92 cm
f. DIÁMETRO DE HOJAS (cm.)
Cuadro 15: Análisis de Varianza (ANVA), para el diámetro de hojas (cm)
** Altamente significativo
R2= 71 % C.V = 8,52% CME = 0,16 X = 1,87cm
g. RENDIMIENTO DE LA CEBOLLA CHINA (Kg /h).
Cuadro 16: Análisis de Varianza (ANVA), para el rendimiento de la Cebolla China (Kg /ha).
** Altamente significativo
R2 = 98 % C.V = 2,69% CME = 882,84 = 32732,91 Kg
Grafico 8: Prueba de Duncan para el rendimiento de la Cebolla China (Kg/ha).
F de V G.L S.C C.M F.C F.T
Bloques 2 114440119,93 57220059,96 73,41 0,0001
**
Tratamientos 6 457311701 76218616,94 97,79 0,0001
**
Error 12 9352939,71 779411,64
h. ANÁLISIS ECONÓMICO DE LOS FACTORES ESTUDIADOS.
Cuadro 17: Análisis Económico.
Tra
El respectivo análisis económico del Cuadro 17, muestra cada uno de los factores estudiados en cuanto al rendimiento/precio, estos fueron realizados de conformidad con el precio que rigió el mercado hasta ese momento que fue de S/. 1.50 Kg (Nuevos soles), de cebolla china vendidos en el mercado de Tarapoto – Perú el 26 y 27 de agosto del año 2009.
5.2 FASE DE LABORATORIO.
Para la identificación de hongos fitopatógenos es necesario la observación de sus estructuras. Mediante la técnica de cámara húmeda y/o aislamiento. La observación de las características de las estructuras producidas y el uso de claves taxonómicas son necesarios para determinar el género y la especie del hongo patógeno
A. Monitoreo de hongos contenidos en el aire.
Se muestran a continuación las poblaciones de hongos identificados, antes evaluados de aplicación de EM y al finalizar el proyecto con aplicación de diferentes dosis de EM.
Cuadro 18: Resultados evaluados de Análisis durante el proceso del desarrollo del trabajo de Investigación
Hongos en el Medio Ambiente (Aire)
GÉNEROS GÉNEROS
Aspergillus sp Aspergillius sp
Fusarium sp Fusarium sp
Mucor sp. Mucor sp.
Penicillium Rhizopus sp. Rhizopus sp. Penicillum
- Trichoderma sp.
- -
- -
- -
B. Monitoreo de hongos en el Suelo.
- Identificación de Hongos del Suelo
Se muestran a continuación las poblaciones de hongos identificados en el análisis microbiológico de Suelo, antes de la aplicación de EM y al finalizar el proyecto con aplicación de diferentes dosis de EM.
Cuadro 19: Población de Hongos en el suelo después de la aplicación
Cercospora sp Colletotrichum sp
Colletotrichum sp Fusarium sp
Curvularia sp Penicillum
Fusarium sp Trichoderma sp
Phytophthora sp Phytophthora sp
Rhizoctonia sp Rhizoctonia sp
Sclerotium sp -
Stemphylium sp -
VII. DISCUSIÓN.
6.1 FASE DE CAMPO.
A. PORCENTAJE DE EMERGENCIA DE HOJAS CEBOLLA CHINA.
En el Cuadro 10, se muestra los promedios, de porcentaje de emergencia de hojas, evaluados en la germinación de los diferentes bloques y tratamientos, con un promedio general que esta dentro de un rango de 7 a 8 días entre tratamiento habiendo una emergencia del 97.2 %, al someter al Análisis de Varianza (ANVA), nos dio como resultado No Significativo (N.S) entre los tratamientos y bloques, que manifiesta que las condiciones de humedad, temperatura, Aplicación de EM – Compost al suelo y la desinfección de la semilla, fueron optimas corroborando con la afirmación de la Prueba Múltiple de Duncan, al no haber diferencia significativa alguna.
Esto en parte corrobora lo mencionado por muchos investigadores, mencionando que las hortalizas requieren una adecuada preparación de suelo, y que este perfectamente nivelado, además de que el éxito germinativo depende de la calidad de la semilla.
B. ALTURA DE PLANTA.
foliar a las plantas, permitiendo el transporte de nutrientes hacia la zona de crecimiento y desarrollo de la planta.
En el gráfico 3, nos muestra la prueba de Duncan para la altura de plantas, indicando que las diferencia estadísticas se debe a la mejor distribución de la dosis de EM, en forma foliar a las plantas, esta a su ves brinda los elementos necesarios para el desarrollo constante, permitiendo el transporte hacia las hojas para que realice la fotosíntesis y como consecuencia se acumule mayor cantidad de fotosintatos, que permiten la respiración normal, como causa efecto se acumula mayor energía en beneficio de las funciones vitales del crecimiento y desarrollo de la planta.
Como se observa en la prueba de Duncan, el tratamiento con 06 cm/l de agua de EM (T4) tubo mayor altura que los demás tratamientos
estudiados con un promedio de 41.05 cm, en comparación del tratamiento testigo sin ninguna aplicación (T1) la cual solo alcanzo una
altura promedio de 32.29 cm.
C. PESO DE PRODUCTO COMERCIAL CEBOLLA CHINA (g /Cepa.)
En el cuadro 12, nos muestra el análisis de varianza (ANVA), para el peso del producto comercial por unidad de planta, mostrando que existe una diferencia Altamente significativa (**) en peso por g/Unid. de planta entre los tratamientos experimentados; existiendo precisión en cuanto al C.V de 7.31% y un R2 de 90%, este resultado se dio por el efecto de las dosis de aplicación de Microorganismos Eficaces (EM – 1) en los tratamientos en forma foliar a las plantas, como también hubo influencia la aplicación de gallinaza para la activación de EM – Compost, permitiendo que los microorganismos ionicen a los nutrientes y pueda ser percolado hacia la zona de crecimiento y desarrollo de la planta, el tamaño y grosor de los bulbos influenciaron también en el peso respectivo.
En el gráfico 4 nos muestra la prueba de Duncan para en del producto comercial g/Cepa de planta, indicando que las diferencia estadísticas altamente significativa entre tratamientos, esto se debe a la mejor dosis de EM-1, en forma foliar a las plantas, la aplicación de gallinaza para la activación del EM – Compost brindo los elementos necesarios para el desarrollo constante, permitiendo el transporte hacia las hojas para que realice la fotosíntesis y desarrolle maslos bulbos como consecuencia se desarrollo mas de las plantas, como causa efecto se acumula mayor energía en beneficio de las funciones vitales del crecimiento y desarrollo.
Como se observa en la prueba Duncan, el tratamiento con 4 800 cc/h de EM – 1 por 800 litros de agua (T4) obtuvo mayor peso por cepa de planta
en comparación del tratamiento testigo sin ninguna aplicación (T1) la cual
solo alcanzo una peso promedio de 69 g/cepa.
D. NÚMERO DE BULBOS PROMEDIO POR PLANTA.
En el Cuadro 13, nos muestra en el análisis de Varianza (ANVA), para el número de bulbos por planta cosechada, encontrándose que existe una diferencia estadística Significativa (*) entre los tratamientos evaluados siendo un C.V de 23,21%, precisando la evaluación realizada con un R2 de 45%, no encontrándose dentro del rango de confiabilidad por diferentes efectos o causas de las elección al azar del número de bulbos por planta para el conteo respectivo.
El gráfico 5, nos muestra la prueba de Duncan en el cual corrobora que entre los promedios de tratamientos evaluados existe una diferencia Significancia, entre ellos, el T3 con 7.39 bulbos por planta ocupó el primer
lugar, superando a los demás tratamientos, así como el que menos bulbos por planta presento fue el tratamiento testigo (T1), que solo
alcanzo un promedio de 5.44 bulbos por planta; cabe mencionar que la prueba realizada para la evaluación de resultados de bulbos por planta no fue la mas indica porque no nos presenta un rango de confiabilidad exacta.
E. DIÁMETRO DE BULBOS (cm)
En el Cuadro 14, nos muestra el análisis de Varianza (ANVA), para el diámetro de bulbos, encontrándose que existe una diferencia estadística Significancia (*) entre los tratamientos evaluados siendo un C.V de 10.99% precisando la evaluación realizada con un R2 de 59%, no estando dentro del rango de confiabilidad por diferentes efectos o causas en la elección al azar del numero de planta para el conteo respectivo.
El gráfico 6, nos muestra la prueba de Duncan en el cual corrobora que entre los promedios de tratamientos evaluados existe una diferencia Significancia (*), entre ellos, el T6 con 2,12 cm. de diámetro ocupo el primer
lugar, pero no superando por una alta diferencia al tratamiento T4 que
alcanzo un promedio de 2.08 cm. de diámetro de bulbo por planta, pero superando a los demás tratamientos, el que menor diámetro obtuvo por plata fue el tratamiento T2 con una aplicación de 3 200 cc/h de EM – 1 por
800 litros de agua , que solo alcanzo un promedio de 1,66 cm de diámetro por bulbos planta.
F. DIÁMETRO DE HOJAS (cm.)
En el Cuadro 15, nos muestra el análisis de Varianza (ANVA), para el diámetro de hojas, existe una diferencia Altamente Significante (**), entre los tratamientos evaluados con un C.V de 8.52% de precisión en la toma de datos, con un grado de confiabilidad de R2 de 71%, que nos indica que se debe al efecto de las diferentes dosis aplicada a cada tratamiento.
La prueba de Duncan (gráfico 7) corrobora que entre los promedios de tratamientos evaluados existe una diferencia altamente significativa entre ellos, el T5 con 2.01 cm de diámetro ocupo el primer lugar, pero no
superando por una alta diferencia al tratamiento T4 que alcanzo un
promedio de 2 cm. de diámetro de hoja por planta, pero superando a los demás tratamientos, el que menor diámetro obtuvo por plata fue el tratamiento T1 (Tratamiento testigo), que solo alcanzo un promedio de 1,54
cm de diámetro por hoja planta.
G. RENDIMIENTO DE LA CEBOLLA CHINA (Kg /ha).
El cuadro 16, nos muestra en el Análisis de Varianza (ANVA), que
determino la variable en cuanto al rendimiento de cebolla china en Kg. /h, resultando ser Altamente Significativo (**) estadísticamente, evidenciado que existe diferencia entre los tratamientos evaluados. Siendo corroborado con la precisión respecto a la evaluación y toma de datos realizados en el presente estudio con un C.V de 2,69% que esta dentro del rango aceptable, con un grado de confiabilidad R2 de 98%, que nos indica que la evaluación estadística realizada y el diseño empleado son los adecuados.
En el gráfico 8; muestra la prueba de Duncan para el rendimiento total del cultivo, indicando que el T4 (4 800cc/h de EM -1 POR 800 litros de agua) es
el tratamiento que ha obtenido el mas alto rendimiento con un promedio de 38 381.6 Kg/h, con respecto a los demás tratamientos evaluados, T3, T5, T7,
T6 y T2, con un promedios de 36 418.3, 34 878.8, 33 677.2, 33 671.1 y 28
441.1 Kg/ha, respectivamente, siendo el T1 (Tratamiento testigo – sin
aplicación de EM), quien resulto con menor rendimiento (23 667.2 Kg/h) comparativamente a los demás tratamientos experimentales, cabe indicar que hubo un mayor crecimiento y desarrollo de las plantas por el efecto de la aplicación de diferentes dosis de Microorganismos Eficaces (EM), permitieron obtener mayor nutrientes porque sus funciones fisiológicas, transporte, fotosíntesis, respiración y transpiración permitieron un desarrollo adecuado para un rendimiento esperado.
mejor respuesta en cuanto al rendimiento promedio con una dosis de 06g.gel/m2 + riego cada dos días obtuvo un rendimiento de 28,68 Tm/ha;
VALDEZ (1999) en el Km 14 a Yurimaguas menciona que con una
densidad de 15x10 obtuvo un rendimiento promedio de 16 411kg/h;
GRANDA (2001), menciona que, en Lamas con aplicación de gel
hidrosolvente y con problemas de Alternaria sp. reporta un rendimiento de 16 483.3 kg/ha,el cual nos indica que con la aplicación de Microorganismos Eficaces (EM), obtuvo mayor resultado en el rendimiento del cultivo con diferentes dosis aplicadas en cualquier de los tratamientos y sin ninguna otra aplicación de productos.
H. ANÁLISIS ECONÓMICO DE LOS FACTORES ESTUDIADOS.
En el Cuadro 17, se muestra el análisis económico de los tratamientos evaluados en el presente experimento, donde se aprecia el costo total de producción para los tratamientos evaluados, esto fue construido sobre la base del costo de producción, rendimiento y precio actual en el mercado local, así también cabe mencionar que el tratamiento (T1 - Testigo) fue
vendido en el mercado local a un precio inferior al de los demás tratamientos debido a la calidad del producto.
obtuvo un C/B = 6,32 en comparación con los demás tratamientos, el que obtuvo un resultado semejante fue T3 con un C/B = 6,03; y el T1
-Testigo, es el que obtuvo menor C/B= 2,86, debido a que se vendido a un precio menor por la calidad y consistencia del producto.
El costo de producción de la Cebolla China se incremento en función a las diferentes dosis de aplicaciones de EM; en el T4 se aplico4 800 cc/h de EM
– 1 por 800 litros de agua, el costo de producción fue de S/.9 096,7, obteniendo una utilidad de 19 190.8; mientras que le testigo absoluto con un costo de producción de S/. 8 252,5 8, obteniendo una utilidad de S/. , 15 414,7 mas baja en referencia a los demás tratamientos, los costos de producción se vieron incrementando por la dosis de aplicación de EM. El precio de cebolla china es impuesto por el comerciante local.
6.2 FASE DE LABORATORIO.
A. Monitoreo microbiológico de los Análisis Realizados.
Los hongos constituyen un grupo muy heterogéneo de organismos eucariotas, unicelulares, heterótrofos no fotosintéticos, con pared celular. Basándose en la apariencia macroscópica de la colonia se pueden diferenciar dos tipos de hongos. Si producen colonias opacas, cremosas o pastosas se denominan levaduras; si producen crecimientos aéreos, velludos, algodonosos o pulverulentos se llaman hongos filamentosos.
En el cuadro Nº 18 se muestra los hongos identificados antes y después de la aplicación de EM , se puede apreciar que al inicio de la investigación antes de la aplicación de las dosis de EM una mayor cantidad de hongos identificados así como ( Asperllilium sp, Fusarium sp, Mucor sp, Penicillium sp, Rhizopus sp,) existió una mayor cantidad de hongos en el aire, esto probablemente se haya debido a factores externos del medio ambiente.
A medida que el proceso fue avanzando, el comportamiento de los hongos fue variando como consecuencia de la actividad de los mismos en función a la aplicación del EM, pues la actividad de los hongos fue disminuyendo a medida que aplicamos las el EM, asi que identificamos los hongos al finalizar el trabajo de investigación y encontramos una pequeña disminución (Asperllilium sp, Fusarium sp, Mucor Sp, Rhizopus sp y Penicillium sp)esto probablemente se deba a la mayor cantidad y diversidad de aplicación de EM, asi se pudo establecer que el aire no tiene una microflora definida, una de las razones es que el aire es portador de polvo, material particulado, etc, los cuales pueden estar cargados de microbios.
b. Hongos en el Suelo.
preparación del hongo al microscopio y estudiar sus características tales como: morfología de las hifas, presencia o ausencia de septos, ramificaciones, tipo de esporas.
Los hongos identificados antes y después de la aplicación de EM, se puede apreciar que al inicio del trabajo sin ningún tipo de aplicación logramos identificar una mayor cantidad de hongos en el suelo así como (Alternaria sp,Beltrania sp, Cercospora sp, Colletotrichum sp, Curvularia sp, Fusarium sp ,Phytophthora sp, Rhizoctonia sp, Verticlium sp,
Stemphylium sp, Sclerotium sp) se pudo observar que existió una mayor cantidad de hongos identificados en el suelo.